Proteinfordøyelse. Funksjoner av prosessen med assimilering av matvarer
All mat er hovedsakelig sammensatt av proteiner, karbohydrater og lipider. Under fordøyelsen i mage-tarmkanalen til pattedyr gjennomgår de tre hovedkomponentene i maten: karbohydrater, fett og proteiner enzymatisk hydrolyse, og brytes ned til deres byggesteiner som de er dannet av. Denne prosessen er nødvendig for avhending av mat, siden cellene i tarmene bare er i stand til å absorbere relativt små molekyler i blodet. Assimilering av polysakkarider og til og med disakkarider blir mulig først etter fullstendig hydrolyse av fordøyelsesenzymer til monosakkarider. På samme måte må proteiner og lipider også hydrolyseres til byggesteinene de er bygget av.
Fordøyelsesprosessen begynner med munnen og magen, mens de siste stadiene av fordøyelsen av alle hovedkomponentene i mat og absorpsjon i blodet av deres strukturelle blokker skjer i tynntarmen. Anatomisk er tynntarmen godt egnet for denne funksjonen, da den har en svært stort område overflaten som absorpsjon skjer gjennom. Tynntarmen kjennetegnes ikke bare av sin store lengde (≈ 4,5 m), men også av tilstedeværelsen på dens indre overflate av mange folder med et stort antall fingerlignende fremspring kalt villi. Hver villus er dekket med epitelceller som bærer mange mikrovilli. Villi skaper en enorm overflate som fordøyelsesproduktene raskt transporteres til epitelcellene, og fra dem til kapillærene i sirkulasjonssystemet og til lymfekarene som ligger i tarmveggen. Overflatearealet til den menneskelige tynntarmen er ≈ 180 m2, dvs. bare litt mindre enn en lekeplass på en tennisbane.
Mikrovilli inneholder bunter av aktin-mikrofilamenter koblet ved bunnen av mikrovilli med et nettverk av myosinfilamenter. Dette filamentsystemet gir bølgende mikrovilli for lokal blanding og bedre absorpsjon av fordøyde næringsstoffer.
Proteinfordøyelse
Matproteiner brytes ned av enzymer i mage-tarmkanalen til deres konstituerende aminosyrer (fig. 1.1). Proteiner som kommer inn i magesekken stimulerer utskillelsen av hormonet gastrin, som igjen forårsaker utskillelse av saltsyre fra parietalcellene i kjertlene i mageslimhinnen, samt pepsinogen fra hovedcellene. Magesaft har en pH på 1,5 til 2,5. På grunn av denne surheten fungerer den som et antiseptisk middel, og dreper de fleste bakterier og andre celler. I tillegg, under forhold med lav pH i magesaft, gjennomgår globulære proteiner denaturering, molekylene deres utfolder seg, og som et resultat blir de interne peptidbindingene til polypeptidkjedene mer tilgjengelige for enzymatisk hydrolyse. Pepsinogen, som er en inaktiv enzymforløper, eller zymogen, omdannes i magesaft til aktivt pepsin som et resultat av den enzymatiske virkningen til selve pepsin, dvs. ved autokatalyse. Under denne prosessen, 42
|
Aktivitet |
|
|
(C.F. 3.4.4.1) |
Tyr, Phe, Tgr, Leu, Glu, Gln |
|
(C.F. 3.4.4.4) |
Angriper peptidbindinger dannet av: Lys, Arg |
|
Chymotrypsin (C.F. 3.4.4.5) |
Angriper peptidbindinger dannet av: Tyr, Phe, Tr s |
|
Karboksypeptidase (C.F. 3.4.2.1) |
Sekvensiell spalting av C-terminale rester |
|
Aminopeptidase (C.F. 3.4.1.1) |
Sekvensiell spalting av N-terminale rester |
Ris. 1.1. – Fordøyelse av proteiner: 1 – proteolytiske enzymer
aminosyrerester som en blanding av korte peptider. Resten av pepsinogenmolekylet som forblir intakt er det enzymatisk aktive pepsinet (EC 3.4.4.1). I magen hydrolyserer pepsin de peptidbindingene i proteiner som dannes av aromatiske aminosyrer: tyrosin, fenylalanin og tryptofan, samt en rekke andre; som et resultat dannes en blanding av kortere peptider fra lange polypeptidkjeder.
Så snart det sure innholdet i magen kommer inn i tynntarmen, begynner utskillelsen av hormonet sekretin, som kommer inn i blodet, i den under påvirkning av lav pH. Dette hormonet stimulerer på sin side frigjøringen av bikarbonat fra bukspyttkjertelen til tynntarmen, noe som fører til nøytralisering av gastrisk HC1. Som et resultat stiger pH kraftig fra 1,5–2,5 til ≈ 7. Proteinfordøyelsen fortsetter i tynntarmen. Inntreden av aminosyrer i tolvfingertarmen forårsaker frigjøring av hormonet kolecystokinin, som stimulerer utskillelsen av flere bukspyttkjertelenzymer med en optimal pH på ca. 7. Tre av dem: trypsin (EC 3.4.4.4), chymotrpsin (EC 3.4.4.5) ) og karboksypeptidase (EC 3.4.2.1) - produseres av eksokrine celler i bukspyttkjertelen i form av enzymatisk inaktive zymogener: henholdsvis trypsinogen, chymotrypsinogen og procarboxypeptidase. På grunn av syntesen av proteolytiske enzymer i form av inaktive forløpere, blir ikke eksokrine celler ødelagt av disse enzymene. En gang i tynntarmen blir trypsinogen, under påvirkning av enterokinase, et spesialisert proteolytisk enzym utskilt av celler i tarmepitel, omdannet til en aktiv form - trypsin. Fritt trypsin, slik det dannes, deltar også i den katalytiske omdannelsen av trypsinogen til trypsin. Dannelsen av fritt trypsin skyldes spaltningen av heksapeptidet fra N-terminalen av trypsinogen polypeptidkjeden.
Det aktive senteret av trypsin består av tre aminosyrerester: serin-195 (det er akseptert at nummereringen av aminosyrerester i trypsin tilsvarer deres posisjoner i proenzymet), histidin-57 og asparaginsyre-102. Sorpsjonsstedet inneholder karboksylgruppen til asparaginsyre-189, som bestemmer spesifisiteten til trypsin til positivt ladede substrater. Mekanismen for katalytisk hydrolyse inkluderer substratsorpsjonsstadiet, peptidbindingsspalting for å danne et acylenzym og overføring av en acylgruppe til en nukleofil akseptor. Trypsin hydrolyserer peptidbindinger dannet med deltakelse av karbonylgrupper av lysin og arginin.
Kymotrypsinogen-molekylet er en enkelt polypeptidkjede med flere intrakjede disulfidbindinger. En gang i tynntarmen blir chymotrypsinogen omdannet til chymotrypsin ved virkningen av trypsin, som bryter den lange polypeptidkjeden av chymotrypsinogen på to steder, og kutter ut dipeptider. De tre fragmentene dannet fra den opprinnelige chymotrypsinogenkjeden holdes imidlertid sammen av kryssdisulfidbindinger. Chymotrypsin hydrolyserer peptidbindinger dannet av fenylalanin-, tyrosin- og tryptofanrester. Derfor bryter trypsin og chymotrypsin ned polypeptidene som dannes i magen under påvirkning av pepsin til mindre peptider. Dette stadiet av proteinfordøyelsen fortsetter med en meget høy effektivitet, siden pepsin, trypsin og chymotrypsin viser forskjellige spesifisiteter i hydrolysen av polypeptidkjeder med hensyn til peptidbindinger dannet av forskjellige aminosyrer.
Nedbrytningen av korte peptider i tynntarmen utføres av andre peptidaser. Disse inkluderer først og fremst karboksypeptidase, et sinkholdig enzym syntetisert i bukspyttkjertelen som et inaktivt prokarboksypeptidasezymogen. Det aktive senteret av karboksypeptidase har form av en lomme, i hulrommet som det er et Zn-atom. Det aktive senteret inkluderer også rester av glutaminsyre, tyrosin og arginin. Funksjonen til sistnevnte i katalysemekanismen er bindingen av den C-terminale karboksylgruppen. Karboksypeptidase spalter sekvensielt C-terminale rester fra peptider.
Tynntarmen skiller også ut aminopeptidase (EC 3.4.1.1), som spalter N-terminale rester etter hverandre fra korte peptider.
Som et resultat av den sekvensielle virkningen av disse proteolytiske enzymene og peptidasene, blir fordøyde proteiner til slutt omdannet til en blanding av frie aminosyrer, som videre transporteres gjennom epitelcellene i tynntarmen. Frie aminosyrer trenger gjennom kapillærene i villi og føres med blodet til leveren.
I den menneskelige mage-tarmkanalen er ikke alle proteiner fullstendig fordøyd. De fleste animalske proteiner er nesten fullstendig hydrolysert til aminosyrer, men en rekke fibrillære proteiner, som keratin, blir bare delvis fordøyd. Mange proteiner fra plantemat, spesielt proteinene i korn, brytes ufullstendig ned på grunn av at proteindelen av frøene og kornene er dekket med et ufordøyelig celluloseskall (skall).
Den sjeldne sykdommen steatorrhea (vedvarende diaré) er kjent, der tarmens enzymer ikke er i stand til å fordøye visse vannløselige kornproteiner, spesielt gliadin, som skader tarmepitelceller. Kornprodukter er utelukket fra maten til slike pasienter. En annen sykdom assosiert med unormal aktivitet av proteolytiske enzymer i fordøyelseskanalen er akutt pankreatitt. I denne sykdommen, forårsaket av et brudd på prosessen med utskillelse av bukspyttkjerteljuice i tarmen, omdannes forløperne til proteolytiske enzymer (zymogener) til de tilsvarende katalytisk aktive former for tidlig, mens de fortsatt er inne i cellene i bukspyttkjertelen.
Som et resultat virker disse kraftige enzymene på selve kjertelens vev, og forårsaker dyp og veldig smertefull ødeleggelse av organet, noe som kan føre til døden. Normalt aktiveres ikke zymogener som skilles ut av bukspyttkjertelen før de når tynntarmen. Bukspyttkjertelen er beskyttet mot selvfordøyelse på en annen måte: den syntetiserer et spesielt protein - en spesifikk trypsinhemmer. Fordi fritt trypsin aktiverer ikke bare trypsinogen og chymotrypsinogen, men også zymogener til to andre fordøyelsesenzymer, prokarboksypeptidase og proelastase, forhindrer en trypsinhemmer for tidlig dannelse av frie proteolytiske enzymer i pankreasceller.
Karbohydratfordøyelse
Hos mennesker fordøyes hovedsakelig polysakkarider fra karbohydrater: stivelse og cellulose som finnes i plantemat. Stivelse brytes fullstendig ned av enzymer i mage-tarmkanalen til deres konstituerende strukturelle blokker, nemlig frie D-glukose (fig. 1.2). Denne prosessen begynner i munnen under tygging av mat på grunn av virkningen av enzymet amylase som skilles ut av spyttkjertlene. Spyttamylase hydrolyserer mange av α-(1→4)-glykosidbindingene i stivelse og glykogen. Dette danner en blanding bestående av maltose, glukose og oligosakkarider.
Fordøyelse av stivelse og andre fordøyelige polysakkarider for å danne D-glukose fortsetter og ender i tynntarmen, hovedsakelig under påvirkning av bukspyttkjertelamylase, som syntetiseres i bukspyttkjertelen og kommer inn gjennom bukspyttkjertelkanalen inn i den øvre tynntarmen. Denne delen av tynntarmen med høyest fordøyelsesaktivitet kalles tolvfingertarmen.
Cellulose i de fleste pattedyr blir ikke utsatt for enzymatisk hydrolyse og brukes ikke på grunn av mangel på enzymer som er i stand til å spalte β-(1→4)-bindinger mellom påfølgende rester D-glukose i cellulose. Samtidig skaper ufordøyd cellulose fra plantemat den massen (noen ganger kalt "fiber" eller "grovfôr") som bidrar til normal tarmmotilitet. Hos drøvtyggere fordøyes cellulose, men ikke direkte, men under påvirkning av bakterier i vommen (magen). Disse bakteriene hydrolyserer cellulose til D-glukose og ytterligere fermentert D-glukose til laktat, acetat og propionat, som absorberes og kommer inn i blodet. Videre omdannes laktat og propionat i leveren til drøvtyggere til blodsukker.
Hydrolysen av disakkarider katalyseres av enzymer som befinner seg i ytterkanten av epitelcellene i tynntarmen. Sukrose, eller rørsukker, hydrolyseres til dannelse D-glukose og D-fruktose under påvirkning av sukrase, også kalt invertase (K. F. 3.2.1.26); laktose hydrolyseres til D-glukose og D-galaktose ved virkningen av laktase, også kalt β-galaktosidase (EC 3.2.1.23); som et resultat av hydrolyse av maltose ved påvirkning av maltase, dannes to molekyler D-glukose. Mange representanter for asiatiske og afrikanske raser i voksen alder er preget av laktoseintoleranse, på grunn av forsvinningen av laktaseaktivitet i tynntarmen, som var til stede i spedbarn og barndom. Hos personer med laktoseintoleranse forblir dette sukkeret intakt i tarmene og en del av det fermenteres av mikroorganismer. Dette forårsaker diaré og gassdannelse i tarmen.
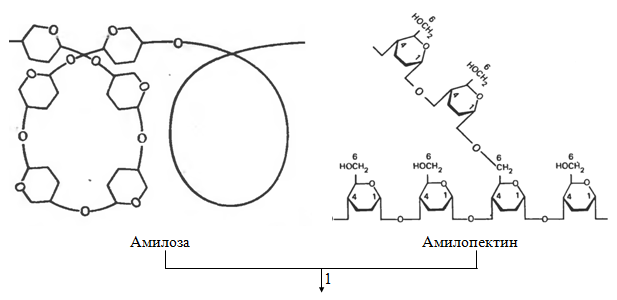
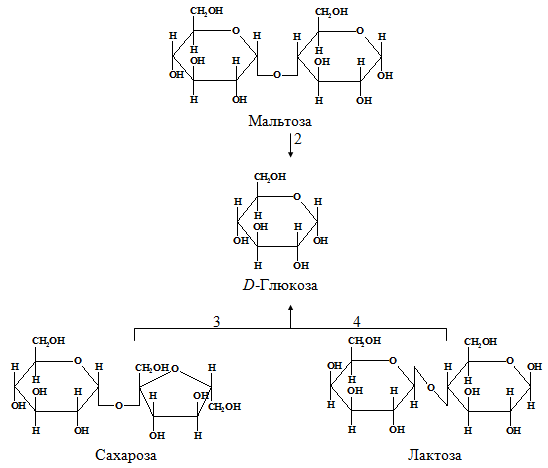
Ris. 1.2. - Fordøyelse av karbohydrater: 1 og 2 - amylolytiske enzymer; 3 - sukrase (C.F. 3.2.1.26); 4 - laktase (K. F. 3.2.1.23)
Epitelcellene som kler tynntarmen D-fruktose, D-ralaktose og D-mannose er delvis omdannet til D-glukose. En blanding av alle disse enkle heksosene tas opp av epitelcellene i tynntarmen og føres med blodet til leveren.
Fett fordøyelse
Fordøyelsen av triacylglyceroler (nøytrale fettstoffer) begynner i tynntarmen, hvor zymogen prolipase kommer inn fra bukspyttkjertelen. Her omdannes prolipase til aktiv lipase (EC 3.1.1.3), som i nærvær av gallesyrer og et spesielt protein kalt kolipase, fester seg til triacylglyceroldråper og katalyserer den hydrolytiske spaltningen av en eller begge ekstreme fettsyrerester med dannelsen av en blanding av gratis fettsyrer i form av deres Na + - eller K + -salter (såper) og 2-monoacylglyceroler. En liten mengde triacylglyceroler forblir ikke-hydrolysert (fig. 1.3).

Fettsyre
Ris. – 1.3. Lipidfordøyelse: 1 - lipase (EC 3.1.1.3), gallesyrer, Na +
De resulterende såpene og ikke-spaltede acylglycerolene emulgeres som små dråper ved peristaltikk (rørende tarmbevegelser) samt av gallesalter og monoacylglyceroler, som er amfipatiske forbindelser og derfor fungerer som vaskemidler. Fettsyrer og monoacylglyceroler fra disse dråpene absorberes av tarmceller, hvor triacylglyceroler hovedsakelig syntetiseres igjen fra dem. Videre trenger ikke triacylglyceroler inn i blodkapillærene, men inn i små lymfekar i tarmvilli - lacteals (ellers - melkeaktige eller chylous kar). Lymfen som strømmer fra tynntarmen, kalt chyle (melkeaktig juice), etter å ha fordøyd fet mat, ligner melk i utseende på grunn av overfloden av chylomikroner suspendert i den - de minste dråpene av emulgerte triacylglyceroler med en diameter på omtrent 1 mikron. Chylomikroner har et hydrofilt skall, bestående av follipider og et spesielt protein som holder chylomikroner i suspensjon. Chylomikroner passerer gjennom thoraxkanalen inn i venen subclavia. Etter inntak av fet mat blir til og med blodplasmaet opaliserende på grunn av den høye konsentrasjonen av chylomikroner i det, men denne opalescensen forsvinner etter 1-2 timer, fordi. triacylglyseroler skilles ut fra blodet, og kommer hovedsakelig inn i fettvev.
Emulgering og fordøyelse av lipider i tynntarmen blir hjulpet av gallesalter. Humane gallesalter er hovedsakelig natriumglykokolat og natriumtaurocholat, som begge er derivater av kolsyre, som kvantitativt dominerer blant de fire viktigste gallesyrene som finnes i menneskekroppen. Gallesalter er kraftige emulgatorer; de kommer fra leveren til gallen, som helles i den øvre tynntarmen. Etter at absorpsjonen av fettsyrer og monoacylglyceroler fra emulgerte fettdråper i nedre del av tynntarmen er fullført, blir også gallesaltene som bidro til denne prosessen reabsorbert. De går tilbake til leveren og blir gjenbrukt. Dermed sirkulerer gallesyrer konstant mellom leveren og tynntarmen.
Gallesyrer spiller utelukkende viktig rolle i assimilering av ikke bare triacylglyceroler, men generelt alle fettløselige matkomponenter. Hvis gallesyrer produseres eller skilles ut i utilstrekkelige mengder, slik det forekommer ved en rekke sykdommer, vises ufordøyd og uabsorbert fett i avføringen. Samtidig forverres absorpsjonen av fettløselige vitaminer A, D, E og K og ernæringsmessig mangel på vitamin A kan oppstå.
De nedbrutte næringsstoffene i blodet transporteres til leveren. I leverceller - hepatocytter, glukose, aminosyrer og frie fettsyrer er inkludert i kroppens metabolske prosesser.
Dermed utføres prosessen med assimilering av matprodukter hos pattedyr i mage-tarmkanalen og er basert på enzymatisk syrehydrolyse:
polysakkarider (stivelse og cellulose) til di- og monosakkarider,
proteiner til aminosyrer
lipider til fettsyrer, etterfulgt av absorpsjon av cellene i tynntarmen inn i blodet, flyter med blodet til leveren og inkludering i kroppens metabolske prosesser.
i mage-tarmkanalen under påvirkning av proteaseenzymer (peptidscrolase). Substratspesifisiteten til disse enzymene ligger i det faktum at hver av dem spalter peptidbindingene dannet av visse aminosyrer med høyest hastighet. Proteaser som hydrolyserer peptidbindinger i et proteinmolekyl tilhører gruppen av endopeptidaser. Enzymer som tilhører gruppen av eksopeptidaser hydrolyserer peptidbindingen dannet av terminale aminosyrer. Under påvirkning av alle proteaser i mage-tarmkanalen brytes matproteiner ned til individuelle aminosyrer, som deretter kommer inn i vevscellene.
A. Fordøyelse av proteiner i magen
Magesaft er et produkt av flere typer celler. Slimhinnen (parietale) cellene i veggene i magen danner saltsyre, hovedcellene skiller ut pepsinogen. Ytterligere og andre celler i epitelet i magen skiller ut slim som inneholder slim. Parietalceller skiller også ut et glykoprotein i magehulen, som kalles "intrinsic factor" (Castle factor). Dette proteinet binder den "ytre faktoren" - vitamin B 12, forhindrer dens ødeleggelse og fremmer absorpsjon.
1. Dannelse og rolle for saltsyre
Den viktigste fordøyelsesfunksjonen til magen er at fordøyelsen av protein begynner i den. Saltsyre spiller en viktig rolle i denne prosessen. Proteiner som kommer inn i magen stimulerer utskillelsen histamin og grupper av proteinhormoner - gastriner(se avsnitt 11), som igjen forårsaker sekresjon av HCI og proenzymet pepsinogen. HCI dannes i parietalcellene i magekjertlene under reaksjonene vist i fig. 9-2.
Kilden til H + er H 2 CO 3, som dannes i parietalcellene i magen fra CO 2 som diffunderer fra blodet, og H 2 O under påvirkning av enzymet karbonsyreanhydrase (karbonatdehydratase):
H 2 O + CO 2 → H 2 CO 3 → HCO 3 - + H+
Dissosiasjonen av H 2 CO 3 fører til dannelse av bikarbonat, som, med deltakelse av spesielle proteiner, frigjøres til plasmaet i bytte mot C1 - og H + ioner, som kommer inn i magelumen gjennom aktiv transport katalysert av membranen H + / K + -ATPase. I dette tilfellet øker konsentrasjonen av protoner i lumen i magen med 10 6 ganger. Ioner C1 - kommer inn i lumen i magen gjennom kloridkanalen.
Konsentrasjonen av HCl i magesaft kan nå 0,16 M, på grunn av hvilken pH-verdien synker til 1,0-2,0. Inntaket av proteinmat er ofte ledsaget av frigjøring av alkalisk urin på grunn av sekresjon. et stort antall bikarbonat under dannelsen av HCl.
Ris. 9-2. Utskillelse av saltsyre i magen. 1 - karbonsyreanhydrase; 2 - H+/K+ - ATP-ase; 3 - anionbærerproteiner; 4 - kloridkanal.
Under virkningen av HCl, denaturering av matproteiner som ikke har gjennomgått varmebehandling, som øker tilgjengeligheten av peptidbindinger for proteaser. HCl virker bakteriedrepende og hindrer patogene bakterier i å komme inn i tarmen. I tillegg aktiverer saltsyre pepsinogen og skaper en optimal pH for virkningen av pepsin.
2. Pepsin aktiveringsmekanisme
Under virkningen av gastriner i hovedcellene i magekjertlene, stimuleres syntesen og sekresjonen av pepsinogen, en inaktiv form for pepsin. Pepsinogen er et protein som består av en enkelt polypeptidkjede med en molekylvekt på 40 kD. Under påvirkning av HCl omdannes det til aktivt pepsin (molekylvekt 32,7 kD) med en optimal pH på 1,0-2,5. Under aktivering, som et resultat av delvis proteolyse, spaltes 42 aminosyrerester fra N-terminalen av pepsinogenmolekylet, som inneholder nesten alle positivt ladede aminosyrer som finnes i pepsinogen. Således er negativt ladede aminosyrer, som er involvert i konformasjonsrearrangementene av molekylet og dannelsen av det aktive senteret, dominerende i aktivt pepsin. De aktive pepsinmolekylene dannet under virkningen av HCl aktiverer raskt de gjenværende pepsinogenmolekylene (autokatalyse). Pepsin hydrolyserer først og fremst peptidbindinger i proteiner dannet av aromatiske aminosyrer (fenylalanin, tryptofan, tyrosin) og noe langsommere - dannet av leucin og dikarboksylaminosyrer. Pepsin er en endopeptidase, derfor dannes kortere peptider i magen som et resultat av dens virkning, men ikke frie aminosyrer.
3. Alderstrekk ved proteinfordøyelsen i magen
Hos spedbarn inneholder magen et enzym rennin(chymosin), som får melk til å koagulere. Hovedproteinet i melk er kasein, som er en blanding av flere proteiner som er forskjellige i aminosyresammensetning og elektroforetisk mobilitet. Rennin katalyserer spaltningen av et glykopeptid fra kasein, noe som resulterer i dannelsen av parakasein. Parakasein fester Ca 2+ ioner, og danner en uløselig koagel, som forhindrer rask utgang av melk fra magen. Proteiner har tid til å brytes ned under virkningen av pepsin. Det er ikke noe rennin i magen til voksne; melken deres er støpt under påvirkning av HCl og pepsin.
I slimhinnen i menneskets mage ble det funnet en annen protease - gastrixin. Alle 3 enzymer (pepsin, rennin og gastrixin) er like i primær struktur, noe som indikerer deres opprinnelse fra et felles forløpergen.
4. Forstyrrelser av proteinfordøyelsen i magen
Ved ulike sykdommer i mage-tarmkanalen i magen forstyrres frigjøringen av HCl og pepsinogen, mens fordøyelsen av proteiner reduseres markant. De vanligste patologiske endringene i surheten til magesaft. Brudd på dannelsen av pepsin noteres sjeldnere og oppdages med mer betydelige lesjoner i magen.
Bestemmelse av surheten til magesaft brukes til å diagnostisere ulike sykdommer i magen (tabell 9-2). Surhet magesaft er vanligvis ledsaget av halsbrann, diaré og kan være et symptom på magesår og duodenalsår, samt hyperacid gastritt. Redusert surhet oppstår med visse typer gastritt. Fullstendig fravær av HCl og pepsin (gastrisk achilia) observeres ved atrofisk gastritt og er ofte ledsaget av pernisiøs anemi på grunn av utilstrekkelig produksjon av Castle-faktoren og malabsorpsjon av vitamin B 12 (se avsnitt 3). Surhet(mage-pH>6,0) indikerer et betydelig tap av mageslimhinnen i parietalceller som skiller ut saltsyre, som ofte forårsaker magekreft.
Surheten til magesaft uttrykkes i titreringsenheter (TU) - mengden 0,1 M NaOH per 1 ml brukt på titrering av 100 ml magesaft i henhold til en viss indikator. Ved bestemmelse av surheten til magesaft er det: total surhet, bundet HCl og fri HCl.
- Generell surhet av magesaft - totalen av alle syre-reaktive stoffer i magesaft er hemmeligheten til magen, samlet innen 1 time.
Tabell 9-2. Komponenter av magesaft under normale og patologiske forhold
| Stat | pH | Surhet (TE) | Pepsin | Slottsfaktoren | Melkesyre | Blod | ||
| generell | bundet HCl | fri HCl | ||||||
| Norm | 1,5-2,0 | 40-60 | 20-30 | 20-40 | + | + | - | - |
| Hyperacid gastritt | 1,0 | 80 | 40 | + | ± | - | - | |
| Hypoacid gastritt | 2,5 | 40 | 20 | ± | ± | ± | - | |
| Achilia | 7,0 | 20 | - | - | - | + | - | |
| magesår | 1,5 | 60 | 40 | + | + | - | + | |
| Magekreft | 6,0 og> |
40-60 | 20 | + | + | + | + | |
Verdiene for total surhet er normalt 40-60 TU.
- Assosiert saltsyre- HCl assosiert med proteiner og deres fordøyelsesprodukter. Verdiene av bundet HCl hos friske mennesker er 20-30 TU.
- Fri HCl- saltsyre, ikke assosiert med komponentene i magesaft. Verdiene av fri Hcl er normale - 20-40 TE. normal mage-pH 1,5-2,0.
Melkesyre er normalt fraværende i magesaft. Det dannes med en reduksjon i innholdet eller fraværet av fri saltsyre som et resultat av multiplikasjonen av melkesyrebakterier eller i ondartede svulster i magen, i cellene hvor glukose oksideres anaerobt.
Ved diagnostisering av sykdommer i magen, i tillegg til biokjemiske analyser, er røntgen- og endoskopiske studier, samt en biopsi, obligatorisk.
B. Fordøyelse av proteiner i tarmen
Mageinnhold (chyme) i prosessen med fordøyelsen kommer inn i tolvfingertarmen. Den lave pH-verdien i chymen forårsaker utskillelse av proteinhormonet sekretin i tarmen, som kommer inn i blodet. Dette hormonet stimulerer i sin tur utskillelsen av bukspyttkjerteljuice som inneholder HCO 3 - fra bukspyttkjertelen inn i tynntarmen, noe som fører til nøytralisering av mage-HCl og hemming av pepsin. Som et resultat øker pH kraftig fra 1,5-2,0 til ~7,0.
Inntrengning av peptider i tynntarmen forårsaker utskillelse av et annet proteinhormon - kolecystokinin (se avsnitt 11), som stimulerer frigjøringen av bukspyttkjertelenzymer med en optimal pH på 7,5-8,0. Under påvirkning av bukspyttkjertelenzymer og tarmceller fullføres fordøyelsen av proteiner.
1. Aktivering av bukspyttkjertelenzymer
Proenzymer av en rekke proteaser syntetiseres i bukspyttkjertelen: trypsinogen, chymotrypsinogen, proelastase, prokarboksypeptidaser A og B. I tarmen omdannes de ved delvis proteolyse til de aktive enzymene trypsin, kymotrypsin, elastase og karboksypeptidaser.
Trypsinogenaktivering oppstår under påvirkning av tarmepitel enzymet enteropeptidase.
Dette enzymet spalter heksapeptidet Val-(Asp)4-Lys fra N-terminalen til trypsinogenmolekylet. En endring i konformasjonen av den gjenværende delen av polypeptidkjeden fører til dannelsen av et aktivt senter, og aktivt trypsin dannes. Val-(Asp)4-Lys-sekvensen er iboende i de fleste kjente trypsinogener i forskjellige organismer, fra fisk til mennesker.
Det resulterende trypsin aktiverer chymotrypsinogen, hvorfra flere aktive enzymer oppnås (fig. 9-3). Chymotrypsinogen består av en enkelt polypeptidkjede som inneholder 245 aminosyrerester og fem disulfidbroer. Under påvirkning av trypsin spaltes peptidbindingen mellom den 15. og 16. aminosyren, noe som resulterer i dannelsen av aktivt π-chymotrypsin. Deretter, under påvirkning av π-chymotrypsin, blir dipeptidet ser(14)-arg(15) spaltet av, noe som fører til dannelsen av δ-chymotrypsin. Spaltning av dipeptidet tre(147)-arg(148) fullfører dannelsen av en stabil form av det aktive enzymet, α-chymotrypsin, som består av tre polypeptidkjeder forbundet med disulfidbroer.
De gjenværende proenzymene til bukspyttkjertelproteaser (proelastase og prokarboksypeptidase A og B) aktiveres også av trypsin gjennom delvis proteolyse. Som et resultat dannes aktive enzymer - elastase og karboksypeptidaser A og B.
2. Spesifisitet av virkning av proteaser
Trypsin hydrolyserer fortrinnsvis peptidbindinger dannet av karboksylgrupper av arginin og lysin. Kymotrypsiner er mest aktive mot peptidbindinger dannet av karboksylgrupper av aromatiske aminosyrer (Phen, Tyr, Tri).
Karboksypeptidaser A og B er sinkholdige enzymer som spalter C-terminale aminosyrerester. Dessuten, karboksypeptidase A

Ris. 9-3. Aktivering av chymotrypsinogen. Kymotrypsinogenmolekylet består av 245 aminosyrerester og har fem disulfidbroer. Diagrammet viser regionene til enzymet som gjennomgår proteolyse. a-Chymotrypsin - en aktiv stabil form av enzymet - består av tre polypeptidkjeder kovalent knyttet til hverandre av to disulfidbroer og ikke-kovalent - pga. hydrogenbindinger og hydrofobe interaksjoner.
spalter hovedsakelig aminosyrer som inneholder aromatiske eller hydrofobe radikaler, og karboksypeptidase B - arginin- og lysinrester.
Det siste stadiet av fordøyelsen - hydrolysen av små peptider, skjer under påvirkning av enzymene aminopeptidaser og dipeptidaser, som syntetiseres av cellene i tynntarmen i en aktiv form.
- Aminopeptidaser sekvensielt spalte de N-terminale aminosyrene i peptidkjeden. Det mest kjente leucinaminopeptidase - Zn 2+ - eller Mn 2+ -holdige enzym, til tross for navnet, har en bred spesifisitet med hensyn til N-terminale aminosyrer.
- Dipeptidaser bryte ned dipeptider til aminosyrer, men virker ikke på tripeptider.
Som et resultat av den sekvensielle virkningen av alle fordøyelsesproteaser, brytes de fleste matproteiner ned til frie aminosyrer.
B. Beskyttelse av celler fra virkningen av proteaser
Bukspyttkjertelceller er beskyttet mot virkningen av fordøyelsesenzymer ved:
- disse enzymene dannet som inaktive forløpere i cellene i bukspyttkjertelen og aktiveres først etter sekresjon i tarmlumen. Således er syntesestedet og virkningsstedet for disse enzymene romlig atskilt.
- finnes i bukspyttkjertelceller trypsinhemmer protein danner et sterkt kompleks med den aktive formen av enzymet (i tilfelle for tidlig aktivering).
I hulrommet i magen og tarmene kommer ikke proteaser i kontakt med celleproteiner, siden slimhinnen er dekket med et slimlag, og hver celle inneholder polysakkarider på den ytre overflaten av plasmamembranen, som ikke spaltes av proteaser og derved beskytte cellen mot deres virkning.
Ødeleggelsen av cellulære proteiner av proteaser skjer med magesår i magen eller tolvfingertarmen. Imidlertid er de første mekanismene for sårdannelse fortsatt dårlig forstått.
D. Transport av aminosyrer inn i cellene
Aminosyrer dannet under fordøyelsen av proteiner absorberes raskt i tarmen. Transporten deres utføres på to måter: gjennom portalsystemet i leveren, som fører direkte til leveren, og gjennom lymfekarene som kommuniserer med blodet gjennom thorax lymfekanalen. Maksimal konsentrasjon av aminosyrer i blodet nås 30-50 minutter etter proteininntak (karbohydrater og fett bremser opptaket av aminosyrer). Absorpsjonen av L-aminosyrer (men ikke D-isomerer) er en aktiv prosess som krever energiforbruk. Aminosyrer overføres gjennom tarmveggen fra slimoverflaten til blodet (fig. 9-4). Overføring over børstegrensen formidles av en rekke transportører, hvorav mange opererer gjennom Na+-avhengige symportmekanismer, som ligner på glukoseoverføring (se avsnitt 7).
De forskjellige hastighetene for aminosyrepenetrasjon gjennom cellemembraner indikerer tilstedeværelsen av transportsystemer som sikrer overføring av aminosyrer både gjennom den ytre plasmamembranen og gjennom intracellulære membraner. For tiden er minst fem spesifikke transportsystemer kjent, som hver fungerer
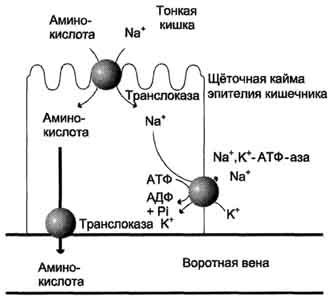
Ris. 9-4. Mekanisme for absorpsjon av aminosyrer i tarmen. L-aminosyre går inn i enterocytten ved å symportere med Na + ion. Videre overfører en spesifikk translokase aminosyren over membranen til blodet. Utvekslingen av natriumioner mellom celler utføres ved primær aktiv transport ved hjelp av Na +, K + -ATPase.
for overføring av en viss gruppe av lignende aminosyrer i struktur:
- nøytral, med en kort sidekjede (alanin, serie, treonin);
- nøytral, med en lang eller forgrenet sidekjede (valin, leucin, isoleucin);
- med kationiske radikaler (lysin, arginin);
- med anioniske radikaler (glutaminsyre og asparaginsyre);
- iminosyrer (prolin, hydroksyprolin).
Dessuten er bærerne av aminosyrer inkludert i den første og femte gruppen, så vel som bæreren av metionin, blant de Na+-avhengige. Na + uavhengige bærere er spesifikke for noen nøytrale aminosyrer (fenylalanin, leucin) og aminosyrer med kationiske radikaler (lysin).
Aminosyrer konkurrerer med hverandre om spesifikke bindingssteder. For eksempel reduserer absorpsjonen av leucin (hvis konsentrasjonen er høy nok) absorpsjonen av isoleucin og valin.
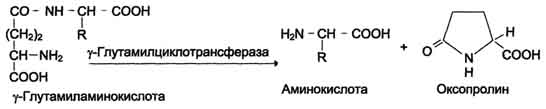
Et av de spesifikke transportsystemene for noen nøytrale aminosyrer fungerer i tarmene, nyrene og tilsynelatende hjernen. Det kalles γ-glutamylsyklusen (fig. 9-5).
Dette systemet involverer 6 enzymer, hvorav den ene er lokalisert i cellemembranen, og resten - i cytosolen. Nøkkelrollen i aminosyretransport spilles av det membranbundne enzymet γ -glutamyltransferase. Dette enzymet er et glykoprotein og katalyserer overføringen av γ-glutamylgruppen fra glutation (noen ganger et annet γ-glutamylpeptid) til den transporterte aminosyren og den påfølgende overføringen av komplekset inn i cellen. Glutation er et tripeptid - γ-glutamylcysteinylglycin, som finnes i alt dyrevev. Reaksjonen fortsetter som følger (se skjema A på s. 468).
Aminosyren bundet til y-glutamylresten er inne i cellen. I neste reaksjon spaltes y-glutamyl

Ris. 9-5.γ -Glutamylsyklus. Systemet består av en membran og fem cytoplasmatiske enzymer. Overføringen av aminosyren til cellen utføres i kombinasjon med glutamylresten av glutation under påvirkning av y-glutamyltransferase. Deretter frigjøres aminosyren, og γ-glutamylresten omdannes i flere trinn til glutation, som er i stand til å feste neste aminosyremolekyl. E 1 - y-glutamyltransferase; E2-y-glutamylcyklotransferase; E3 - peptidase; E4 - oksoprolinase; E 5 - y-glutamylcystein syntetase; E 6 - glutationsyntetase.
rest under påvirkning av enzymet y-glutamylcyklotransferase (se skjema B).
Dipeptidet cysteinylglycin spaltes av peptidase til 2 aminosyrer - cystein og glycin. Som et resultat av disse 3 reaksjonene overføres ett aminosyremolekyl til cellen (eller intracellulær struktur). Følgende 3 reaksjoner sikrer regenerering av glutation, på grunn av hvilken syklusen gjentas mange ganger. For transport av ett aminosyremolekyl inn i cellen med deltakelse av y-glutamylsyklusen, brukes 3 ATP-molekyler.
D. Brudd på proteinfordøyelse og aminosyretransport
En liten andel av proteinfordøyelsesprodukter er ikke-hydrolyserte korte peptider. Noen mennesker har en immunrespons på proteininntak, som tilsynelatende er relatert til evnen til å absorbere
slike peptider. Produktene av et fullstendig fordøyd protein (aminosyrer) er blottet for antigene egenskaper og forårsaker ikke immunreaksjoner.
Hos nyfødte er permeabiliteten til tarmslimhinnen høyere enn hos voksne, så råmelkantistoffer (hemmeligheten til brystkjertlene frigjort de første dagene etter fødselen, beriket med antistoffer og antitoksiner) kan komme inn i blodet. Dette forverres av tilstedeværelsen av trypsinhemmerprotein i råmelk. Proteolytiske enzymer i fordøyelsessekretet til nyfødte har lav aktivitet. Alle disse bidrar til intestinal absorpsjon. en liten mengde native proteiner tilstrekkelig til å gi en immunrespons. Åpenbart er denne økningen i absorpsjonskapasiteten til tarmen årsaken til den noen ganger observerte intoleransen mot matproteiner (for eksempel melk og egg) hos voksne.
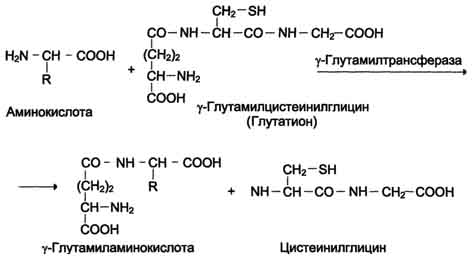
Opplegg A
Opplegg B
Flere og flere bevis blir gitt til hypotesen om at cøliaki (ikke-tropisk sprue) det er et brudd på cellene i tarmslimhinnen, hvor små ikke-hydrolyserte peptider absorberes. Cøliaki er preget av overfølsomhet for gluten, et glutenprotein i korn som konsumeres av mennesker. Dette proteinet har en giftig effekt på slimhinnen tynntarmen, som fører til patologiske endringer og malabsorpsjon. Patogenesen til sykdommen er ikke klar nok.
Sykdommer som f.eks cystinuri, sykdom Hartnap og noen andre, oppstår fra en defekt i nøytrale aminosyretransportører i tarmene og nyrene. En medfødt patologi assosiert med en defekt i enzymet 5-oksoprolinase er beskrevet (fig. 9-5, reaksjon 4). I dette tilfellet skilles oksoprolin ut i urinen. Hos disse pasientene er transporten av aminosyrer inn i vev og deres metabolisme i cellene svekket.
Matproteiner i munnhulen brytes ikke ned, siden spytt ikke inneholder hydrolytiske enzymer.
Kjemisk nedbrytning av proteiner begynner i magen under påvirkning av proteolytiske enzymer (peptidhydrolaser), som bryter ned peptidbindinger mellom aminosyrer.
Disse enzymene produseres av cellene i slimhinnen i magen, tynntarmen og bukspyttkjertelen i en inaktiv form. Denne formen for enzym hindrer selvfordøyelse av proteiner i cellene der de syntetiseres og veggene i mage-tarmkanalen (spesielt for de som fortsatt er i villrede med tanken om at magen fordøyer seg selv under faste).
I magen oppstår proteinfordøyelse med deltakelse av magesaftenzymet pepsin, som dannes av inaktivt pepsinogen under påvirkning av saltsyre. Pepsin viser maksimal enzymatisk aktivitet i et sterkt surt miljø ved pH 1-2. I tillegg, under påvirkning av saltsyre, oppstår hevelse og delvis denaturering av proteiner, noe som fører til en økning i kontaktoverflaten til enzymet med proteiner. Alt dette letter prosessen med proteinnedbrytning i magen. Pepsin spalter peptidbindingene til proteinmolekyler, noe som resulterer i dannelsen av høymolekylære peptider og protesegrupper.
Proteiner som ikke spaltes i tynntarmen gjennomgår spaltning i tykktarmen under påvirkning av peptidaser, som syntetiseres av mikrofloraen som ligger her. Enzymer av mikrofloraen i tykktarmen er i stand til å bryte ned mange aminosyrer i maten med dannelse av forskjellige giftige stoffer: fenol, kresol, indol, hydrogensulfid, merkaptaner, etc. En slik transformasjon av aminosyrer i tykktarmen kalles proteinforråtnelse. Giftige stoffer tas opp i blodet og leveres til leveren, hvor de avgiftes. Hele prosessen med proteinfordøyelse i mage-tarmkanalen tar i gjennomsnitt 8-12 timer etter å ha spist.
konklusjoner
Kilde
Fra alt det ovennevnte følger den åpenbare konklusjonen: det er uønsket å konsumere karbohydrater sammen med protein.
Det er en spesiell sphincter i magen, kalt pylorus, og den har en veldig interessant funksjon: å skille den pyloriske delen av magen fra ampulla i tolvfingertarmen og fungere som en regulator for strømmen av surt mageinnhold inn i tolvfingertarmen. ettersom den er klar til å motta de neste porsjonene chyme (matslurry).
Det skjedde slik at det sure miljøet i magen ikke endres, så vel som det alkaliske miljøet i tarmsaften. Derfor, ved å lage en vinaigrette, dømmer du deg selv til ett av følgende utfall:
1) Når pylorus ikke slipper mat inn i tarmen før proteinet er fordøyd, forsinker du ved å gjøre det flyten av glukose til blodet, og, mye verre, lar karbohydrater fermentere. Dette truer med nedbrytning av karbohydrater til karbondioksid, eddiksyre, alkohol - stoffer som ikke er egnet for absorpsjon.
2) Når det meste av maten som spises er karbohydrater, og blander dem grundig med protein, drar du det hele inn i tarmen på forhånd, noe som vil resultere i ytterligere råtning av proteinet i tykktarmen. Magen kjenner ikke mekanismen for å skille disse nøye blandede stoffene og plassere dem i forskjellige deler av hulrommet.
Det faktum at proteinforråtnelse konstant observeres i tykktarmen til en "sivilisert" person, betyr ikke at et slikt fenomen kan betraktes som normalt. Og forråtnelse er stinkende avføring, vanskelig avføring, oppblåst mage og gasser.
For å oppsummere, gjør følgende:
· Først av alt, spis alle karbohydrater, tygg veldig nøye, fordi. fordøyelsen vil begynne i munnen. På grunn av det sure miljøet i magen vil ikke karbohydrater forbli der i lang tid, når du starter proteindelen, vil hoveddelen av karbohydratene allerede falle ned i tarmen (for større pålitelighet er det bedre å ta en pause i 15-20 minutter).
· Fett, angående nøtter, søtsaker osv., spises best sammen med karbohydrater, fordi det er nødvendig med et alkalisk miljø og fordi lipider bremser magesekresjonen, og dermed hemmer fordøyelsen. I tilfelle hvor fett ikke kan skilles fra protein, for eksempel olje brukt i matlaging, kan denne sykdommen stoppes med rå grønne grønnsaker.
Proteiner er henholdsvis det siste tallet.
Ved å dele og spise mat i denne sekvensen slår du tre fluer i en smekk:
1. okkupere tarmene organisk materiale, som utfører en energifunksjon;
2. okkupere magen som de viktigste bærere av livet;
3. og det som er viktig, på denne måten kan du dumt spise mer (relevant ved periodisk faste).
Jeg oppfordrer ingen til å ta ordet i en lærebok i fysiologi, en lærebok i biokjemi, og enda mer, jeg personlig oppfordrer ingen, bare prøv det og gjør din egen mening.













