Kvalitativ og kvantitativ bestemmelse. §2. Kjemisk formel. Kvalitativ analyse av antroglykosider
J. Ya Berzelius foreslo å betegne kjemiske elementer med den første bokstaven i deres latinske navn. Dermed ble symbolet på oksygen den første bokstaven i dets latinske navn: oksygen - O (les "o", siden det latinske navnet på dette elementet er oksygenium). Følgelig mottok hydrogen symbolet - H (les "aske", siden det latinske navnet på dette elementet er hydrogenium), karbon - C (les "ce", siden det latinske navnet på dette elementet er karboneum). Men de latinske navnene for krom (krom), klor (klor) og kobber (cuprum), samt karbon, begynner med bokstaven "C". Hvordan kan dette være? J. Ya Berzelius foreslo en genial løsning: skriv slike symboler ikke med en, men med to bokstaver - den første og en av de etterfølgende bokstavene, oftest den andre. Dermed er krom betegnet Cr (les "krom"), klor er C1 (les "klor"), kobber er Cu (les "cuprum").
En annen halogenidentifikasjonsreaksjon er reaksjonen med sølvnitrat. For å indikere tilstedeværelsen av et halogen, dannes et hvitt eller gult sølvhalogenid. For å identifisere hvert halogenatom behandles det resulterende bunnfallet med ammoniumhydroksidløsning og følgende observasjoner gjøres.
Hvis bunnfallet er hvitt og lett oppløst i ammoniumhydroksid, inneholder stoffet klor. Hvis bunnfallet er hvit-gult og mer løselig i ammoniumhydroksid, inneholder det brom. Hvis bunnfallet er gult og uløselig i ammoniumhydroksid, inneholder det jod.
Russiske og latinske navn, tegn på de tjue kjemiske elementene som er mest brukt i skolen og deres uttale er gitt i tabell 2.
Tabell 2
Navn og symboler på noen kjemiske grunnstoffer
Bordet vårt har kun plass til 20 elementer. For å se alle 110 kjente grunnstoffer, må du se tabellen over kjemiske elementer av D.I.
Identifikasjon av halogener i sammensetningen organisk materiale planter. Nødvendige stoffer: konsentrert acidoasat; sølvnitrat, 2% løsning; tørket selleri eller bregneblader. Eksperiment: Spre tørket selleri eller bregneblader i en digel. Den resulterende asken utsettes for vandig ekstraksjon, separert på filterpapir. Gjenta om nødvendig filteroperasjonen på samme filter til en klar væske oppnås. Fra den filtrerte væsken, ta et rent reagensrør med et volum på 1-2 ml og surgjør det med noen dråper konsentrert salpetersyre.
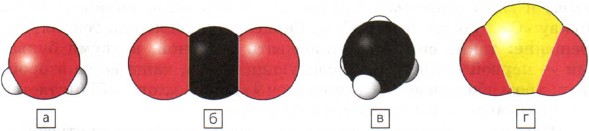
Oftest inneholder stoffer atomer av flere kjemiske elementer. Du kan skildre den minste partikkelen av et stoff, for eksempel et molekyl, ved å bruke kulemodeller som du gjorde i forrige leksjon. Figur 40 viser tredimensjonale modeller av molekyler av vann (a), karbondioksid (b), metan (c) og svoveldioksid (d).
Tilsett 3-4 dråper av en 2% sølvnitratløsning til blandingen. Utseendet til et hvitt bunnfall av sølvklorid indikerer tilstedeværelsen av klor i henhold til reaksjonen. Organisk kjemisk analyse gir oss metoder for å bestemme omfanget av forurensning og derfor iverksette beskyttelsestiltak. Noen plantevernmidler som er vanskelige å biologisk nedbryte kan samle seg i jorda, hvor de kan lekke ut til planter som poteter eller gulrøtter.
I en panne ekstraheres analytter fra poteter eller gulrøtter ved behandling med vanlig heksan. Separer løsningen ved å dekantere, tilsett noen dråper kaliumhydroksid, en vanlig alkoholløsning. Fordamp i vannbad til det er tørt. Etter hydrolyse løses den tørkede resten på nytt i noen få dråper karbontetraklorid. Rør og rist med 2 ml av en blanding av salpetersyre og svovelsyre.
Ris. 40.
Volumetriske modeller av molekyler:
a - vann; b - karbondioksid; c - metan; g - svoveldioksid
Kjemiske formler for stoffer er skrevet ved hjelp av symboler for kjemiske elementer og indekser. Indeksen viser hvor mange atomer av et gitt grunnstoff som er inkludert i molekylet til et stoff. Det er skrevet under til høyre for skiltet kjemisk element. For eksempel er formlene for stoffene vist i figur 40 skrevet som følger: a - H 2 O; b - CO 2; c - CH4; g - SO 2.
Elementær kvantitativ analyse
Fremstår som et hint grønn. Elementær kvantitativ analyse bestemmer prosentandelen av ulike komponenter av organisk materiale. Elementer oppnådd ved disaggregering av et stoff kan være volumetriske eller gravimetriske, hvis dosering er gjenstand for elementære metoder for kvantitativ analyse.
Bestemmelse av halogener krever nedbrytning av organisk materiale for å tilføre ionisk halogen og deretter dosere det gravimetrisk eller volumetrisk med sølvnitrat. Det er flere bestemmelsesmetoder i denne forbindelse. Når det gjelder flyktige organiske forbindelser, utføres bestemmelsen av halogener ved hjelp av Carius-metoden. Den enkleste og enkleste metoden for å bestemme halogener er Stepanov-metoden. Direkte identifikasjon av halogener fra organiske stoffer ved hjelp av Stepanovs metode er som følger.
Kjemisk formel- den viktigste ikoniske modellen i vår vitenskap. Hun bærer veldig viktig informasjon. Den kjemiske formelen viser:
høykvalitets komposisjon stoffer, dvs. atomer av hvilke elementer er inkludert i sammensetningen av dette stoffet;
kvantitativ sammensetning, dvs. hvor mange atomer av hvert grunnstoff er inkludert i molekylet til stoffet.
Formelen til et stoff kan også avgjøre om det er enkelt eller komplekst.
For eksempel er hydrogen H2, jern Fe, oksygen O2 enkle stoffer, og vann H2O, karbondioksid CO 2 og svovelsyre H 2 SO 4 - kompleks.
Spørsmål og oppgaver
- Hvilke kjemiske grunnstoffer har stor bokstav C i symbolene sine? Skriv dem ned og si dem.
- Fra tabell 2, skriv ned hver for seg tegnene til metallelementene og tegnene til ikke-metallelementene. Si navnene deres.
- Hva er den kjemiske formelen? Skriv formlene for følgende stoffer:
- a) svovelsyre, hvis det er kjent at molekylet inneholder to hydrogenatomer, ett svovelatom og fire oksygenatomer;
- b) hydrogensulfid, hvis molekyl består av to hydrogenatomer og ett svovelatom;
- c) svoveldioksid, et molekyl som inneholder ett svovelatom og to oksygenatomer.
Hva har alle disse stoffene til felles?
- Lag tredimensjonale modeller av molekyler av følgende stoffer fra plasticine:
- a) ammoniakk, hvis molekyl inneholder ett nitrogenatom og tre hydrogenatomer, plasserer hydrogenatomene i en vinkel på 110° i forhold til nitrogenatomet;
- b) hydrogenklorid, hvis molekyl består av ett hydrogenatom og ett kloratom;
- c) klor, hvis molekyl består av to kloratomer.
Skriv formlene til disse stoffene og les dem.
- Figur 40 viser modeller av molekyler på fire kjemikalier. Hvor mange kjemiske grunnstoffer danner disse stoffene? Gi dem et navn, skriv ned symbolene til disse elementene og si dem.
- Ta plasticine av fire farger. Rull de minste kulene hvit- Dette er modeller av hydrogenatomer, større røde kuler er modeller av oksygenatomer, svarte kuler er modeller av karbonatomer, og til slutt, de største gule kulene er modeller av svovelatomer. Lag tredimensjonale modeller av molekylene vist i figur 40.
ROSZHELDOR Statens utdanningsinstitusjon
høyere yrkesfaglig utdanning"Rostovsky statlig universitet kommunikasjonsmidler"
GENERELL KJEMI
Selvhjelpsopplæring
studentarbeid
Godkjent av universitetets metodologiske råd
Rostov ved Don
UDC 541(07) + 06
Generell kjemi: opplæringsmanual for selvstendig arbeid av studenter / Yu.F. Migal, S.B. Bulgarevich, V.N. Doronkin [osv.]; Høyde. tilstand Universitetet for kommunikasjon. – Rostov n/d, 2010. – 191 s. Bibliografi : 11 titler
Inneholder informasjon om hoveddelene av kurset generell kjemi: klasser av uorganiske forbindelser, kjemisk termodynamikk, hastighet av kjemiske reaksjoner, kjemisk likevekt, struktur av materie, løsninger, redoksreaksjoner, elektrokjemi, polymerer. Eksempler på løsning av typiske problemer, anvendte problemer om jernbanetemaer og diagrammer som viser logiske sammenhenger er gitt. kjemiske konsepter, og anbefalt lesing.
Læreboken er godkjent for publisering av Institutt for kjemi ved Russian State University of Pedagogical University og er beregnet på 1. års studenter av alle spesialiteter.
Anmeldere: Dr. Chem.. vitenskaper, prof. A.G. Berezhnaya (SFU); Ph.D. tech. Realfag, førsteamanuensis G.N. Sokolov (RGUPS)
© Rostov State Transport University, 2010
INNLEDNING: GRUNNLEGGENDE KONSEPT OG DEFINISJONER
Det teoretiske grunnlaget for moderne kjemi er atom-molekylær vitenskap.
Et atom er den minste, kjemisk udelelige partikkelen i et kjemisk grunnstoff. Et nøytralt atom består av en positivt ladet kjerne og antallet elektroner som tilsvarer denne ladningen. I et nøytralt atom er antallet protoner i kjernen lik antallet elektroner som beveger seg rundt kjernen.
Kjemisk element– en type atomer med samme kjerneladning.
Atomer av kjemiske elementer kan kombineres med hverandre, og danner enkle stoffer, bestående av identiske atomer (O 2, H 2, P 4, C og andre), eller komplekse stoffer, bestående av atomer av forskjellige kjemiske elementer (H2 SO4, C12 H22 011, NaOH). Komplekse stoffer kalles kjemiske forbindelser. Gyldig for mange kjemiske forbindelser
loven om konstans for sammensetningen av materie (J.L. Proust, 1808) – alle aldre
Et stoff med molekylær struktur har en konstant kvalitativ og kvantitativ sammensetning, uavhengig av fremstillingsmetoden.
Molekyl – minste partikkel et stoff som bevarer sin sammensetning og grunnleggende kjemiske egenskaper.
Ioner er elektrisk ladede partikler dannet av atomer (eller grupper av atomer) som et resultat av tilsetning eller tap av et visst antall elektroner Kationer er positivt ladede ioner, anioner er negativt ladede ioner.
Prosessligning |
||
Na+ – kation | Na0 – 1ē = Na+ |
|
S2– – anion | S0 + 2ē = S2– |
|
Kjemisk formel- en symbolsk oversikt over sammensetningen og det enkleste numeriske forholdet mellom atomer av forskjellige elementer som danner en kjemisk forbindelse. Den kvalitative sammensetningen av et stoff er indikert med symbolene til kjemiske elementer, den kvantitative sammensetningen er indikert med subskripter i symbolene til kjemiske elementer, som indikerer antall atomer til et gitt element i forbindelsen; hvis forbindelsen inneholder ett atom av et grunnstoff, registreres ikke indeksen "en". For eksempel i komposisjonen
molekyler av svovelsyre H2SO4 inkluderer 2 hydrogenatomer (H2-indeks 2), 1 svovelatom (S1 er ikke skrevet) og 4 oksygenatomer (O4).
Kjemiske fenomener eller kjemiske reaksjoner er fenomener når
der noen stoffer forvandles til andre som skiller seg fra de opprinnelige stoffene i egenskapene deres; grunnstoffsammensetningen til stoffet endres ikke.
Loven om bevaring av masse(M.V. Lomonosov, 1748) – vekten av
stoffer som kom inn i reaksjonen er lik massen av stoffer som dannes som følge av reaksjonen.
Absolutt masse av et atom eller molekyl uttrykt i gram
kilogram eller atommasseenheter. For eksempel
m (H) = 1,674 10–24 g = 1,674 10–27 kg = 1 amu
Atommasseenhet (1 amu) lik 1/12 av massen til et karbonisotopatom 12 C.
1 amu = 1/12 m (12 C) ≈ 1,66 10–24 g ≈ 1,66 10–27 kg.
Relativ atommasse til et grunnstoff (Ar) lik forholdet mellom gjennomsnittlig masse per atom i en naturlig blanding av isotoper og 1/12 av massen til karbonisotopen 12 C. Relativ atommasse – likegyldig
målt verdi, Ar (Cl) = 35,453; A r (O) = 15,9994;
Relativ molekylvekt (Mr) lik forholdet mellom gjennomsnittene
lavere masse som tilsvarer den kjemiske formelen til stoffet, funnet under hensyntagen til sammensetningen av den naturlige blandingen av isotoper av kjemiske elementer, til 1/12 av massen til et atom av 12 C-isotopen, det vil si til 1 amu. Derfor er den relative molekylmassen lik summen av de relative atommassene til alle elementene inkludert i sammensetningen kjemisk forbindelse. For kjemiske beregninger er A r- og M r-verdier ofte avrundet til hele tall, bortsett fra i noen tilfeller, for eksempel klor (35,5). For eksempel, M r (H2SO4) = 1∙2 + 32∙1 + 16∙4 = 98.
Mol er mengden stoff (n,) som inneholder samme antall partikler av stoff (atomer, molekyler, ioner, elektroner...) som det er atomer i 0,012 kg av karbon 12 C isotopen.
Avogadros konstant (NA ≈ 6,02 1023 mol-1) – antall strukturelle enheter i en mol av ethvert stoff.
Molar masse er massen av en mol av et stoff. Måleenhet
– g/mol; kg/kmol; mg/mmol.
Mengde av stoff n ("antall mol") kan bestemmes av masse eller av antall strukturelle enheter:
hvor m er massen til stoffet, M – molar masse stoffer, N – antall strukturelle enheter, N A – Avogadros antall.
Avogadros lov - like volumer av forskjellige gasser under samme forhold inneholder samme antall molekyler.
Den første konsekvensen av Avogadros lov – ett mol av en hvilken som helst gass under samme forhold opptar samme volum.
Under normale forhold (n.s.): T = 273,15 K (t = 0 ˚C) og P = 101 325 Pa (1 atm = 760 mmHg) 1 mol av en ideell gass opptar et volum på 22,4 liter. Molarvolumene til ekte gasser under normale forhold er svært nær denne verdien.
Mengde gassformig stoff n gass finnes i henhold til formelen
n gassV V gass,
hvor V gass er volumet av gass; V M er det molare volumet av gass (V M = 22,4 l/mol ved null nivå).
Clapeyron – Mendeleev ligning:
PV M m RT,
hvor P er gasstrykket, V er volumet av gass, m er massen av gass, M er den molare massen av gass, R er den universelle gasskonstanten, R = 8,314 J/(mol K).
Valens er evnen til et atom av et kjemisk element til å danne en viss mengde kjemiske bindinger med atomer av andre kjemiske elementer.
Elektrolytter er stoffer hvis vandige løsninger eller smelter leder elektrisk strøm; Elektrolytter inkluderer syrer, baser og salter.
Ikke-elektrolytter er stoffer hvis løsninger eller smelter ikke leder elektrisk strøm.
Elektrolytisk dissosiasjon – desintegrering av elektrolytten til ioner under oppløsning eller smelting. Dissosiasjon er en reversibel prosess; den omvendte prosessen kalles assosiasjon.
En syre er en elektrolytt, hvis dissosiasjon produserer bare hydrogenkationer H+ og anioner av syreresten.
HCl H+ + Cl–
Flerbasiske syrer er syrer som inneholder flere hydrogenatomer; polybasiske syrer dissosieres trinnvis:
H2SO4 | H+ + HSO4 – | (1. trinn); |
HSO4 – H+ + SO4 2– | (2. trinn); |
|
H2SO4 | 2H+ + SO4 2– | |
Dissosiasjonen av polybasiske syrer skjer hovedsakelig i det første trinnet.
En base er en elektrolytt hvis dissosiasjon produserer bare hydroksydanioner OH- og metall- eller ammoniumkationer.
NaOH Na+ + OH–
Polysyrebaser er baser som inneholder flere hydroksydanioner OH–, de dissosieres trinnvis:
Al(OH)3 | Al(OH)2 + + OH– | (1. trinn); |
Al(OH)2 + AlOH2+ + OH– | (2. trinn); |
|
AlOH2+ Al3+ + OH– | (3. trinn); |
|
Al(OH)3 | Al3+ + 3OH– | (total dissosiasjonsligning). |
Dissosiasjonen av polysyrebaser skjer hovedsakelig i det første trinnet.
Gjennomsnittssaltet er en elektrolytt, hvis dissosiasjon produserer et metall- eller ammoniumkation og et anion av en sur rest:
NH4 Cl NH4 + + Cl–
K2 SO4 2K+ + SO4 2– .
Et syresalt er en elektrolytt, hvis dissosiasjon produserer et metallkation og et anion av en sur rest som inneholder et hydrogenatom. Anionet til syreresten er involvert i prosessen med sekundær dissosiasjon:
NaHSO3 Na+ + HSO3 – HSO3 – H+ + SO3 2–
Hovedsaltet er en elektrolytt ved dissosiasjon dannes et kation bestående av et metall og hydroksylgrupper og et anion av en sur rest. Metallhydroksikeringen er også i stand til å dissosiere:
СaОНСl CaOH+ + Cl– CaOH+ Ca2+ + OH–
Oksider er komplekse stoffer som består av to grunnstoffer, hvorav det ene er et oksygenatom i -2 oksidasjonstilstand. Oksider er ikke-elektrolytter og dissosieres ikke i løsninger.
Ioniske ligninger
I løsninger skjer det mange reaksjoner mellom ioner; reaksjoner kan være reversible og irreversible.
Reversibel reaksjon
– i molekylær form:
NaCl + KNO3 NaNO3 + KCl;
- i ionisk form:
Na+ + Cl– + K+ + NO3 – Na+ + NO3 – + K+ + Cl– .
Settet med ioner på venstre og høyre side av ligningen ovenfor er det samme -
Reaksjoner fortsetter irreversibelt hvis det dannes uløselige (1), lett dissosierende (2) eller gassformige (3) produkter, det vil si at noen reaksjonsprodukter fjernes fra reaksjonssfæren.
2 i molekylær form 2NaOH+ H 2SO4 = Na2SO4 + 2H2O
i full ionisk form 2Na+ + 2OH– + 2H+ + SO4 2– =
2Na+ + SO4 2– + 2H2O |
||
forkortet | H+ + OH– = H2O |
|
3 i molekylær form | Na2S + H2SO4 = Na2SO4 + H2S |
|
i full ionisk form | 2Na+ + S2– + 2H+ + SO4 2– = |
|
2Na+ + SO4 2– + H2S |
||
forkortet | 2H+ + S2- = H2S |
|
Det grunnleggende om nomenklaturen for uorganiske forbindelser kan oppsummeres som følger:
1 Ikke-metallatomer i binære forbindelser (bortsett fra forbindelser med hydrogen) navngis ved å legge til suffikset - ID til det latinske navnet
grunnstoff, for eksempel: O–2 – oksid, Cl– – klorid, I– – jodid, N–3 – nitrid, P–3
– fosfid, S–2 – sulfid, etc.
2 Formlene til de fleste komplekse uorganiske stoffer er skrevet i sekvensen «fra kation til anion» i salter, baser og syrer, for eksempel Na+ Cl–, H+ 2 S–2, (NH4 )+ 2 SO4 –2. I hydrogenforbindelser elementer i hovedundergruppene i gruppene IV og V, er dette elementet plassert først, og deretter hydrogen: CH4 - metan, SiH4 - silan, NH3 - ammoniakk, PH3 - fosfin, AsH3 - arsin og andre.

I Russland er navnene på oksider, baser og salter ofte ordnet "fra anion til kation", og navngir fra høyre til venstre atomene eller gruppene som er inkludert i denne forbindelsen og indikerer oksidasjonstilstanden til det viktigste (sentrale) elementet, hvis det kan ha forskjellige betydninger i ulike stoffer1. For eksempel: MgO – magnesiumoksid, SO2 – svovel (IV) oksid, SO3 – svoveloksid
(VI), FeCl2 – jern(II)klorid, FeCl3 – jern(III)klorid, Cu(OH)2 – hydrogen
kobber(II)oksid, (ZnOH)2SO4 – sinkhydroksysulfat (eller sinkhydroksysulfat), (NH4 )2HPO4 – ammoniumhydroksyfosfat.
Tabell 1
Navn på noen uorganiske stoffer og anioner eller kationer inkludert i deres sammensetning
Navn | Syreformel |
|
forbindelser | forbindelser | rest, anion eller |
kationer og deres navn |
||
HNO2 | salpetersyre | NO2 – – nitritt |
HNO3 | NO3 – – nitrat |
|
NH4+ – ammonium |
||
H2 SiO3 | silisium (metasilisium- | SiO3 2– – silikat |
syre | ||
HMnO4 | permangansyre | MnO4 – – permanganat |
H2SO3 | svovelsyrling | SO3 2– – sulfitt |
H2SO4 | svovelsyre | SO4 2– – sulfat |
hydrosulfidsyre | S2– – sulfid |
|
H2 CO3 | karbonsyre | CO3 2– – karbonat |
HClO4 | perklorsyre | ClO4 – – perklorat |
HClO3 | klorsyre | ClO3 – – klorat |
hypoklorsyre | ClO– – hypokloritt |
|
saltsyre (saltsyre) | Cl– – klorid |
|
Flussyre (fluorsyre) | F– – fluor |
|
syre | ||
HPO3 | metafosforsyre | PO3 – – metafosfat |
H3PO4 | fosforsyre | PO4 3– – ortofosfat (fosf- |
H4P2O7 | pyrofosforsyre | P2 O7 4– – pyrofosfat |
natriumhydroksid | OH– – hydroksid |
1 IUPAC Nomenclature Commission anbefaler at navn begynner med kationen, for eksempel: NaCl - natriumklorid, MgCl(OH) - magnesiumhydroksidklorid.

1 KLASSER UORGANISKE FORBINDELSER
ELEMENTER | ||
Typisk | Amfoterisk | Typisk |
ikke-metaller |
||
Grunnleggende | Amfoterisk | Syrlig |
K2O, CaO | ZnO, Al203 | CO2, SO3 |
(+H2O) | ||
HYDROKSIDER | ||
Årsaker | Amfoterisk | |
begrunnelse | ||
KOH, Ca(OH)2 | Zn(OH)2, Al(OH)3 | H2 CO2, H2 SO4 |
Ris. 1.1. Hovedklasser av uorganiske forbindelser og deres relasjoner
3 Oksygenholdige syrer, som inneholder et ikke-metallatom eller et metall i høyeste oksidasjonstilstand, har suffikset - NA (syre), i den forrige - - IST (syre), for eksempel: HNO3 - salpetersyre og HNO2 - salpetersyre, H2 SO4 - svovelsyre og H2 SO3 - svovelsyrling.
Oksider er komplekse stoffer som består av to elementer, hvorav det ene er oksygen i -2 oksidasjonstilstand.
Oksider deles inn i saltdannende (de fleste) og ikke-saltdannende (CO, N2O, NO).
Saltdannende oksider deles inn i sure, amfotere og basiske.
Generelle metoder for å produsere oksider
1 Oksidasjon enkle stoffer(metaller og ikke-metaller) oksygen:
2Zn + O2 = 2ZnO S + O2 = SO2
2 Oksidasjon (forbrenning) av komplekse stoffer (organiske og uorganiske):
CH4 + O2 = CO2 + 2H2 O 2H2 S + 3O2 = 2SO2 + 2H2 O 2CO + O2 = 2CO2
3 Transformasjoner av komplekse stoffer:
a) dekomponering (uten å endre oksidasjonstilstanden) av oksygenholdige syrer, baser og noen salter:
H2 SO3 = SO2 + H2 O Cu(OH)2 = CuO + H2 O CaCO3 = CaO + CO2
b) redoksreaksjoner: 2Al + Fe2 O3 = 2Fe + Al2 O3
Cu + 4HNO3(kons.) = Cu(NO3)2 + 2NO2 + 2H2O 4CuO = 2Cu2O + O2
Sure oksider– oksider av ikke-metaller (CO2, SO3, SiO2, P2 O5) og oksider av overgangsmetaller, vanligvis i oksidasjonstilstanden +5, +6, +7 (V2 O5, CrO3, Mn2 O7).
Kjemiske egenskaper til syreoksider:
1 Reaksjon med vann (unntatt SiO2): SO3 + H2O = H2SO4
Cr03 + H20 = H2Cr04













