Strukturformel for molekyler
2.1. Kjemisk språk og dets deler
Menneskeheten bruker mange forskjellige språk. Unntatt naturlige språk(japansk, engelsk, russisk - mer enn 2,5 tusen totalt), det er også kunstige språk for eksempel esperanto. Blant kunstige språk er det språk diverse vitenskaper. Så i kjemi bruker de sine egne, kjemisk språk.
Kjemisk språk– et system med symboler og konsepter designet for en kort, kortfattet og visuell registrering og overføring av kjemisk informasjon.
En melding skrevet på de fleste naturlige språk er delt inn i setninger, setninger i ord og ord i bokstaver. Hvis vi kaller setninger, ord og bokstaver deler av språket, så kan vi identifisere lignende deler i kjemisk språk (tabell 2).
Imidlertid vil den mulige forvrengningen med hensyn til vinkelantikonformasjon, som bestemmer den relative orienteringen mellom tilstøtende ringer og det påfølgende tapet av molekylær planaritet, påvirke den elektroniske strukturen til polymeren, selv forutsatt at den er anvendelig.
Dette er grunnen til at beregningsmetoder blir mer sofistikerte etter mange år og kraften til datamaskiner for å bestemme torsjonspotensialer så nøyaktig som mulig. En første tilnærming til å kjenne konformasjonspreferansene til polytiofen og noen av dets derivater kan oppnås ved å studere en veldig enkel forbindelse, 2, 2-bitiofen og dens dimetylderivater. Vi utvidet nylig studien til større tiofenoligomerer.
Tabell 2.Deler kjemisk språk
Det er umulig å mestre noe språk umiddelbart; dette gjelder også et kjemisk språk. Derfor vil du foreløpig bare bli kjent med det grunnleggende i dette språket: lær noen "bokstaver", lær å forstå betydningen av "ord" og "setninger". På slutten av dette kapittelet vil du bli introdusert til navn kjemiske stoffer er en integrert del av det kjemiske språket. Når du studerer kjemi, vil kunnskapen din om kjemisk språk utvides og utdypes.
Disse resultatene, som er i klar synkronisering med eksperimentelle observasjoner, kan tilskrives direkte utvidelsen av effektiv konjugering langs polymerkjeden. Dopingprosessen: ioniseringspotensial og elektronaffinitet. Som diskutert ovenfor involverer doping av en polymer dens interaksjon med dopemidlet og overføring av elektroner fra polymeren til dopemidlet eller omvendt. Derfor er det viktig å kunne estimere ioniseringspotensialet og elektronaffiniteten til polymeren, noe som er interessant å studere.
KJEMISK SPRÅK.
1. Hvilke kunstige språk kan du (annet enn de som er nevnt i teksten til læreboken)?
2.Hvordan skiller naturlige språk seg fra kunstige?
3. Tror du det er mulig å beskrive kjemiske fenomener uten å bruke kjemisk språk? Hvis ikke, hvorfor ikke? I så fall, hva er fordelene og ulempene med en slik beskrivelse?
Denne verdien gir en ide om de ledende egenskapene til polymeren, siden den representerer energien til den mest gunstige elektroniske overgangen. Bruken av denne teknikken, som i prinsippet gjør det mulig å reprodusere egenskapene til et polymermolekyl med uendelig lengde, er begrenset til molekyler som ikke viser noen form for forandring eller molekylær forvrengning, siden det ellers ville gjenta seg med jevne mellomrom langs kjeden. Betraktning av det periodiske molekylære systemet gir en logisk mer eksakt beskrivelse polymer enn den gitte modellen.
2.2. Kjemiske elementsymboler
Symbolet for et kjemisk element representerer selve elementet eller ett atom i det elementet.
Hvert slikt symbol er et forkortet latinsk navn på et kjemisk grunnstoff, bestående av en eller to bokstaver i det latinske alfabetet (for det latinske alfabetet, se vedlegg 1). Symbolet er skrevet med stor bokstav. Symboler, samt russiske og latinske navn på enkelte grunnstoffer, er gitt i tabell 3. Informasjon om opprinnelsen til de latinske navnene er også gitt der. Det er ingen generell regel for uttalen av symboler, derfor viser tabell 3 også "lesningen" av symbolet, det vil si hvordan dette symbolet leses i den kjemiske formelen.
Sistnevnte gir imidlertid svært rimelige resultater fra et kvalitativt synspunkt og lar i tillegg påvirkningen av alle typer endringer og spesifikke defekter i molekylet analyseres nøyaktig. Dopingprosessen: strukturelle endringer. Som nevnt forventes dopingprosessen å resultere i viktige geometriske endringer i polymerkjedene. Dessverre kompliserer den amorfe strukturen som kjennetegner de fleste polymerer den eksperimentelle studien av slike endringer. Fra et teoretisk synspunkt kan den nøytrale polymerkjeden og den elektrisk ladede kjeden modelleres separat for deretter å analysere de strukturelle forskjellene mellom dem.
Det er umulig å erstatte navnet på et element med et symbol i muntlig tale, men i håndskrevne eller trykte tekster er dette tillatt, men ikke anbefalt Foreløpig er 110 kjent kjemiske elementer, 109 av dem har navn og symboler godkjent av International Union of Pure and Applied Chemistry (IUPAC).
Tabell 3 gir informasjon om kun 33 elementer. Dette er elementene du vil møte først når du studerer kjemi. Russiske navn (i alfabetisk rekkefølge) og symboler for alle elementene er gitt i vedlegg 2.
Senere, for å komme nærmere de faktiske egenskapene til polytiofen, brukte vi større modeller som inneholdt opptil 13 tiofenringer. Resultatene bekreftet tidligere studier, samtidig som de tillot å bestemme utvidelsen av den bipolare defekten. En annen strategi for å studere strukturelle endringer er å eksplisitt modellere interaksjonen mellom polymeren og dopemidlet, i stedet for å analysere bare geometrien til de innledende og endelige polymertilstandene. Dermed inkluderer studien informasjon om området av polymeren der interaksjon med dopemidlet skjer, samt polarisasjonseffektene som dopemidlet har på polymeren.
Tabell 3.Navn og symboler på noen kjemiske grunnstoffer
Navn |
||||
latin |
Skriving |
|||
| - | Skriving Nye materialer Utvilsomt er en av de største fordelene med molekylær modellering fremfor rene eksperimentelle metoder at nye materialer kan "forestilles" og mange av deres egenskaper vurderes uten behov for å syntetisere dem, med påfølgende besparelser som dette representerer. For eksempel kan man tenke på å øke den elektriske ledningsevnen til en polymer ved å endre dens kjemisk sammensetning eller dens struktur. Et annet viktig forskningsområde er fokusert på hvordan man kan forbedre løseligheten til polytiofen-avledede polymerer, som kreves av noen ingeniørapplikasjoner. En måte å øke løseligheten i organiske løsningsmidler på er å inkorporere visse funksjonelle sidegrupper, slik som alkylkjeder, ioniserbare substituenter, alkoholer eller estere, i polytiofen-ryggraden. På den annen side er det viktig å vite den mest gunstige posisjonen for introduksjonen av disse gruppene, samt taktikken som polymeren vil ta. |
Opprinnelse |
- | - |
| Nitrogen | N itrogenium | Fra gresk "føde salpeter" | "no" | |
| Aluminium | Al uminium | Fra lat. "alun" | "aluminium" | |
| Argon | Ar gon | Fra gresk "inaktiv" | "argon" | |
| Barium | Ba rium | Fra gresk "tung" | "barium" | |
| Bor | B orum | Fra arabisk "hvit mineral" | "bor" | |
| Brom | Br omum | Fra gresk "stinkende" | "brom" | |
| Hydrogen | H hydrogenium | Fra gresk "føde vann" | "aske" | |
| Helium | Han lium | Fra gresk "Sol" | "helium" | |
| Stryke | Fe rrum | Fra lat. "sverd" | "ferrum" | |
| Gull | Au rom | Fra lat. "brenner" | "aurum" | |
| Jod | jeg odum | Fra gresk "fiolett" | "jod" | |
| Kalium | K alium | Fra arabisk "lut" | "kalium" | |
| Kalsium | Ca lsium | Fra lat. "kalkstein" | "kalsium" | |
| Oksygen | O xygenium | Fra gresk "syregenererende" | "O" | |
| Silisium | Si licium | Fra lat. "flint" | "silisium" | |
| Krypton | Kr ypton | Fra gresk "skjult" | "krypton" | |
| Magnesium | M en g nesium | Fra navnet Magnesia-halvøya | "magnesium" | |
| Mangan | M en n ganum | Fra gresk "rensing" | "mangan" | |
| Kopper | Cu prum | Fra gresk navn O. Kypros | "cuprum" | |
| Natrium | Na trium | Fra arabisk, "vaskemiddel" | "natrium" | |
| Neon | Ne på | Fra gresk "ny" | "neon" | |
| Nikkel | Ni ccolum | Fra ham. "St. Nicholas Copper" | "nikkel" | |
| Merkur | H ydrar g yrum | Lat. "flytende sølv" | "hydrargyrum" | |
| Bly | P lum b um | Fra lat. navn på en legering av bly og tinn. | "plommeboom" | |
| Svovel | S ulfur | Fra sanskrit "brennbart pulver" | "es" | |
| Sølv | EN r g entum | Fra gresk "lys" | "argentum" | |
| Karbon | C arboneum | Fra lat. "kull" | "tse" | |
| Fosfor | P hosfor | Fra gresk "bringer av lys" | "peh" | |
| Fluor | F luorum | Fra lat. verbet "å flyte" | "fluor" | |
| Klor | Cl orum | Fra gresk "grønnaktig" | "klor" | |
| Krom | C h r omium | Fra gresk "fargestoff" | "krom" | |
| Cesium | C ae s ium | Fra lat. "himmelblå" | "cesium" | |
| Sink | Z jeg n cum | Fra ham. "tinn" | "sink" | |
2.3. Kjemiske formler
Heldigvis kan de nevnte problemene løses ved hjelp av molekylære modelleringsteknikker. For eksempel kan introduksjonen av en karboksylgruppe av en tiofenring føre til flere forbindelser, slik som de som er nevnt i beskrivelsen, hvis strukturelle og elektroniske egenskaper kan vurderes og sammenlignes fra et teoretisk synspunkt.
Simuleringer av disse tre forbindelsene indikerer at derivatet med karboksylgrupper i posisjon 4 av tiofenringene er det mest stabile og antar en konformasjon nær planaritet. Dette resultatet indikerer at begge nøytrale forbindelser har lignende elektrisk ledningsevne. I denne artikkelen har vi sett på flere egenskaper ved noen heterosykliske polymerer som er relatert til deres evne til å lede elektrisk strøm. Polymerer bør ha en nesten flat struktur og, logisk sett, en liten båndbredde.
Brukes for å betegne kjemiske stoffer kjemiske formler.
For molekylære stoffer kan en kjemisk formel betegne ett molekyl av dette stoffet.
Informasjon om et stoff kan variere, så det er forskjellige typer kjemiske formler.
Avhengig av fullstendigheten av informasjonen, er kjemiske formler delt inn i fire hovedtyper: protozoer,
molekylær, strukturelle Og romlig.
På den annen side letter lave ioniseringspotensialer og høye elektronaffiniteter polymerdoping. Resultatene presentert i denne artikkelen viser at teoretiske molekylære modelleringsteknikker er tilstrekkelige til å evaluere disse og andre egenskaper raskt og relativt enkelt, noe som gir en bedre forståelse av fenomenet elektrisk ledningsevne.
På den annen side er det viktig å merke seg at verktøy for molekylær modellering kan brukes, i det minste i prinsippet, for å forutsi egenskapene til enhver forbindelse, selv om den aldri har blitt syntetisert. Derfor innebærer samarbeid mellom teoretiske og eksperimentelle laboratorier å optimalisere innsatsen til sistnevnte, noe som kan redusere deres forbruk av menneskelige og instrumentelle ressurser betydelig.
Abonnementer i den enkleste formelen har ikke en felles divisor.
Indeksen "1" brukes ikke i formler.
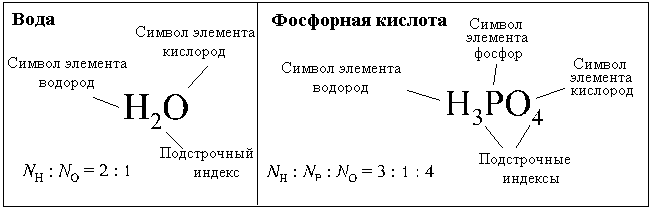
Eksempler på de enkleste formlene: vann - H 2 O, oksygen - O, svovel - S, fosforoksid - P 2 O 5, butan - C 2 H 5, fosforsyre - H 3 PO 4, natriumklorid ( bordsalt) – NaCl.
Den enkleste formelen for vann (H 2 O) viser at sammensetningen av vann inkluderer grunnstoffet hydrogen(H) og element oksygen(O), og i en hvilken som helst del (en del er en del av noe som kan deles uten å miste egenskapene.) av vann dobles antall hydrogenatomer flere tall oksygenatomer.
Antall partikler, inkludert antall atomer, betegnet latinsk bokstav N. Angir antall hydrogenatomer - N H, og antall oksygenatomer er NÅ, det kan vi skrive
Granovsky, Moskva statsuniversitet. I organisk kjemi brukes molekylære, empiriske, strukturelle, semistrukturelle og elektroniske formler. Molekylformelen viser den kvalitative og kvantitative sammensetningen av atomer i et molekyl. Den empiriske formelen viser det relative antallet atomer til hvert element i et molekyl. Strukturelle og elektroniske formler gjenspeiler rekkefølgen for tilkobling av atomer i et molekyl. I organisk kjemi brukes vanligvis semistrukturformler, siden atomer har et romlig arrangement i et molekyl.
Strukturformler er språket i organisk kjemi. Hvert stoff har sin egen kjemiske formel. Imidlertid ble det oppdaget stoffer som hadde det samme kjemiske formler, men viste forskjellige egenskaper. Strukturteorien forklarte årsaken til eksistensen av slike forbindelser. I mettede hydrokarboner kan karbonatomer kobles i serie i en kjede, og det er derfor slike hydrokarboner kalles uforgrenede. Men for alkaner som inneholder fire eller flere karbonatomer, er andre strukturer mulige, som består av forgrenede kjeder av karbonatomer.
Eller N H: N O=2:1.
Den enkleste formelen for fosforsyre (H 3 PO 4) viser at fosforsyre inneholder atomer hydrogen, atomer fosfor og atomer oksygen, og forholdet mellom antall atomer til disse elementene i en hvilken som helst del av fosforsyre er 3:1:4, det vil si
NH: N P: N O = 3:1:4.
Det er to butaner C 4 H 10, som er forskjellige i fysiske egenskaper: normal butan CH 3 CH 2 CH 2 CH 3, hvis kokepunkt er 0,6 ºC, og butan med en forgrenet struktur: kokepunktet er 11,7 ºC . Så, i karbonforbindelser, tilsvarer en molekylformel ikke en, men til flere forbindelser som er forskjellige i fysiske og kjemiske egenskaper.
Forbindelser som har samme sammensetning, men forskjellige molekylære strukturer, som forårsaker forskjellige egenskaper, kalles isomerer, og fenomenet med eksistensen av slike forbindelser kalles isomerisme. Tilstedeværelsen av isomerer bestemmer antall organiske forbindelser. Hvordan flere atomer karbon inneholder en organisk forbindelse, jo flere isomerer det danner. For eksempel har heksan 5 isomerer, heptan - 9, oktan - 18, nonan - 35, dekan -.
Den enkleste formelen kan kompileres for enhver person kjemisk stoff, og for molekylær substans, i tillegg kan kompileres molekylformel.
Eksempler på molekylformler: vann - H 2 O, oksygen - O 2, svovel - S 8, fosforoksid - P 4 O 10, butan - C 4 H 10, fosforsyre - H 3 PO 4.
Ikke-molekylære stoffer har ikke molekylære formler.
Isomerisme er veldig vanlig i organisk kjemi. Det er påtruffet i studiet av alle klasser av organiske forbindelser. Isomerisme forårsaket av forskjellige sekvenser av kommunikasjon av atomer i molekyler, så vel som forskjellige posisjoner av flere bindinger i dem, kalles strukturell isomeri.
Et eksempel er butanisomerer. Hvis det er fire karbonatomer i molekylet til en organisk forbindelse, er isomerisme mulig som et resultat av forskjellige arrangementer av karbonatomer. Strukturell isomerisme i mettede hydrokarboner er assosiert med isomerisme av karbonskjelettet.
Rekkefølgen av å skrive elementsymboler i enkle og molekylære formler bestemmes av reglene for kjemisk språk, som du vil bli kjent med når du studerer kjemi. Informasjonen som formidles av disse formlene påvirkes ikke av symbolsekvensen.
Av skiltene som gjenspeiler strukturen til stoffer, vil vi bare bruke foreløpig valensslag("bindestrek"). Dette tegnet viser tilstedeværelsen mellom atomene til den såkalte kovalent binding(hvilken type tilkobling dette er og hva dens funksjoner er, vil du snart finne ut).
Når antallet karbonatomer i et molekyl øker, øker antallet mulige isomerer. Derfor er det ikke nok å nevne bare for eksempel isoheksan, som det kan være fem av for heksan. Navnet på isomerer bør være sammensatt på en slik måte at det ikke bare indikerer antall atomer som utgjør stoffet, men også gir en ide om strukturen til molekylet, slik at dets strukturformel kan være enkelt og nøyaktig skrevet. For dette formålet har forskere utviklet regler for sammenstilling av individuelle navn på stoffer - nomenklatur.
I organisk kjemi er det flere nomenklaturer for navngivning av forbindelser: historisk eller triviell, rasjonell, systematisk nomenklatur. Historisk nomenklatur oppsto i antikken, da organiske forbindelser ble gitt tilfeldige navn. I utgangspunktet indikerte disse navnene opprinnelsen til stoffene. For eksempel maursyre, oksalsyre, eplesyre, vinsyre, trealkohol osv. Denne nomenklaturen gjør det ikke mulig å navngi isomerer.
I et vannmolekyl er et oksygenatom forbundet med enkle (enkelt)bindinger til to hydrogenatomer, men hydrogenatomene er ikke koblet til hverandre. Dette er nøyaktig hva strukturformelen til vann tydelig viser. ![]()
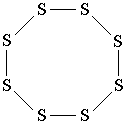
Et annet eksempel: svovelmolekylet S8. I dette molekylet danner 8 svovelatomer en åtteleddet ring, der hvert svovelatom er forbundet med to andre atomer med enkle bindinger. Sammenlign strukturformelen til svovel med den tredimensjonale modellen av molekylet vist i fig. 3. Vær oppmerksom på at strukturformelen til svovel ikke formidler formen til molekylet, men viser bare sekvensen av atomers forbindelse med kovalente bindinger.
Det mest praktiske er den internasjonale nomenklaturen, som er basert på navnene på mettede hydrokarboner. For å navngi isomerer ved å bruke denne nomenklaturen, må vi først bli kjent med radikaler og substituenter. Når et hydrogenatom abstraheres fra alkanmolekyler, dannes det monovalente partikler, som kalles frie radikaler.
Radikal er en partikkel som har et uparet elektron og er i stand til selvstendig tilværelse. Navnene på enverdige radikaler kommer fra navnene på de tilsvarende hydrokarboner med endingen -an erstattet med -yl, -il. CH3-metyl, -C4H10-butyl, -C2H5-etyl, -C6H5-fenyl, -C3H7-propyl, CH = CH2-vinyl, etc.
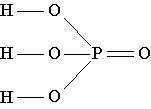
Strukturformelen til fosforsyre viser at i molekylet til dette stoffet er ett av de fire oksygenatomene bare koblet til fosforatomet med en dobbeltbinding, og fosforatomet er på sin side koblet til ytterligere tre oksygenatomer med enkeltbindinger . Hvert av disse tre oksygenatomene er også forbundet med en enkel binding til ett av de tre hydrogenatomene som er tilstede i molekylet.
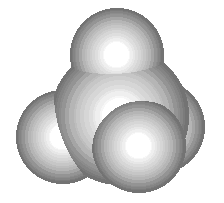
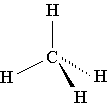
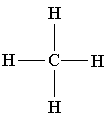
Sammenlign følgende tredimensjonale modell av et metanmolekyl med dets romlige, strukturelle og molekylære formel:
|
|
|
I den romlige formelen for metan viser kileformede valensstreker, som i perspektiv, hvilke av hydrogenatomene som er "nærmere oss" og hvilke som er "lengre fra oss".
Noen ganger indikerer romformelen bindingslengder og vinkler mellom bindinger i et molekyl, som vist i eksemplet med et vannmolekyl.

Ikke-molekylære stoffer inneholder ikke molekyler. For enkelhets skyld å utføre kjemiske beregninger i et ikke-molekylært stoff, den såkalte formelenhet.
Eksempler på sammensetningen av formelenheter av noen stoffer: 1) silisiumdioksid (kvartssand, kvarts) SiO 2 – en formelenhet består av ett silisiumatom og to oksygenatomer; 2) natriumklorid (bordsalt) NaCl – formelenheten består av ett natriumatom og ett kloratom; 3) jern Fe - en formelenhet består av ett jernatom Som et molekyl er en formelenhet den minste delen av et stoff som beholder sine kjemiske egenskaper.
Tabell 4
Informasjon formidlet av ulike typer formler
Formel type |
Informasjon formidlet av formelen. |
|
| Den enkleste Molekylær Strukturelt Romlig |
|
|
La oss nå vurdere, ved hjelp av eksempler, hvilken informasjon ulike typer formler gir oss.
1. Stoff: eddiksyre. Den enkleste formelen er CH 2 O, molekylformelen er C 2 H 4 O 2, strukturformel
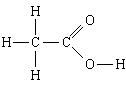
Den enkleste formelen forteller oss det
1) eddiksyre inneholder karbon, hydrogen og oksygen;
2) i dette stoffet er antallet karbonatomer relatert til antall hydrogenatomer og antall oksygenatomer, som 1: 2: 1, dvs. N H: N C: N O = 1:2:1.
Molekylformel legger det til
3) i et molekyl av eddiksyre er det 2 karbonatomer, 4 hydrogenatomer og 2 oksygenatomer.
Strukturformel legger det til
4, 5) i et molekyl er to karbonatomer forbundet med hverandre ved en enkel binding; en av dem er i tillegg koblet til tre hydrogenatomer, hver med en enkeltbinding, og den andre til to oksygenatomer, en med en dobbeltbinding og den andre med en enkeltbinding; det siste oksygenatomet er fortsatt forbundet med en enkel binding til det fjerde hydrogenatomet.
2. Stoff: natriumklorid.
Den enkleste formelen er NaCl.
1) Natriumklorid inneholder natrium og klor.
2) I dette stoffet er antall natriumatomer lik antall kloratomer.
3. Stoff: stryke.
Den enkleste formelen er Fe.
1) Dette stoffet inneholder kun jern, det vil si at det er et enkelt stoff.
4. Stoff: trimetafosforsyre . Den enkleste formelen er HPO 3, molekylformel er H 3 P 3 O 9, strukturformel
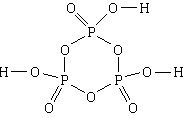
1) Trimetafosforsyre inneholder hydrogen, fosfor og oksygen.
2) N H: N P: N O = 1:1:3.
3) Molekylet består av tre hydrogenatomer, tre fosforatomer og ni oksygenatomer.
4, 5) Tre fosforatomer og tre oksygenatomer, alternerende, danner en seksleddet syklus. Alle tilkoblinger i syklusen er enkle. Hvert fosforatom er i tillegg koblet til ytterligere to oksygenatomer, det ene med en dobbeltbinding og det andre med en enkeltbinding. Hvert av de tre oksygenatomene forbundet med enkle bindinger til fosforatomer er også forbundet med en enkel binding til et hydrogenatom.
| Fosforsyre – H 3 PO 4(et annet navn er ortofosforsyre) er et gjennomsiktig, fargeløst, krystallinsk stoff med molekylær struktur som smelter ved 42 o C. Dette stoffet løses veldig godt opp i vann og absorberer til og med vanndamp fra luften (hygroskopisk). Fosforsyre produseres i store mengder og brukes primært til produksjon av fosfatgjødsel, samt i kjemisk industri, i produksjon av fyrstikker og til og med i konstruksjon. I tillegg brukes fosforsyre til fremstilling av sement i tannteknologi og inngår i mange medisiner. Denne syren er ganske billig, så i noen land, for eksempel USA, tilsettes veldig ren fosforsyre, sterkt fortynnet med vann, til forfriskende drikker for å erstatte den dyre sitronsyren. |
| Metan - CH 4. Hvis du har en gasskomfyr hjemme, møter du dette stoffet hver dag: naturgassen som brenner i brennerne på ovnen din består av 95 % metan. Metan er en fargeløs og luktfri gass med et kokepunkt på –161 o C. Når det blandes med luft er det eksplosivt, noe som forklarer eksplosjonene og brannene som noen ganger oppstår i kullgruver (et annet navn for metan er branndamp). Det tredje navnet på metan - sumpgass - skyldes det faktum at bobler av denne gassen stiger opp fra bunnen av sumper, hvor den dannes som et resultat av aktiviteten til visse bakterier. I industrien brukes metan som drivstoff og råstoff til produksjon av andre stoffer. Metan er det enkleste hydrokarbon |
. Denne klassen av stoffer inkluderer også etan (C 2 H 6), propan (C 3 H 8), etylen (C 2 H 4), acetylen (C 2 H 2) og mange andre stoffer..Tabell 5-
Eksempler på ulike typer formler for noen stoffer Akkurat som i uorganisk kjemi er det grunnleggende teoretiske grunnlaget Periodisk lov Periodesystemet kjemiske elementer av D.I. Mendeleev, så i organisk kjemi er det ledende vitenskapelige grunnlaget Butlerov-Kekule-Cooper-teorien om strukturen til organiske forbindelser.
Som enhver annen vitenskapelig teori, var teorien om strukturen til organiske forbindelser et resultat av en generalisering av det rikeste faktamaterialet som organisk kjemi, som tok form som en vitenskap i tidlig XIX V. Flere og flere nye karbonforbindelser ble oppdaget, og antallet økte som et snøskred (tabell 1).
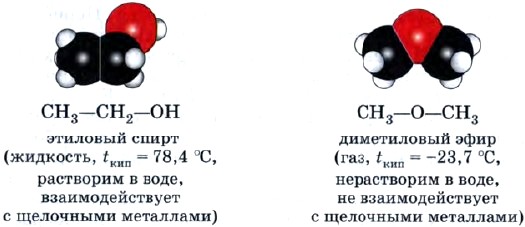
For eksempel er etylalkohol og dimetyleter isomerer: disse stoffene har samme sammensetning C 2 H 6 O, men annen struktur, dvs. ulik rekkefølge av kobling av atomer i molekyler, og derfor ulike egenskaper.
F. Wöhler, allerede kjent for deg, beskrev organisk kjemi i et av sine brev til J. J. Berzelius: «Organisk kjemi kan nå gjøre hvem som helst gal. Det virker for meg som en tett skog, full av fantastiske ting, et grenseløst kratt som du ikke kan komme deg ut av, som du ikke tør å trenge inn i...»
Utviklingen av kjemi ble sterkt påvirket av arbeidet til den engelske vitenskapsmannen E. Frankland, som, basert på ideene om atomisme, introduserte begrepet valens (1853).
I et hydrogenmolekyl H2 dannes ett kovalent kjemikalie N-N forbindelse, dvs. hydrogen er enverdig. Valensen til et kjemisk element kan uttrykkes ved antall hydrogenatomer som ett atom av det kjemiske elementet legger til seg selv eller erstatter. For eksempel er svovel i hydrogensulfid og oksygen i vann toverdige: H 2 S, eller H-S-H, H 2 O eller H-O-H, og nitrogen i ammoniakk er treverdig:
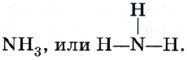
I organisk kjemi er begrepet "valens" en analog til begrepet "oksidasjonstilstand", som du er vant til å jobbe med i løpet av uorganisk kjemi i grunnskolen. Dette er imidlertid ikke det samme. For eksempel, i nitrogenmolekylet N2, er oksidasjonstilstanden til nitrogen null, og valensen er tre:
![]()
I hydrogenperoksid H2O2 er oksidasjonstilstanden til oksygen -1, og valensen er to:
![]()
I ammoniumionet NH + 4 er oksidasjonstilstanden til nitrogen -3, og valensen er fire:

Vanligvis i forhold til ioniske forbindelser(natriumklorid NaCl og mange andre uorganiske stoffer med ioniske bindinger) bruker ikke begrepet "valens" av atomer, men vurderer deres oksidasjonstilstand. Derfor, i uorganisk kjemi, hvor de fleste stoffer har en ikke-molekylær struktur, er det å foretrekke å bruke konseptet "oksidasjonstilstand", og i organisk kjemi, hvor de fleste forbindelser har en molekylær struktur, som regel konseptet " valency» brukes.
Teori kjemisk struktur- resultatet av en syntese av ideene til fremragende organiske forskere fra tre europeiske land: tyskeren F. Kekule, engelskmannen A. Cooper og russeren A. Butlerov.
I 1857 klassifiserte F. Kekule karbon som et tetravalent grunnstoff, og i 1858, sammen med A. Cooper, bemerket han at karbonatomer er i stand til å koble seg til hverandre i forskjellige kjeder: lineære, forgrenede og lukkede (sykliske).
Verkene til F. Kekule og A. Cooper tjente som grunnlag for utviklingen av en vitenskapelig teori som forklarer fenomenet isomerisme, forholdet mellom sammensetningen, strukturen og egenskapene til molekyler av organiske forbindelser. Denne teorien ble laget av den russiske forskeren A.M. Det var hans nysgjerrige sinn som "turte å trenge" inn i den "tette skogen" av organisk kjemi og begynne å forvandle dette "grenseløse krattet" til en vanlig park oversvømmet av sollys med et system av stier og smug. De grunnleggende ideene til denne teorien ble først uttrykt av A.M. Butlerov i 1861 på kongressen for tyske naturforskere og leger i Speyer.
Hovedbestemmelsene og konsekvensene av Butlerov-Kekule-Cooper-teorien om strukturen til organiske forbindelser kan kort formuleres som følger.
1. Atomer i molekyler av stoffer er forbundet i en bestemt rekkefølge i henhold til deres valens. Karbon i organiske forbindelser er alltid fireverdig, og dets atomer er i stand til å kombinere med hverandre, og danner forskjellige kjeder (lineære, forgrenede og sykliske).
Organiske forbindelser kan ordnes i rader av stoffer som ligner i sammensetning, struktur og egenskaper - homologe rader.
- Butlerov Alexander Mikhailovich (1828-1886), russisk kjemiker, professor ved Kazan-universitetet (1857-1868), fra 1869 til 1885 - professor ved St. Petersburg-universitetet. Akademiker ved St. Petersburgs vitenskapsakademi (siden 1874). Skaperen av teorien om den kjemiske strukturen til organiske forbindelser (1861). Forutsa og studerte isomerismen til mange organiske forbindelser. Syntetiserte mange stoffer.
For eksempel er metan CH 4 stamfaren til den homologe serien av mettede hydrokarboner (alkaner). Dens nærmeste homolog er etan C2H6 eller CH3-CH3. De neste to medlemmene av den homologe metanserien er propan C 3 H 8, eller CH 3 -CH 2 - CH 3, og butan C 4 H 10, eller CH 3-CH 2-CH 2-CH 3, etc.
Det er lett å se at for homologiske serier kan man utlede en generell formel for rekken. Så for alkaner er denne generelle formelen C n H 2n + 2.
2. Egenskapene til stoffer avhenger ikke bare av deres kvalitative og kvantitative sammensetning, men også av strukturen til molekylene deres.
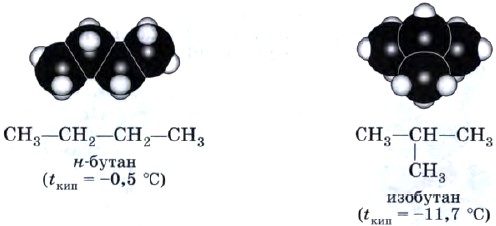
Denne posisjonen til teorien om strukturen til organiske forbindelser forklarer fenomenet isomerisme. Det er åpenbart at for butan C 4 H 10, i tillegg til et molekyl med en lineær struktur CH3-CH2-CH2-CH3, er en forgrenet struktur også mulig:

Dette er et helt nytt stoff med sine egne individuelle egenskaper, forskjellig fra egenskapene til butan med lineær struktur.
Butan, i molekylet hvis atomer er ordnet i en lineær kjede, kalles normal butan (n-butan), og butan, hvis kjede av karbonatomer er forgrenet, kalles isobutan.
Det er to hovedtyper av isomerisme - strukturell og romlig.
I samsvar med den aksepterte klassifiseringen skilles tre typer strukturell isomeri.
Isomerisme av karbonskjelettet. Forbindelser er forskjellige i rekkefølgen av karbon-karbonbindinger, for eksempel diskutert n-butan og isobutan. Det er denne typen isomerisme som er karakteristisk for alkaner.
Isomerisme av posisjonen til en multippelbinding (C=C, C=C) eller en funksjonell gruppe (dvs. en gruppe atomer som bestemmer om en forbindelse tilhører en bestemt klasse av organiske forbindelser), for eksempel:
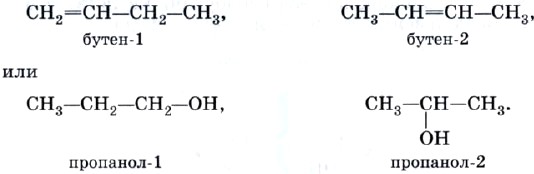
Interklasse-isomerisme. Isomerer av denne typen isomerisme tilhører forskjellige klasser av organiske forbindelser, for eksempel etylalkohol (klasse mettede monohydriske alkoholer) og dimetyleter (klasse etere) diskutert ovenfor.
Det er to typer romlig isomeri: geometrisk og optisk.
Geometrisk isomeri er først og fremst karakteristisk for forbindelser med en dobbel karbon-karbonbinding, siden på stedet for en slik binding har molekylet en plan struktur (fig. 6).

Ris. 6.
Etylen molekyl modell
For eksempel, for buten-2, hvis identiske grupper av atomer ved karbonatomene ved dobbeltbindingen er på den ene siden av planet til C=C-bindingen, så er molekylet en cis-isomer, hvis det på motsatte sider er en trans-isomer.

Optisk isomerisme observeres for eksempel i stoffer hvis molekyler har et asymmetrisk eller kiralt karbonatom bundet til fire diverse varamedlemmer. Optiske isomerer er speilbilder av hverandre, som to håndflater, og er ikke kompatible. (Nå forstår du åpenbart det andre navnet på denne typen isomerisme: gresk chiros - hånd - et eksempel på en asymmetrisk figur.) For eksempel eksisterer 2-hydroksypropansyre (melkesyre), som inneholder ett asymmetrisk karbonatom, i formen av to optiske isomerer.

I kirale molekyler oppstår isomere par der isomermolekylene er relatert til hverandre i sin romlige organisasjon på samme måte som et objekt og dets speilbilde er relatert til hverandre. Et par slike isomerer har alltid de samme kjemiske og fysiske egenskapene, med unntak av optisk aktivitet: hvis en isomer roterer planet av polarisert lys med klokken, så roterer den andre nødvendigvis mot klokken. Den første isomeren kalles høyredreiende, og den andre kalles venstredreiende.
Betydningen av optisk isomerisme i organiseringen av livet på planeten vår er veldig stor, siden optiske isomerer kan variere betydelig både i deres biologiske aktivitet og i kompatibilitet med andre naturlige forbindelser.
3. Atomer i molekyler av stoffer påvirker hverandre. Du vil vurdere gjensidig påvirkning av atomer i molekylene til organiske forbindelser under videre studier av kurset.
Den moderne teorien om strukturen til organiske forbindelser er ikke bare basert på den kjemiske, men også på den elektroniske og romlige strukturen til stoffer, som diskuteres i detalj på profilnivået for å studere kjemi.
I organisk kjemi er flere typer kjemiske formler mye brukt.
Molekylformelen gjenspeiler den kvalitative sammensetningen av forbindelsen, det vil si at den viser antall atomer til hvert av de kjemiske elementene som danner molekylet til stoffet. For eksempel er molekylformelen for propan: C 3 H 8.
Strukturformelen gjenspeiler rekkefølgen for tilkobling av atomer i et molekyl i henhold til valens. Strukturformelen til propan er:
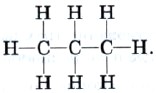
Ofte er det ikke nødvendig å skildre i detalj kjemiske bindinger mellom karbon- og hydrogenatomer, derfor brukes i de fleste tilfeller forkortede strukturformler. For propan er denne formelen skrevet som følger: CH 3 -CH 2 -CH 3.
Strukturen til molekyler av organiske forbindelser reflekteres ved hjelp av ulike modeller. De mest kjente er volumetriske (skala) og ball-and-stick-modeller (fig. 7).

Ris. 7.
Etanmolekylmodeller:
1 - ball-og-stang; 2 - skala
Nye ord og begreper
- Isomerisme, isomerer.
- Valence.
- Kjemisk struktur.
- Teori om strukturen til organiske forbindelser.
- Homolog serie og homolog forskjell.
- Molekylære og strukturelle formler.
- Modeller av molekyler: volumetrisk (skala) og ball-and-stick.
Spørsmål og oppgaver
- Hva er valens? Hvordan skiller det seg fra oksidasjonstilstand? Gi eksempler på stoffer der verdiene for oksidasjonstilstanden og valensen til atomene er numerisk like og forskjellige,
- Bestem valensen og oksidasjonstilstanden til atomer i stoffer hvis formler er Cl 2, CO 2, C 2 H 6, C 2 H 4.
- Hva er isomerisme; isomerer?
- Hva er homologi; homologer?
- Hvordan, ved å bruke kunnskap om isomerisme og homologi, forklare mangfoldet av karbonforbindelser?
- Hva menes med den kjemiske strukturen til molekyler av organiske forbindelser? Formuler bestemmelsene i strukturteorien, som forklarer forskjellen i egenskapene til isomerer. Formuler bestemmelsene i strukturteorien, som forklarer mangfoldet av organiske forbindelser.
- Hvilket bidrag ga hver av forskerne - grunnleggerne av teorien om kjemisk struktur - til denne teorien? Hvorfor spilte bidraget fra den russiske kjemikeren en ledende rolle i utviklingen av denne teorien?
- Det kan være tre isomerer av sammensetningen C 5 H 12. Skriv ned deres fullstendige og forkortede strukturformler,
- Basert på modellen av stoffmolekylet presentert på slutten av avsnittet (se fig. 7), komponer dets molekylære og forkortede strukturformler.
- Kalkulere massefraksjon karbon i molekylene til de fire første medlemmene av den homologe serien av alkaner.