Tabell over mønstre for endringer i egenskapene til atomer til enkle stoffer. Kjemi eksamen - Periodisk lov og periodisk system av kjemiske elementer av D. I. Mendeleev. Mønstre av endringer i egenskapene til elementer av små perioder og hovedundergrupper avhengig av
Med en økning i ladningen til atomkjernen observeres en regelmessig endring i deres elektroniske struktur, noe som fører til en naturlig endring i de kjemiske og de fysiske egenskapene til atomer av elementer som er avhengig av elektronisk struktur(radius av et atom eller ion, ioniseringspotensial, smelte- og kokepunkter, tetthet, standard formasjonsentalpi, etc.)
Endring i kjemiske egenskaper. På kjemisk interaksjon av atomer av alle grunnstoffer, tar elektronene i de ytre lagene, lengst fra kjernen og minst assosiert med den, størst del i denne prosessen, kalt valens. For s- og p-elementer er det kun elektronene i det ytre laget (s- og p-) som er valens. I d-elementer er valenselektronene s-elektronene til det ytre laget (primært) og d-elektronene til det ytre laget. For f-elementer vil valenselektronene være s-elektronene til det ytre laget (primært), d-elektronene til det pre-ytre laget (hvis noen), og f-elektronene til det pre-ytre laget.
Elementer lokalisert i en undergruppe av PSE, har samme struktur av en ( elektroniske analoger) eller to ytre lag ( komplette elektroniske analoger) og er preget av nære kjemiske egenskaper, er kjemiske analoger.
La oss vurdere elementene i gruppe 7 i hovedundergruppen A:
F 2s 2 2p 5
Cl 2s 2 2p 6 3s 2 3p 5 elektroniske analoger
Br 3s 2 3p 6 3d 10 4s 2 4p 5
jeg 4s 2 4p 6 4d 10 5s 2 5p 5 komplette analoger
Elementer som ligger i samme PSE-gruppe, men i forskjellige grupper, er ufullstendige elektroniske analoger, for eksempel Cl og Mn, V og P osv. Hvorfor?
Den elektroniske strukturen til nøytrale atomer av klor og mangan er helt forskjellige, og de kjemiske egenskapene til disse stoffene i fri tilstand er ikke like: Cl er et p-element, et typisk ikke-metall, gass, Mn er et d-metall. Klor- og manganioner med oksidasjonstilstander (+7) er allerede elektroniske analoger og har mye til felles kjemisk:
Oksyder Syrer Salter
Cl 2s 2 2p 6 3s 2 3p 5 Cl (+7) 2s 2 2p 6 Cl 2 O 7 HClO 4 klor KClO 4 kaliumperklorat
Mn 3s 2 3p 6 3d 5 4s 2 Mn(+7) 3s 2 3p 6 Mn 2 O 7 HMnO 4 mangan KMnO 4 kaliumpermanganat
Regelmessige endringer i grunnstoffenes kjemiske egenskaper over perioder er assosiert med en naturlig endring i atomers radier og strukturen til de ytre og pre-ytre elektroniske lagene av atomer.
La oss se på eksemplet med elementer fra periode 2, 3, 4.
Endre atomradier . Atomradius kan ikke måles direkte. Dette refererer til den såkalte "effektive radius", som bestemmes eksperimentelt som ½ den indre nukleære avstanden for det aktuelle elementet i krystallen. Den minste radiusen til hydrogenatomet er 0,53 o A (0,053 nm), den største er den til Cs - 0,268 nm.
Innenfor perioden avtar atomets radius (®), fordi ladningen til kjernen øker med samme antall elektronlag (tiltrekningen av elektroner til kjernen øker). Innenfor en undergruppe av en gitt gruppe øker atomets radius (¯), fordi antall elektroniske lag øker.
Fig. 11. Endringer i radiene til atomene til elementene i periodene 2,3,4
Trenden med avtagende radius over en periode gjentas (i hver periode), men på et nytt kvalitativt nivå. I små perioder, hvor det kun er s- og p-elementer, er endringen i radius fra grunnstoff til grunnstoff svært betydelig, siden det ytre elektronlaget endres. For overgang d-elementer endres radiusen mer monotont, siden den elektroniske strukturen til det ytre laget ikke endres, og de indre d-orbitalene skjermer kjernen og svekker påvirkningen av den økende ladningen på atomets ytre elektroniske lag. For f-elementer endres den elektroniske strukturen til et enda dypere lag, slik at radius endres enda mindre betydelig. Den langsomme reduksjonen i størrelsen på et atom med økende kjerneladning på grunn av screeningseffekten av d- og f-orbitaler på kjernen kalles d- og f-kompresjon.
La oss nå vurdere en betinget egenskap kalt "metallisitet". Trenden med endringer i denne egenskapen gjentar trenden med endringer i radiene til atomene vist i fig. 11.
I periode 2 og 3 endres de kjemiske egenskapene svært betydelig fra grunnstoff til grunnstoff: fra det aktive metallet Li (Na) gjennom fem grunnstoffer til det aktive ikke-metallet F (Cl), siden strukturen til det ytre elektroniske laget endres fra grunnstoff til grunnstoff .
I den 4. perioden blir s-elementene K og Ca fulgt av en gruppe overgangs-d-metaller fra Sc til Zn, hvis atomer er forskjellige i strukturen til ikke det ytre, men det pre-ytre laget, som er mindre gjenspeiles i endringen i kjemiske egenskaper. Fra Ga, endres det ytre elektronlaget igjen og øker kraftig ikke-metalliske egenskaper(Br).
I f-elementer endres det pre-eksterne elektronlaget, så kjemisk er disse elementene spesielt nærme. Derav deres samtidige forekomst i naturen og vanskeligheten med å separere.
Således, i enhver PSE-periode, observeres en naturlig endring i de kjemiske egenskapene til elementer (og ikke en enkel gjentakelse av egenskaper), forklart fra posisjonen til den elektroniske strukturen.
Endring i oksidenes natur over en periode(ved å bruke eksempelet fra periode 3).
oksid: Na 2 O MgO Al 2 O 3 SiO 2 P 2 O 5 SO 3 Cl 2 O 7
1444424443 + + +
H 2 O H 2 O i H 2 O uløselig 3 H 2 O H 2 O H 2 O
oksid: 2NaOH Mg(OH) 2 ¯Al 2 O 3 ×3H 2 Oº2Al(OH) 3 ¯SiO 2 ×H 2 OºH 2 SiO 3 ¯ 2H 3 PO 4 H 2 SO 4 2HClO 4
Al 2 O 3 × H 2 Oº2HAlO 2 144444442444443
Egenskaper: syrebaser
sterk svak svak middels sterk veldig
(alkali) vanskelig å oppløse vanskelig å oppløse styrke sterk
Karakter
oksid: basisk basisk amfotersyre syre syre
Således, i enhver periode, endres naturen til oksider (og andre forbindelser av samme type) naturlig: fra basisk til sur til amfoter.
Amfoterisiteten til aluminiumhydroksid viser seg i dets evne til å reagere med både syrer og baser: Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O; Al 2 O 3 + 2 NaOH = 2 NaAlO 2 + H 2 O.
Siden silisiumoksid ikke oppløses direkte i vann, kan den tilsvarende syren oppnås indirekte: Na 2 SiO 3 + H 2 SO 4 = H 2 SiO 3 ¯ + Na 2 SO 4. Oksydets sure natur kommer til uttrykk i reaksjonen med alkali: SiO 2 + 2 NaOH = Na 2 SiO 3 + H 2 O.
Ioniseringspotensialer. Ioniseringsenergi og elektronaffinitet u.
Nøytrale atomer av elementer, gjennom ulike interaksjoner, har evnen til å donere eller få elektroner, og dermed bli til positivt eller negativt ladede ioner.
Atomers evne til å donere elektroner er preget av verdien ioniseringspotensial
I (eV/atom) eller ioniseringsenergi(ioniseringsentalpi) DH ioniz. (kJ/mol atomer).
Ioniseringspotensial er energien som må brukes for å skille et elektron fra et atom (nøytralt, ueksitert, gassformet) og ta det til det uendelige.
Ioniseringsenergi bestemmes ved å bombardere atomer med elektroner akselerert i et elektrisk felt. Feltspenningen som hastigheten til elektroner er tilstrekkelig til å ionisere atomer kalles ioniseringspotensial. Ioniseringspotensialet er numerisk lik ioniseringsenergien uttrykt i eV.
H – e = H+, I = 13,6 eV/atom, 1 eV = 1,6,10 -22 kJ, N A = 6,02,10 23
DH ionisert. = 13,6 × 1,6,10 -22 × 6,02,10 23 » 1300 kJ/mol
Vanligvis sammenlignes bare de første ioniseringspotensialene, dvs. fjerning av det første elektronet. Fjerning av påfølgende elektroner krever mer energi, for eksempel for Ca-atomet I 1 I 2 I 3
6.11®11.87® 151.2
I løpet av perioden (¾®) øker ioniseringspotensialet, noe som er assosiert med en reduksjon i atomenes radius.
I undergrupper av PSE endres ioniseringspotensialer annerledes. I hovedundergruppene avtar potensialet fra topp til bunn, noe som er assosiert med en økning i radius og effekten av skjerming av kjernen med interne stabile skall s 2 p 6. I side undergrupper ah, ioniseringspotensialet øker fra topp til bunn, siden radius endres ubetydelig, og det uferdige skallet skjermer kjernen dårlig.
Generelt, Metaller er preget av lave ioniseringspotensialer, dvs. metallatomer gir lett fra seg elektroner (Cs, Fr har minimum ioniseringspotensial), for ikke-metaller – høye ioniseringspotensialverdier(maksimalt ved F).
Blant de kjente elementene flere metaller. Alle s- (unntatt H, He), d-, f-elementer er metaller. Blant p-elementene er metaller: Al, Ga, In, Tl, Sn, Pb, Bi.
Det maksimale antallet valenselektroner som et atom kan "gi fra seg" under interaksjon, og dermed oppnå maksimal positiv oksidasjonstilstand, tilsvarer gruppenummeret i PSE.
3 gr. Al 2s 2 2p 6 3s 2 3p 1 -3e ------- Al(+3) 2s 2 2p 6
6 gr. S 2s 2 2p 6 3s 2 3p 4 -6e ------- S(+6) 2s 2 2p 6
6 gr. Cr 3s 2 3p 6 3d 5 4s 1 -2e -----Cr(+2) 3s 2 3p 6 3d 4 -1e ---- Cr(+3) 3s 2 3p 6 3d 3 - 3e ---- - Cr(+6) 3s 2 3p 6
UNNTAK: F - ingen positiv oksidasjonstilstand
O - maksimal positiv oksidasjonstilstand +2 i OF 2-forbindelse
Elementer av gruppe 1 p/g B Au - maksimum +3
Cu, Ag - maksimum +2
Elementer av gruppe 8 p/gr B Co, Ni, Rh, Pd, Ir, Pt
Et atoms evne til å få elektroner karakteriserer elektronaffinitetsenergi–
E (eV/atom) eller entalpi for elektronaffinitet DH-affinitet (kJ/mol) er energien som frigjøres når et elektron fester seg til et nøytralt, ueksitert atom for å danne et negativt ladet ion.
F 2s 2 2p 5 + e = F - 2s 2 2p 6 + Q
Elektronaffinitetsenergi kan ikke måles direkte. Beregnet ved indirekte metoder fra Born-Haber-syklusen.
Generelt, ikke-metaller er preget av store verdier av E. I den elektroniske strukturen til atomene deres i det ytre laget er det 5 eller flere elektroner og 1-3 elektroner mangler til en stabil åtte-elektronkonfigurasjon. Ved å legge til elektroner får ikke-metallatomer negative oksidasjonstilstander, for eksempel S (-2), N (-3), O (-2), etc. Metaller preget av små verdier av E . Metaller har ikke negative oksidasjonstilstander!
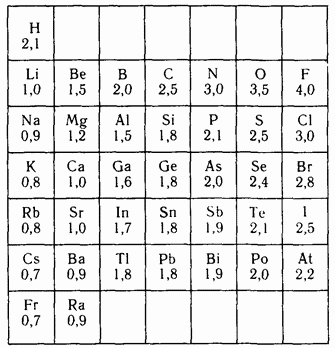
Elektronegativitet. For å løse problemet med å flytte et elektron fra ett atom til et annet, er det nødvendig å ta hensyn til begge disse egenskapene. Den halve summen av ioniseringsenergi og elektronaffinitet (modulo) kalles elektronegativitet (EO). Vanligvis brukes ikke absolutte verdier, men relative (REO).
EO for et Li- eller Ca-atom tas som en enhet av EO og EO for andre elementer beregnes ved hvor mange ganger EO for andre elementer er større eller mindre enn det valgte. Åpenbart må de atomene som holder elektronene sine fast og lett aksepterer andre ha høyeste verdier OEO er typiske ikke-metaller - fluor (OEO = 4), oksygen (OEO = 3,5); for hydrogen og OEO = 2,1, og for kalium - 0,9. Etter periode øker EO, etter hovedundergrupper avtar den. Metaller har lave EO-verdier og gir lett fra seg elektronene sine - reduksjonsmidler. Ikke-metaller, tvert imot, godtar lett elektroner - oksidasjonsmidler. OEO-verdiene er gitt i oppslagsboken. Vi vil bruke dem til å kvalitativt vurdere polariteten til en kjemisk binding.
*Note. Ved å bruke begrepet elektronegativitet, må vi huske at EO-verdier ikke kan betraktes som konstante, fordi de avhenger av oksidasjonstilstanden og av hvilket atom det samhandler med.
De kjemiske egenskapene til grunnstoffer manifesteres av samspillet mellom atomene deres. Den periodiske tabell av elementer gjenspeiler den vanlige endringen i disse egenskapene.
Typene konfigurasjoner av de ytre energinivåene til atomer bestemmer hovedtrekkene i den kjemiske oppførselen til elementer. Disse funksjonene er spesifikke for elementer i hovedundergruppene (s- og p-elementer), sekundære undergrupper (-elementer) og -elementer (lantanider og aktinider).
En spesiell plass er okkupert av elementene i den første perioden (H og He). Den høye kjemiske aktiviteten til atomisk hydrogen forklares av evnen til enkelt å gi fra seg et enkelt elektron, mens den elektroniske konfigurasjonen av heliumatomet er veldig stabil, noe som bestemmer dets kjemiske treghet.
Siden elementene i hovedundergruppene har sine ytre energinivåer fylt (med samme periodenummer), endres egenskapene til elementene merkbart ettersom ordenstallet øker. Således, i den andre perioden (konfigurasjon - et kjemisk aktivt metall som lett taper et elektron - også et metall, men mindre aktivt Den metalliske karakteren til det neste elementet er svakt uttrykt.
Åtte-elektronkonfigurasjonen til det ytre energinivået er ekstremt sterk, og det er grunnen til at neon er en edelgass.
En lignende karakter av endringer i egenskaper er observert i elementer av den tredje perioden, så vel som i elementer av alle påfølgende perioder. Imidlertid har svekkelsen av styrken til bindingen mellom de ytre elektronene og kjernen til elementer i hovedundergruppene etter hvert som de vokser, en viss effekt på egenskapene deres. Dermed viser p-elementer av samme gruppe en økning metalliske egenskaper. I hovedundergruppen til gruppe VIII svekkes stabiliteten til konfigurasjonen (når den øker), som et resultat av at krypton (den fjerde perioden) allerede får evnen til å danne kjemiske forbindelser.
Spesifisiteten til -elementene i den fjerde til sjette perioden skyldes også at de er skilt fra -elementene med sett med elementer, i atomene som de tidligere energinivåene er fylt av.
For d-elementer i sideundergrupper fullføres ufullstendige nivåer, hvor hovedkvantetallet av elektroner er ett mindre enn periodetallet. Konfigurasjonen av de ytre energinivåene til d-elementer er som regel Alle d-elementer er metaller.
Eksperimentelle studier har etablert et forhold

Ris. 1.7. Avhengighet av den første ioniseringsenergien av atomnummeret til grunnstoffet Z
kjemiske og fysiske egenskaper til grunnstoffer fra deres plassering i det periodiske systemet.
Ioniseringsenergi.
Den viktigste egenskapen til et grunnstoff, direkte relatert til den elektroniske strukturen til atomet, er ioniseringsenergien.
Ioniseringsenergi er energien som må brukes for å abstrahere og fjerne et elektron fra et atom i et ion eller molekyl. Ioniseringsenergi uttrykkes i joule eller elektronvolt, eV. Ioniseringsenergi er et mål på den reduserende kraften til et atom. Jo lavere ioniseringsenergiverdien er, jo høyere er atomets reduserende evne. Atomer mister elektroner og blir positivt ladede ioner. For et gitt atom eller ion kalles energien som kreves for å abstrahere og fjerne det første elektronet den første ioniseringsenergien til det andre - den andre ioniseringsenergien
Ioniseringsenergien øker i følgende rekkefølge: siden fjerning av et elektron fra et elektrisk nøytralt atom skjer lettere enn fra et ion. I fig. Figur 1.7 viser avhengigheten av atomnummeret til grunnstoffet. Sharp-maksima tilsvarer atomer av edelgasser, som har den mest stabile elektroniske konfigurasjonen. Minimaene til kurven er karakteristiske for alkalimetaller, hvis atomer gir opp elektron på det ytre nivået, skaffe seg konfigurasjonen av atomet til den forrige edelgassen. Dermed er periodene på kurven i fig. 1.7 samsvarer fullt ut med periodene i Mendeleev-systemet. I løpet av en periode endres det ikke monotont. Kurven viser sekundære mindre skarpe maksima, tilsvarende
fylle -undernivået til elementer i gruppe II. I de følgende gruppe III-elementene reduserer utseendet til det første -elektronet igjen ioniseringsenergien. De neste maksima på kurven tilsvarer elementer i gruppe V, som tilsvarer den energimessig gunstige halve fyllingen av -subnivået. For gruppe VI-elementene som ligger bak dem, avtar ioniseringsenergien igjen.
I gruppe II i det periodiske systemet er skarpe sekundære maksima tilsvarende forklart av påvirkningen fra det oppbygde d-undernivået. Innenfor en gruppe synker verdiene vanligvis når de øker, noe som er assosiert med en økning i avstanden til det ytre elektroniske nivået fra kjernen.
Elektronaffinitet.
Elektronaffinitet er energien som frigjøres når et elektron fester seg til et atom, molekyl eller radikal. Det uttrykkes i de samme enhetene som ioniseringsenergi.
Atomer av oksiderende elementer, som aksepterer elektroner, blir til negativt ladede ioner. Elektronaffinitetsenergien til atomer (så vel som ioniseringsenergien) endres naturlig i samsvar med naturen til de elektroniske strukturene til elementenes atomer. I perioder fra venstre til høyre øker elektronaffiniteten og oksiderende egenskaper til grunnstoffer. I grupper fra topp til bunn har elektronaffiniteten en tendens til å avta.
Halogener har den høyeste elektronaffiniteten, siden når ett elektron legges til et nøytralt atom, får de en fullstendig elektronisk konfigurasjon edelgass. Alkalimetaller er preget av lave elektronaffiniteter. For å avgjøre hvilket atom som lettere gir eller får et elektron, tas begge indikatorene i betraktning: ioniseringsenergi og elektronaffinitet. I følge Mulliken kalles halve summen av ioniseringsenergi og elektronaffinitet elektronegativitet (EO)
Tatt i betraktning vanskeligheten med å bestemme verdien av elektronaffinitet, foreslo den amerikanske forskeren Pauling et termokjemisk system, i henhold til hvilket elektronegativiteten til atomene A og B bestemmes basert på bindingsenergiene til atomers elektronegativitetsskala s. 28.
Elektronegativiteten øker fra venstre til høyre for elementer i hver periode og avtar fra topp til bunn for elementer i samme gruppe i det periodiske systemet.
Størrelser på atomer og ioner (radii av atomer og ioner).
Atomer og ioner har ikke strengt definerte grenser på grunn av elektronenes bølgenatur. Derfor bestemmes de betingede radiene til atomer og ioner bundet til hverandre kjemisk binding V
krystaller. I fig. Figur 1.8 viser en kurve som uttrykker den periodiske avhengigheten til atomenes radier av grunnstoffets atomnummer
Radiene til metallatomer i perioder med økende atomnummer av elementet reduseres, siden med samme antall elektronlag øker ladningen til kjernen, og følgelig tiltrekningen av elektroner av den observeres i elementer av små perioder, hvor

Ris. 1.8. Avhengighet av atomradius av atomnummeret til et grunnstoff
fyller det ytre energinivået med elektroner. I store perioder og -elementer observeres en jevnere reduksjon i radier med økende ladning av atomkjernen. Innenfor hver undergruppe av elementer øker som regel radiene til atomene fra topp til bunn ettersom antall energinivåer øker.
Radiene til ioner skiller seg fra radiene til atomene fordi de enten har mistet flere elektroner eller fått elektroner. Derfor er radiene til positivt ladede ioner mindre, og radiene til negativt ladede ioner er større enn radiene til de tilsvarende atomene. Radiiene til ioner avhenger også periodisk av atomnummeret til elementet. For eksempel, innenfor samme gruppe, øker radiene til ioner med samme ladning med økende elementantall (kjerneladning).
Betydningen av den periodiske lov.
Oppdagelsen av den periodiske loven av D.I. Mendeleev er av stor betydning for utviklingen av kjemi. Den periodiske loven generaliserte stort antall naturlover, var det det vitenskapelige grunnlaget for kjemi. Først av alt var det mulig å systematisere det rike, men spredte materialet som ble akkumulert på den tiden av generasjoner av kjemikere, om egenskapene til elementer og deres forbindelser, for å klargjøre mange konsepter, for eksempel konseptene "kjemisk element" og " enkelt stoff». Da den periodiske loven ble oppdaget, var 63 grunnstoffer kjent. Mendeleev spådde eksistensen av mange elementer som var ukjente på den tiden; scandium (ekaboron), gallium (ekaaluminium) og germanium (ekasiliium).
I motsetning til sine forgjengere, som prøvde å gi en eller annen systematikk av elementer, var Mendeleev overbevist om at han hadde oppdaget en naturlov, og basert på den nærmet han seg vurderingen av de tilgjengelige eksperimentelle dataene, som ikke alle virket pålitelige. I en rekke tilfeller, basert på den periodiske loven, endret han atommassene til grunnstoffer som var akseptert på den tiden, som tidligere var blitt bestemt på grunnlag av feilaktige ideer om elementenes valens og sammensetningen av forbindelser. For eksempel ble høyere uranoksid tildelt en sammensetning i stedet for
I noen tilfeller arrangerte D.I. Mendeleev elementer i samsvar med en naturlig endring i egenskaper, noe som tyder på en mulig unøyaktighet i verdiene til atommassene deres). Dette satte oppgaven med å klargjøre atommassene til disse grunnstoffene, og for noen av dem ble atommassene korrigert. I utgangspunktet så det ut til at oppdagelsen av edelgasser ville forstyrre periodisiteten til endringer i elementenes egenskaper, men så ble de gjenværende edelgassene oppdaget, som passet godt inn i det periodiske systemet.
Vitenskapsmannens spådommer gikk strålende i oppfyllelse. Siden da den periodiske lov og periodisk system elementer
D.I. Mendeleev fungerer som et vitenskapelig grunnlag for prognoser i kjemi. Siden utgivelsen av det periodiske systemet for grunnstoffer har det dukket opp mer enn 40 nye grunnstoffer. Basert på den periodiske loven ble transuranelementer kunstig oppnådd, inkludert nr. 101, kalt mendelevium. Den periodiske loven gjorde det mulig å forutsi egenskapene til grunnstoffer som ennå ikke var oppdaget, for eksempel 117, 118, 119 og 120.
Den periodiske loven spilte en avgjørende rolle for å belyse den komplekse strukturen til atomet. Ved å bruke det periodiske systemet med grunnstoffer er det mulig å bestemme fysisk-kjemiske konstanter kjemiske forbindelser basert på en sammenligning av kjente mengder. Den periodiske lov er grunnlaget for kjemi, først og fremst uorganisk; det hjelper med å løse problemer med å syntetisere stoffer med gitte egenskaper; utvikling av nye materialer, spesielt halvledere; utvalg av spesifikke katalysatorer for ulike kjemiske prosesser osv.
Det periodiske systemet har blitt en av de viktigste kildene til informasjon om kjemiske grunnstoffer og de enkle stoffene og forbindelsene de danner.Dmitry Ivanovich Mendeleev opprettet det periodiske systemet mens han jobbet med læreboken "Fundamentals of Chemistry", og oppnådde maksimal konsistens i presentasjonen av materialet. Mønsteret av endringer i egenskapene til elementene som danner systemet kalles periodisk lov.
I henhold til den periodiske loven formulert av Mendeleev i 1869, eiendommene kjemiske elementer er periodisk avhengig av atommassene deres. Det vil si at med en økning i relativ atommasse, gjentas egenskapene til elementene med jevne mellomrom (mer presist, stoffer dannet av elementer, men dette er ofte utelatt når man sier "elementers egenskaper").
Sammenlign: hyppigheten av skiftende sesonger over tid.
Dette mønsteret blir noen ganger brutt, for eksempel overstiger argon (en inert gass) neste kalium (alkalimetall) i masse. Denne motsetningen ble forklart i 1914 da man studerte strukturen til atomet. Serienummeret til et element i det periodiske systemet er ikke bare en sekvens, det har en fysisk betydning - det er lik ladningen til atomkjernen. Det er derfor
Den moderne formuleringen av den periodiske loven er:
Egenskapene til kjemiske elementer, så vel som stoffene som dannes av dem, avhenger periodisk av ladningen til atomkjernen.
En periode er en sekvens av elementer ordnet i rekkefølge med økende ladning av kjernen til et atom, som starter med et alkalimetall og slutter med en inert gass.
I løpet av perioden, med en økning i ladningen til kjernen, øker elektronegativiteten til elementet, de metalliske (reduserende) egenskapene svekkes og de ikke-metalliske (oksiderende) egenskapene til enkle stoffer øker. Dermed begynner den andre perioden med alkalimetallet litium, etterfulgt av beryllium, som viser amfotere egenskaper, bor, et ikke-metall, etc. Endelig er fluor et halogen og neon er en inert gass.
(Den tredje perioden begynner igjen med et alkalimetall - dette er periodisitet)
Periode 1-3 er små (inneholder én rad: 2 eller 8 elementer), periode 4-7 er store perioder, bestående av 18 eller flere elementer.
Da han kompilerte det periodiske systemet, kombinerte Mendeleev elementer kjent på den tiden som var like i vertikale kolonner. Grupper er vertikale kolonner av elementer som som regel har en valens i det høyere oksidet lik gruppetallet. Gruppen er delt inn i to undergrupper:
Hovedundergruppene inneholder elementer fra små og store perioder og danner familier med lignende egenskaper (alkalimetaller - I A, halogener - VII A, inerte gasser - VIII A).
(de kjemiske tegnene til elementene i hovedundergruppene i det periodiske systemet er plassert under bokstaven "A" eller, i svært gamle tabeller der det ikke er bokstavene A og B - under elementet i den andre perioden)
Sideundergrupper inneholder kun elementer av lange perioder, de kalles overgangsmetaller.
(under bokstaven "B" eller "B")
I hovedundergruppene med økende atomladning ( atomnummer) metalliske (reduserende) egenskaper øker.
-
Periodisk lov Og periodisk system kjemisk elementer D. OG. Mendeleev. Mønstre endringer eiendommer elementer liten perioder Og hoved- undergrupper V avhengigheter fra deres ordinær (atomisk) tall. -
Periodisk lov Og periodisk system kjemisk elementer D. OG. Mendeleev. Mønstre endringer eiendommer elementer liten perioder Og hoved- undergrupper V avhengigheter fra deres ordinær (atomisk) tall. -
Mønstre endringer eiendommer elementer liten perioder Og hoved- undergrupper V avhengigheter fra deres ordinær (atomisk) tall.
Struktur av elektroniske skall atomer første 20 kjemisk elementer periodisk systemer D. OG. Mendeleev. -
Struktur atomer kjemisk elementer. Sammensatt atomisk atomer første 20 kjemisk elementer periodisk systemer D. OG. Mendeleev. -
1. Tilkoblinger atomer karbon (C) med hverandre og andre elementer periodisk systemer D. OG. Mendeleev. I dette tilfellet dannes kjeder og sykluser. 2. Atom karbon kan være i tre forskjellige hybridtilstander. -
...(f.eks. Periodisk lov Og periodisk system kjemisk elementer D.OG.Mendeleev, teori om strukturen til organiske forbindelser D M. Butlerova, åpning lover termodynamikk, dannelse og utvikling kjemisk kinetikk osv.) -
Struktur atomer kjemisk elementer. Sammensatt atomisk kjerner. Struktur av elektroniske skall atomer første 20 kjemisk elementer periodisk systemer D. OG. Mendeleev. -
Tar hensyn til kjemisk sammensetning og struktur av utgangsmaterialene, velg den mest rasjonelle designen av produkter og etablere optimale moduser teknologiske prosesser deres produksjon. I avhengigheter fra størrelse, strukturell elementer skjelne... -
6. Mønstre biologiske rytmer tas i betraktning i forebygging, diagnostisering og behandling av sykdommer.
Fysiologiske rytmer har som regel perioder fra brøkdeler av et sekund til flere minutter (trykkrytmer
Rytmen er universell eiendom i live systemer. -
Kjemisk eiendommer. Den viktigste generalen kjemisk eiendommer aromatiske hydrokarboner er deres tendens til substitusjonsreaksjoner og større styrke på benzenringen.
Lignende sider funnet:10













