Hva er hybridisering i kjemidefinisjon. Hybridisering av elektronskyer
Hybridiseringsmetode atomorbitaler går ut fra antagelsen om at når et molekyl dannes, i stedet for det opprinnelige atom- og - elektronskyer Slike ekvivalente "blandede" eller hybride elektronskyer dannes som er forlenget mot naboatomer, på grunn av dette oppnår de mer fullstendig overlapping med elektronskyene til disse atomene. Slik deformasjon av elektronskyer krever energi. Men en mer fullstendig overlapping av valenselektronskyene fører til dannelsen av en sterkere kjemisk binding og derfor til en ekstra energigevinst. Hvis denne energigevinsten er tilstrekkelig til å mer enn kompensere for energien som brukes på deformasjonen av de innledende atomelektronskyene, fører en slik hybridisering til slutt til en reduksjon i den potensielle energien til det resulterende molekylet og følgelig til en økning i stabiliteten.
Tenk på, som et eksempel på hybridisering, dannelsen av et berylliumfluoridmolekyl. Hvert fluoratom som er en del av dette molekylet har ett uparet elektron,
![]()
som er involvert i dannelsen av kovalente bindinger. Et berylliumatom i en ueksitert tilstand har ingen uparrede elektroner:

Derfor, for å delta i dannelsen av kjemiske bindinger, må berylliumatomet gå inn i en eksitert tilstand:
Det resulterende eksiterte atomet har to uparrede elektroner: elektronskyen til en av dem tilsvarer tilstanden, den andre -. Når disse elektronskyene overlapper med p-elektronskyer to fluoratomer kan dannes kovalente bindinger(Fig. 38).
Men som allerede nevnt, med forbruk av noe energi, i stedet for de opprinnelige s- og p-orbitalene til berylliumatomet, kan det dannes to ekvivalente hybridorbitaler (-orbitaler). Formen og plasseringen av disse orbitalene er vist i fig. 39, hvorfra det er klart at hybridorbitalene er forlenget i motsatte retninger.
Overlappingen av hybrid-elektronskyer av berylliumatomet med p-elektronskyer av fluoratomer er vist i fig. 40.
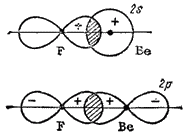
Ris. 38. Skjema for overlapping av -elektronskyer av fluoratomer med og -elektronskyer av et berylliumatom (for hver binding separat Områdene med overlapping av elektronskyer er skyggelagt).
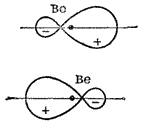
Ris. 39. Form (skjematisk representasjon) og relativ posisjon av hybrid-elektronskyer til et berylliumatom (for hver hybridorbital separat).
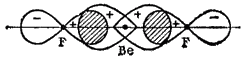
Ris. 40. Skjema for dannelsen av kjemiske bindinger i et molekyl. For å forenkle figuren er ikke hybridelektronskyene til berylliumatomet avbildet i sin helhet.
Takket være den langstrakte formen til hybridorbitalene oppnås en mer fullstendig overlapping av samvirkende elektronskyer, noe som betyr sterkere kjemiske bindinger. Energien som frigjøres under dannelsen av disse bindingene er større enn det totale energiforbruket for eksitasjon av berylliumatomet og hybridisering av dets atomorbitaler. Derfor er prosessen med molekyldannelse energetisk gunstig.
Det vurderte tilfellet med hybridisering av en s- og en p-orbital, som fører til dannelsen av to -orbitaler, kalles -hybridisering. Som fig. 39, -orbitalene er orientert i motsatte retninger, noe som fører til den lineære strukturen til molekylet. Faktisk er molekylet lineært, og begge bindingene i dette molekylet er likeverdige i alle henseender.
Andre tilfeller av hybridisering av atomorbitaler er også mulige, men antallet resulterende hybridorbitaler er alltid lik det totale antallet innledende atomorbitaler involvert i hybridisering. Således, når en s- og to p-orbitaler hybridiseres (-hybridisering - les "es-pe-two"), dannes tre like -orbitaler. I dette tilfellet er hybridelektronskyer plassert i retninger som ligger i samme plan og orientert i vinkler på 120° til hverandre (fig. 41). Åpenbart tilsvarer denne typen hybridisering dannelsen av et flatt trekantet molekyl.
Et eksempel på et molekyl der β-hybridisering skjer er borfluorid-molekylet. Her, i stedet for den opprinnelige s- og to p-orbitaler til det eksiterte boratomet
Tre like -orbitaler dannes. Derfor er molekylet bygget i form av en vanlig trekant, med et boratom i sentrum og fluoratomer i hjørnene. Alle tre bindingene i molekylet er likeverdige.
Hvis en s- og tre p-orbitaler (-hybridisering) er involvert i hybridisering, er resultatet dannelsen av fire hybrid-orbitaler, forlenget i retningene mot toppene til tetraederet, dvs. orientert i vinkler til hverandre ( Fig. 42). Slik hybridisering skjer for eksempel i et eksitert karbonatom under dannelsen av et metanmolekyl.

Ris. 41. Gjensidig arrangement av hybridelektronskyer.

Ris. 42. Gjensidig arrangement av hybridelektronskyer.
Derfor har metanmolekylet form som et tetraeder, og alle fire bindingene i dette molekylet er likeverdige.
La oss gå tilbake til å vurdere strukturen til vannmolekylet. Under dannelsen skjer -hybridisering av oksygenatomorbitaler. Det er grunnen til at HOH-bindingsvinkelen i et molekyl ikke er nær, men den tetraedriske vinkelen. Den lille forskjellen mellom denne vinkelen og 109,5° kan forstås hvis vi tar i betraktning den ulik tilstanden til elektronskyene som omgir oksygenatomet i vannmolekylet. Faktisk, i metanmolekylet (I)

alle åtte elektroner som okkuperer hybrid-orbitaler i karbonatomet deltar i dannelsen av co valensbindinger. Dette forårsaker en symmetrisk fordeling av elektronskyer i forhold til kjernen til karbonatomet. I mellomtiden, i molekylet, danner bare fire av de åtte elektronene som okkuperer hybridorbitalene til oksygenatomet bindinger, og to elektronpar forblir udelte, det vil si at de bare tilhører oksygenatomet. Dette fører til en viss asymmetri i fordelingen av elektronskyer som omgir oksygenatomet og, som en konsekvens, til et avvik i vinkelen mellom bindinger fra .
Når et ammoniakkmolekyl dannes, oppstår også atomorbitalene til sentralatomet (nitrogen). Det er derfor bindingsvinkelen er nær tetraedrisk. Den lille forskjellen mellom denne vinkelen og 109,5° forklares, som i vannmolekylet, av asymmetrien i fordelingen av elektronskyer rundt nitrogenatomets kjerne: av fire elektronpar deltar tre i dannelsen av N-H-bindinger, og en forblir udelt.
Som vist i fig. 39, 41 og 42 er hybridelektronskyene forskjøvet i forhold til atomkjernen.
Derfor faller ikke sentrum av den elektriske ladningen til et ensomt elektronpar lokalisert i en hybrid orbital sammen med posisjonen til atomkjernen, dvs. med sentrum av den positive ladningen som er tilstede i atomet. Dette skiftet i ladningen til et ensomt elektronpar fører til utseendet til et dipolmoment, som gir et betydelig bidrag til det totale dipolmomentet til molekylet. Det følger av dette at polariteten til et molekyl ikke bare avhenger av polariteten til individuelle bindinger og deres innbyrdes arrangement (se § 40), men også av tilstedeværelsen av ensomme elektronpar i hybridorbitaler og av romlig arrangement av disse orbitalene.
For elementer fra den tredje og påfølgende perioden kan -orbitaler også delta i dannelsen av hybridelektronskyer. Tilfellet -hybridisering er spesielt viktig når en, tre og to -orbitaler deltar i dannelsen av hybridorbitaler. I dette tilfellet dannes seks ekvivalente hybridorbitaler, langstrakte i retningene mot toppene til oktaederet. Den oktaedriske strukturen til molekyler, ioner og mange andre forklares ved -hybridisering av atomorbitalene til sentralatomet.
Multiplisitet av kovalent binding
For en kovalent binding er tilfeller mulige når to atomer i et molekyl ikke er forbundet med en binding, men med to eller flere, det vil si at det ikke dannes ett felles elektronpar, men flere. Eksempler inkluderer molekyler N 2 , O 2 , CH 2 = CH 2 (etylen) og acetylen. Når flere bindinger dannes, vil en av dem være σ og de andre π. σ-bindingen dannes først som en sterkere binding.
Atomer danner ofte bindingene sine ved å bruke elektroner fra forskjellige undernivåer. La oss vurdere et eksempel på dannelsen av et BeCl 2-molekyl.
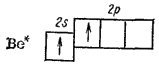
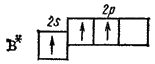
I sin normale tilstand kan ikke beryllium delta i dannelsen av kjemikalier forbindelser, i forbindelse med fravær av uparrede elektroner. Men siden beryllium har et fritt p-undernivå, er en overgang av atomet til en eksitert tilstand mulig, som er preget av sammenkoblingen av elektroner og overgangen til en av dem fra s- til p-undernivået.
| s | s |
| ↓ |
4 Vær:.. 2s 2 → Vær *: 2s 1 2p 1
Ved å ha to uparrede elektroner, er berylliumatomet i stand til å danne to bindinger via utvekslingsmekanismen.
Bindingene som dannes må være forskjellige i energi, siden elektronene er på forskjellige undernivåer. Imidlertid er det eksperimentelt bevist at begge forbindelsene er nøyaktig like. Følgelig, når kjemiske bindinger dannes, er atomorbitaler på linje i energi og form. Denne prosessen kalles - hybridisering , og "justerte" orbitaler kalles hybrid.
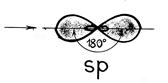
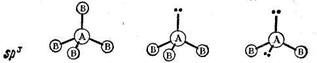
Tilfellet med hybridisering av en s- og en p-orbital kalles sp hybridisering .
Sp-hybridisering er preget av en lineær struktur av molekylet, en bindingsvinkel på 180° Denne typen hybridisering er observert i elementer i gruppe II.
For eksempel: et molekyl av berylliumklorid BeCl 2 - et berylliumatom for å danne to bindinger med kloratomer går inn i en eksitert tilstand (som vist ovenfor). Som et resultat, elektronskyer av en s-(sfærisk handikap) og en r-elektron (som har et forsprang på et volum åtte) blir utsatt for sp-hybridisering, som et resultat av at det dannes to hybridskyer, plassert i rommet i en vinkel på 180 0:

For hvert av de to kloratomene forekommer ikke hybridisering, siden det er ett nødvendig uparet elektron (siden elektronet er på p-subnivået, er formen på elektronskyen en tredimensjonal åttefigur) for å danne en binding med beryllium:
| s | s |



I sp 3 hybridisering En s og tre p orbitaler er involvert, noe som resulterer i fire hybrid orbitaler. Denne typen hybridisering er typisk for elementer fra gruppe IV.
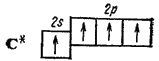
For eksempel: metanmolekyl CH 4 6 C: 2s 2 2p 2 → C *: 2s 1 2p 3
Tema: Introduksjon til organisk kjemi
Leksjon: Geometri av molekyler. Begrepet hybridiseringsteori
ved å bruke eksemplet med molekyler med enkeltbindinger
Eksternt nivå karbonatom i grunntilstanden (ueksitert). beskrevet av formelen 2s 2 2p 2 eller diagrammet:
|
2 s |
Dette bygget inneholder forutsetningene for en unik symmetri- for fire elektroner er det bare 4 orbitaler. Inn igjen midten av 19århundre, antok den tyske forskeren Friedrich Kekule med rette at i organiske forbindelser er valensen til karbon lik fire.
Fra synspunktet elektronisk struktur atom dette kan forklares som følger:
Ett elektron fra 2s orbital "hopper" til 2p orbital, og karbonatomet går inn i den såkalte eksiterte tilstanden:
Eksitert tilstand av et atom karbon 2s 1 2p 3:
|
2 s |
lar et karbonatom danne 4 kovalente bindinger gjennom en utvekslingsmekanisme.
De tre p-orbitalene er tradisjonelt avbildet i form av "håndvekter" gjensidig vinkelrett på hverandre, og s-orbitalen er i form av en ball. De tre bindingene som dannes av p-elektronene må være i en vinkel på 90 o i forhold til hverandre, og de er betydelig lengre enn bindingen som dannes av s-elektronet. Men metan CH 4 er et symmetrisk tetraeder.
Tilbake i 1874, mange år før direkte bestemmelse av strukturen til molekyler ble mulig, antydet Jacob Henrik van't Hoff (1852-1911), mens han var student ved Universitetet i Utrecht, at karbonatomet i forbindelser har en tetraedrisk struktur. Strukturen til CH 4-metanmolekylet er et vanlig tetraeder med et karbonatom i sentrum. Bindevinkler N-C-N bindinger lik 109 o 28'.
En forenklet forklaring: alle orbitaler i det ytre nivået av karbon er justert i energi og form, blandet, dvs. "hybridisere", og danner identiske hybridorbitaler. Se fig. 1.
Ris. 1. Hybridisering er blanding av elektronskyer under dannelsen av kjemiske bindinger
Blanding en s-orbitaler og tre s-orbitaler gir fire sp 3-hybride orbitaler, langstrakte i hjørnene av tetraederet med C-atomet i sentrum. Karbon i metan er i en tilstand av sp 3 hybridisering. Ris. 2.

Ris. 2. Struktur av metan
Strukturen til ammoniakk
På samme måte hybridiseres de fire orbitalene til nitrogenatomet inn ammoniakkmolekyl NH 3: Nitrogenatomet har 5 elektroner i sitt ytre skall. Derfor inneholder en sp 3 orbital et ensomt elektronpar, og de tre andre inneholder elektronpar av N-H-bindinger. Alle fire elektronparene er plassert i hjørnene av det forvrengte tetraederet (elektronskyen til det ensomme paret er større enn det til bindingsparet). Ris. 3

Ris. 3. Struktur av ammoniakk
Struktur av vann
Oksygenatomet har 6 elektroner i sitt ytre skall. Derfor inneholder to sp 3 orbitaler ensomme elektronpar, og de resterende to inneholder elektronpar O-H-bindinger. Molekylet har en vinkelstruktur. Ris. 4.
Ris. 4. Struktur av vann
Når man analyserer strukturen til molekyler på denne måten, er det viktig å ikke forveksle geometrien til arrangementet av elektronpar i rommet og geometrien til kjemiske bindinger. Vi ser at i ammoniakk og vann ikke alle elektronpar deltar i dannelsen av kjemiske bindinger.
Geometrien til molekyler eller kjemiske bindinger vurderer arrangementet av atomer i rommet, uten å beskrive arrangementet av ensomme elektronpar. Elektronskyene til hybridorbitaler prøver å skyve unna hverandre så langt som mulig. Hvis det er fire skyer, vil de spre seg til hjørnene av tetraederet, tre - de vil være plassert i planet i en vinkel på 120 °.
MolekylstrukturBF 3
Det er 3 elektroner i det ytre nivået av et boratom. Når bindinger dannes, går bor, som karbon, inn i en eksitert tilstand. En s- og to p-orbitaler, som inneholder elektroner, hybridiserer for å danne tre identiske sp 2-hybridorbitaler, plassert i hjørnene av en likesidet trekant med et boratom i sentrum. Ris. 5
Ris. 5. Struktur av borfluorid
Konklusjon: Molekylær geometri vurderer arrangementet av atomer i rommet uten å beskrive arrangementet av ensomme elektronpar. Dermed er strukturen til et vannmolekyl, bestående av tre atomer, ikke tetraedrisk, men kantet.
Oppsummering av leksjonen
Du har fått en ide om emnet "Geometry of Molecules. Konseptet med teorien om hybridisering." Den universelle naturen til hybridiseringsprosessen for organiske, komplekse uorganiske stoffer og allotropiske modifikasjoner av karbon ble avslørt. Du lærte om avhengigheten til molekylers geometri av typen hybridisering av elektroniske orbitaler og egenskapene til stoffer av molekylers geometri.
Referanser
1. Rudzitis G.E. Kjemi. Grunnleggende generell kjemi. 10. klasse: lærebok for allmenne utdanningsinstitusjoner: grunnnivå / G. E. Rudzitis, F.G. Feldman. - 14. utgave. - M.: Utdanning, 2012.
2. Kjemi. 10. klasse. Profilnivå: akademisk. for allmennutdanning institusjoner/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin et al. - M.: Bustard, 2008. - 463 s.
3. Kjemi. 11. klasse. Profilnivå: akademisk. for allmennutdanning institusjoner/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin et al. - M.: Bustard, 2010. - 462 s.
4. Khomchenko G.P., Khomchenko I.G. Samling av problemer i kjemi for de som går inn på universiteter. - 4. utg. - M.: RIA " Ny bølge": Utgiver Umerenkov, 2012. - 278 s.
Lekser
1. nr. 1-3 (s. 22) Rudzitis G.E. , Feldman F.G. Chemistry: Organic chemistry. 10. klasse: lærebok for allmenne utdanningsinstitusjoner: grunnnivå / G. E. Rudzitis, F.G. Feldman. - 14. utgave. - M.: Utdanning, 2012.
2. Hvorfor, med samme type hybridisering (hvilken?), har metan- og ammoniakkmolekyler forskjellige romlige strukturer?
3. Hvordan er grunntilstanden til et karbonatom forskjellig fra den eksiterte tilstanden?
Typer hybridisering av s- og p-elektronskyer. Romlig konfigurasjon av molekyler.
1) sp – eller q 2 – hybridisering er karakteristisk når dannelsen av en binding involverer 1 s Og 1 p- elektron.
Ris. 16. Opplegg sp – hybridisering
Molekylet har en lineær struktur som AB 2.
2) sp 2 – eller q 3 – hybridisering. Hybride skyer er plassert i en vinkel på 120 0 i ett plan (fig. 17).
Ved dannelse av en hybridsky deltar én person s Og
 |
2p elektron.
Ris. 17. Ordning sp 2 - hybridisering
For eksempel et molekyl BCl 3
Molekylet har form som en flat trekant.
3) sp 3 – q 4 – hybridisering utføres på grunn av en s og tre p – elektroniske skyer. Skyer med denne typen hybridisering er lokalisert i en vinkel på 109 0 28 ¢ (fig. 18). 4 hybridskyer er rettet fra midten av et vanlig tetraeder til hjørnene. Et eksempel på et slikt molekyl kan være CH4, CCl4.
Ris. 18. Ordning sp 3– hybridisering
I tillegg til de som vurderes, er andre typer hybridisering av valensorbitaler og tilsvarende typer romlig konfigurasjon av molekyler mulig. Kombinasjon av en s – tre p – og en d – orbitaler fører til sp 3 d – hybridisering. Dette tilsvarer orienteringen til fem sp 3 d – hybridorbitaler til toppunktene til den trigonale bipyramiden. I tilfelle sp 3 d 2– hybridisering seks sp 3 d 2 hybridorbitaler er orientert mot toppunktene til oktaederet. Orienteringen av de syv orbitalene til toppunktene til den femkantede bipyramiden tilsvarer sp 3 d 3(eller sp 3 d 2 f) – hybridisering av valensorbitaler til det sentrale atomet i molekylet.
Dermed bestemmer retningen til kjemiske bindinger den romlige konfigurasjonen av molekyler.
La oss vurdere andre mulige typer nye molekyler.
Molekyler type AA eller AB. Denne typen inkluderer molekyler dannet av to identiske eller forskjellige atomer, mellom hvilke en enkelt ( s- sigma) binding, sistnevnte kan dannes på grunn av samspillet mellom to s – elektroner, en fra hvert atom ( s¢ - s¢), to p – elektroner ( p¢ - p¢) eller to elektroner blandet type (s¢ - p¢) (Fig. 19). Slike bindinger oppstår mellom atomer av elementer som har en s – eller p – elektron: hydrogen, gruppeelementer I.A.(alkalimetaller) og grupper VIIA(halogener). Molekyler av denne typen har en lineær form, f.eks. H 2, F 2, Cl 2, Br 2, J 2, Zi 2, Na 2, K 2, HCl osv.
Ris. 19. Overlappende s- Og p- orbitaler
med utdanning s- kommunikasjon
Molekyler som AB 2, AB 3. De dannes på grunn av samspillet mellom to p – elektronene til atomet I Og s – elektroner av to atomer EN. To uparrede p- elektroner er karakteristiske for atomer av elementer VI A grupper, dvs. for oksygen og dets analoger (kalkogener).
Elektroniske skyer p- elektroner er plassert i forhold til hverandre i en vinkel på 90 0 langs koordinataksene x Og y.
Ris. 20. Overlappende orbitaler i et vannmolekyl
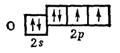
For eksempel i et molekyl H2O(Fig. 20) skyoverlapping s – elektroner med skyer p – elektroner forekommer på stedet angitt av skyggelegging, og derfor må kjemiske bindinger rettes i en vinkel på 90 º. Slike molekyler kalles hjørne. Imidlertid, ifølge eksperimentelle data, er molekyler med en annen bindingsvinkel mye mer vanlige. For eksempel har et vannmolekyl en bindingsvinkel på 104,5º. en av grunnene til dette fenomenet, ifølge teorien om valensbindinger, er tilstedeværelsen av ikke-bindende elektronpar ved det sentrale atomet. Forvrengningen av bindingsvinkler i dette tilfellet er forårsaket av gjensidig frastøtning av bindende og ikke-bindende elektronpar i sentralatomet. Det bør tas i betraktning at skyen til et bindende elektronpar (lokalisert mellom to atomer) tar opp mindre plass enn skyen til et ikke-bindende elektronpar, derfor i de fleste i større grad frastøting skjer mellom ikke-bindende par, noe mindre frastøting mellom et ikke-bindende par og et bindende par, og til slutt mindre frastøting mellom bindende elektronpar. Dette kan sees i strukturen til molekylene metan, ammoniakk og vann. De sentrale atomene i disse molekylene danner kjemiske bindinger på grunn av elektroner s s 3 - hybridorbitaler står for fire elektroner
Dette bestemmer dannelsen av fire bindinger C–H og arrangementet av hydrogenatomene til metanmolekylet CH 4 ved hjørnene av tetraederet (fig. 21)

Ris. 21. Overlappende orbitaler i metanmolekylet
 |
Nitrogenatomet har fire sp 3 - hybridorbitaler står for fem elektroner:
Følgelig viser et par elektroner seg å være ikke-bindende og opptar ett av sp 3 – orbitaler rettet mot toppene til tetraederet. På grunn av den frastøtende effekten av det ikke-bindende elektronparet, vil bindingsvinkelen i ammoniakkmolekylet H3N viser seg å være mindre enn tetraedrisk og utgjør < HNH = 107,3º .
Det er nå klart at når man vurderer et vannmolekyl, bør bindingsvinkelen være enda mindre, dvs. ved oksygenatomet 4 sp 3– hybridorbitaler står for seks elektroner, dvs. to sp 3 – Hybride orbitaler opptar ikke-bindende elektronpar. De frastøtende handlingene til to
ikke-bindende par manifesterer seg i større grad. Derfor blir bindingsvinkelen forvrengt mot den tetraedriske vinkelen enda sterkere i vannmolekylet H2O utgjør < HOH = 104º,5¢ . Med en økning i antall ikke-bindende elektroner i sentralatomet endres også den romlige konfigurasjonen av molekylene (tabell 7). Så hvis et molekyl har formen av et vanlig tetraeder med et karbonatom i sentrum, så når det gjelder et molekyl H3N vi kan anta at en av toppunktene til tetraederet er okkupert av et ikke-bindende elektronpar og molekylet har form av en trigonal pyramide. I et molekyl H2O to hjørner av tetraederet er okkupert av elektronpar, og selve molekylet har en vinkel V- figurativ form.
 |
tetraeder trigonal kantet
type AB 4 pyramide type AB 2 (A 2 B)
CH 4 type AB 3 NH 3 H 2 O
Kommunikasjonspolariteter. Bindingen mellom atomer av forskjellige elektroner er alltid mer eller mindre polar. Dette skyldes forskjellen i størrelse og elektronegativitet til atomene. For eksempel i et molekyl av hydrogenklorid HCl den bindende elektronskyen forskyves mot det mer elektronegative kloratomet. Som et resultat blir ladningen til hydrogenkjernen ikke lenger kompensert, og på kloratomet blir elektrontettheten for høy sammenlignet med ladningen til kjernen.
Tabell 7
Romlig konfigurasjon av molekyler ABn
| Type hybridisering | Antall elektronpar av atom A | Type molekyl | Romlig konfigurasjon | Eksempler | |
| Binding | Uforpliktende | ||||
| sp | AB 2 | lineær | BeCl 2 (g) CO 2 | ||
| sp 2 | AB 3 AB 2 | trekantet hjørne | BCl3, COO3 | ||
| sp 3 | AB 4 | tetraedrisk | CCl4, BH, NH | ||
| AB 3 AB 2 | trigonal permidal vinkel | H 3 N, H 3 PH 2 O | |||
| sp 3 d 1 | AB 5 | trigonal-bipyramidal | PF5, SbCl5 |
Med andre ord, hydrogenatomet i HCl polarisert positivt og kloratomet negativt polarisert; En positiv ladning vises på hydrogenatomet, og en negativ ladning på kloratomet. Denne avgiften d- kalt effektiv, kan den etableres eksperimentelt. I følge tilgjengelige data, effekten
effektiv ladning på et hydrogenatom i et molekyl HCl utgjør dH = +0,2 og på kloratomet d Cl = -0,2 absolutt ladning av et elektron.
Avhengig av graden av forskyvning (polarisering) av den forbindende elektronskyen, kan forbindelsen være ikke-polar, polar eller ionisk. Ikke-polare og ionisk binding representerer ekstreme tilfeller av polar kobling.
Ikke-polare og polare molekyler. I upolare molekyler faller tyngdepunktene til positive og negative ladninger sammen. Polare molekyler er dipoler, dvs. systemer som består av to ladninger like store og motsatte i fortegn ( +q Og –q), ligger i en viss avstand l fra hverandre, som kalles dipollengden. Polariteten til et molekyl, så vel som polariteten til en binding, vurderes ved verdien av dets dipolmoment, betegnet m
m = l q,
Hvor l- dipollengde, q– størrelsen på den elektriske ladningen.
l har en verdi i størrelsesorden atomets diameter, dvs. 10 -8 cm, og elektronladningen 4,8∙10 -10 e-post Kunst. enheter, derfor m uttrykt ved en verdi av ordren 10 -18 e-post Kunst. enheter∙cm Denne mengden kalles Debye-enheten og dannes av bokstaven D. I SI-enheter m målt i coulomb-meter (K∙m); 1 D = 0,33∙10 -29 K∙m.
Verdiene til dipolmomentet til kovalente molekyler ligger innenfor området 0-4 D ionisk 4-11 D.
Dipolmomentet til et molekyl er vektorsummen av dipolmomentene til alle bindinger og ubundne elektronpar i molekylet. Resultatet av tilsetning avhenger av strukturen til molekylet. For eksempel et molekyl CO2, pga sp hybridisering av orbitalene til karbonatomet, har en symmetrisk lineær struktur.
(m = 1,84 D eller 0,61∙10 -29 K∙M)
Fraværet av et dipolmoment indikerer en svært symmetrisk struktur av molekylet. Tilstedeværelsen av et dipolmoment og dets størrelse bestemmer molekylets asymmetri.
Polariserbarhet av kommunikasjon. For å karakterisere reaktiviteten til molekyler er det viktig å vite ikke bare den innledende elektrontetthetsfordelingen, men også hvor lett den vil endre seg. Det siste tiltaket er bindingspolariserbarhet– dens evne til å bli polar (eller mer polar) som et resultat av virkningen av et elektrisk felt på den.
Som et resultat av polarisering kan det oppstå et fullstendig brudd på bindingen med overgangen av bindingselektronparet til et av atomene med dannelse av negative og positive ioner. Asymmetrisk bindingsspaltning med dannelse av ulikt ioner kalles heterolytisk.
homolytisk heterolytisk
gap gap
(dissosiasjon) (ionisering)
Heterolytisk spaltning skiller seg fra ødeleggelse av bindinger under desintegreringen av et molekyl til atomer og radikaler. I sistnevnte tilfelle bindingselektronparet blir ødelagt og prosessen kalles homolytisk. I samsvar med ovenstående bør man skille mellom dissosiasjonsprosessen og ioniseringsprosessen; i tilfelle HCl den første observeres under dens termiske dekomponering til atomer, den andre - under dens nedbrytning til ioner i løsning.
Under påvirkning av et eksternt elektrisk felt blir molekylet polarisert, dvs. en omfordeling av ladninger skjer i den og molekylet får en ny verdi av dipolmomentet. I dette tilfellet kan upolare molekyler bli til polare, og polare blir enda mer polare. Med andre ord, under påvirkning av et eksternt elektrisk felt, induseres en dipol i molekylene, kalt indusert eller indusert, som bare eksisterer under påvirkning av et eksternt elektrisk felt.













