Hvilke elementer har en enkeltbinding? Hva betyr "kovalent binding"?
n1.doc
3.2. Kovalent bindingKovalent binding- dette er en to-elektron, to-senter forbindelse, utført ved å dele et par elektroner.
La oss vurdere mekanismen for kovalent bindingsdannelse ved å bruke eksemplet med hydrogenmolekylet H2.
Kjernen til hvert hydrogenatom er omgitt av en sfærisk elektronsky av et 1s-elektron. Når to atomer nærmer seg hverandre, tiltrekker kjernen til det første atomet elektronet til det andre, og elektronet til det første atomet tiltrekkes av kjernen til det andre. Som et resultat overlapper elektronskyene deres og danner en felles molekylsky. Som et resultat av overlappingen av elektronskyer av atomer, kovalent binding.
Skjematisk kan dette avbildes som følger:
N + N N : N
En kovalent binding dannes på lignende måte i et klormolekyl:
. . . . . . . .
: Cl + Cl Cl : Cl :
. . . . . . . .
Hvis en binding dannes av identiske atomer (med samme elektronegativitet), så er elektronskyen plassert symmetrisk i forhold til kjernene til de to atomene. I dette tilfellet snakker de om kovalent ikke-polar binding .
Kovalent polar binding dannes når atomer med ulik elektronegativitet samhandler.
. . . .
N + Cl H : Cl :
. . . .
Elektronskyen til bindingen er asymmetrisk, forskjøvet til et av atomene med høyere elektronegativitet, i dette tilfellet til klor.
De gitte eksemplene karakteriserer den kovalente bindingen som dannes av metabolsk mekanisme.
Den andre mekanismen for dannelsen av kovalente bindinger er giver-akseptor. I dette tilfellet dannes bindingen på grunn av det ensomme elektronparet til ett atom (donor) og den frie orbitalen til et annet atom (akseptor):
N 3 N : + H + +
Forbindelser med kovalente bindinger kalles atomisk.
Vilkår for utdanning kjemisk binding
1. En kjemisk binding dannes når atomene er tilstrekkelig nær hverandre i tilfelle at den totale indre energien i systemet avtar. Dermed viser det resulterende molekylet seg å være mer stabilt enn individuelle atomer og har mindre energi.
2. Dannelsen av en kjemisk binding er alltid en eksoterm prosess.
3. En forutsetning for dannelsen av en kjemisk binding er tilstedeværelsen av økt elektrontetthet mellom kjernene.
For eksempel er radiusen til et hydrogenatom 0,053 nm. Hvis hydrogenatomene bare kom nærmere hverandre under dannelsen av molekylet, ville den indre nukleære avstanden være 0,106 nm. Faktisk er denne avstanden 0,074 nm, derfor vil det å bringe kjernene nærmere føre til en økning i elektrontettheten.
Kvantitative egenskaper ved kjemiske bindinger
1. Bindingsenergi, E, kJ/mol
Kommunikasjonsenergi- dette er energien som frigjøres når en binding dannes eller mengden energi som må brukes for å bryte bindingen.
Jo høyere bindingsenergi, jo sterkere forbindelse. Majoritetsbindingsenergi kovalente forbindelser er i området 200 - 800 kJ/mol.
2. Bindingslengde, r 0 , nm
Lenkelengde er avstanden mellom sentrene til atomene (internukleær avstand).
Jo kortere bindingslengden er, desto sterkere er forbindelsen.
Tabell 3.1.
Energi- og lengdeverdier for noen bindinger
| Forbindelse | r 0 , nm | E, kJ/mol |
| S - S | 0, 154 | 347 |
| C = C | 0,135 | 607 |
| C C | 0,121 | 867 |
| H - F | 0,092 | 536 |
| H-Cl | 0,128 | 432 |
| H-Br | 0,142 | 360 |
| H - jeg | 0,162 | 299 |
3. Bindevinkler avhenger av den romlige strukturen.
Egenskaper til kovalente bindinger
1. Retning av kovalent binding oppstår i retning av maksimal overlapping av de elektroniske orbitalene til interagerende atomer, som bestemmer den romlige strukturen til molekylene, dvs. formen deres.
Skjelne -kommunikasjon- bindinger dannet langs linjen som forbinder sentrene til atomene. -bindinger kan dannes s - s, s - s Og s - s elektroniske skyer.
En -binding kan bare dannes r - r elektronskyer.
-forbindelse er en binding dannet på begge sider av en linje som forbinder sentrene til atomene. Denne bindingen er karakteristisk bare for forbindelser med flere bindinger (dobbelt og trippel).
Skjemaer for dannelse av - og -bindinger er presentert i fig. 3.1.
Ris. 3.1. Opplegg for dannelse av - og - bindinger.
2. Kovalent bindingsmetning- full bruk av valensorbitaler av atomet.
3.3. Metallkobling
Atomene til de fleste metaller på det ytre energinivået inneholder et lite antall elektroner (1 e - 16 elementer; 2 e - 58 elementer,
3. - 4 elementer; 5 e for Sb og Bi, og 6 e for Po). De tre siste grunnstoffene er ikke typiske metaller.
Under normale forhold er metaller krystallinske faste stoffer (unntatt kvikksølv). Metallkationer er lokalisert ved nodene til metallkrystallgitteret.
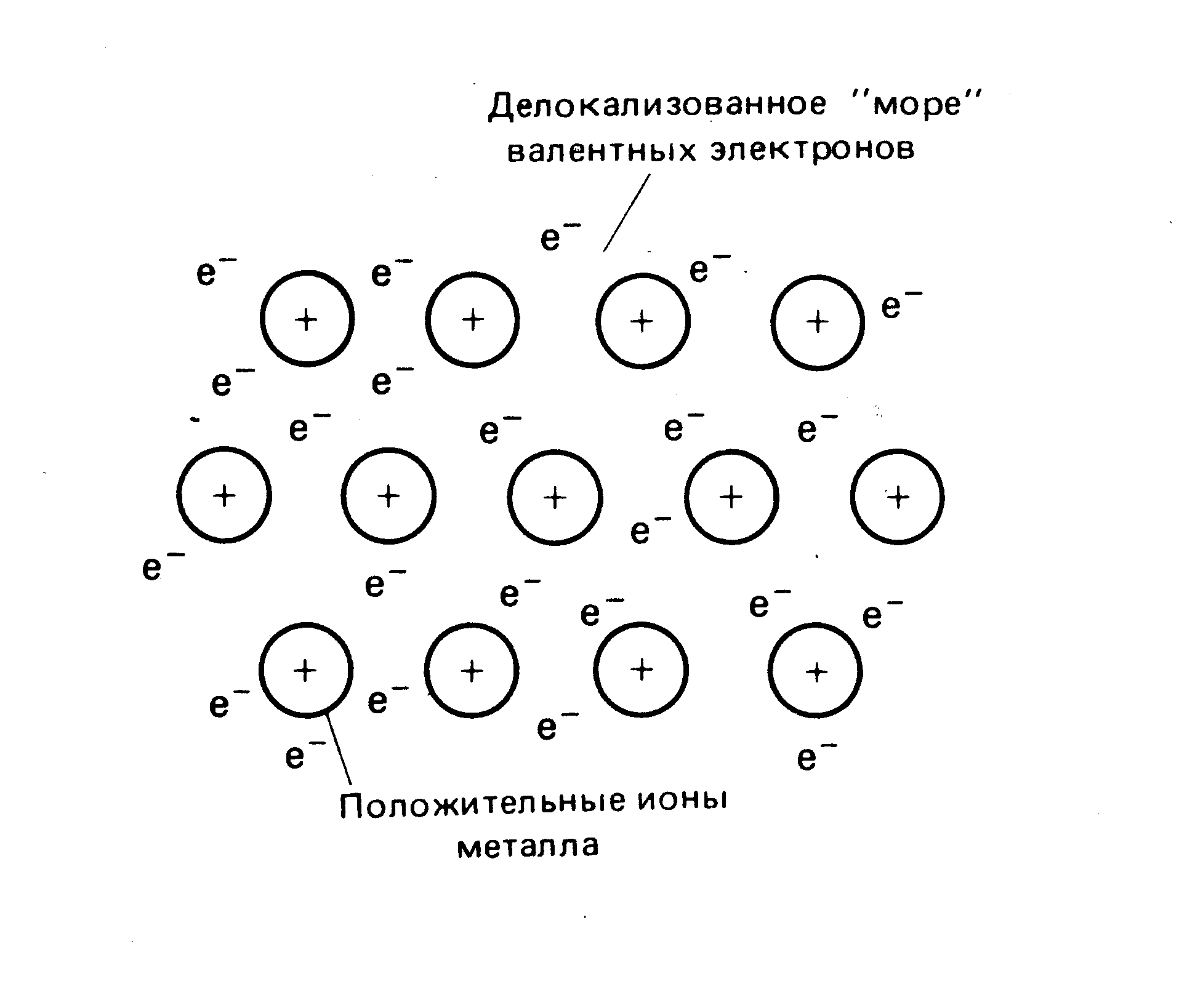
Ris. 3.2. Utdanningsordning metallforbindelse.
Valenselektroner har lav ioniseringsenergi og holdes derfor svakt tilbake i atomet. Elektroner beveger seg gjennom krystallgitteret og tilhører alle dets atomer, og representerer den såkalte "elektrongassen" eller "havet av valenselektroner". Dermed er kjemisk binding i metaller sterkt delokalisert. Dette bestemmer slike egenskaper som er karakteristiske for metaller som høy termisk og elektrisk ledningsevne, formbarhet og plastisitet.
Metallisk binding er karakteristisk for metaller og legeringer i fast og flytende tilstand. I damptilstand består metaller av individuelle molekyler (monatomiske og diatomiske) koblet sammen med kovalente bindinger.
For første gang om et slikt konsept som kovalent binding Kjemiske forskere begynte å snakke etter oppdagelsen av Gilbert Newton Lewis, som han beskrev som sosialiseringen av to elektroner. Senere studier gjorde det mulig å beskrive selve prinsippet om kovalent binding. Ord kovalent kan betraktes innenfor rammen av kjemi som et atoms evne til å danne bindinger med andre atomer.
La oss forklare med et eksempel:
Det er to atomer med små forskjeller i elektronegativitet (C og CL, C og H). Som regel er disse nærmest mulig bygget elektronskall edle gasser.
Når disse betingelsene er oppfylt, oppstår en tiltrekning av kjernene til disse atomene til elektronparet som er felles for dem. I dette tilfellet overlapper ikke elektronskyene hverandre bare, som i tilfellet med en kovalent binding, som sikrer en pålitelig forbindelse av to atomer på grunn av det faktum at elektrontettheten omfordeles og energien til systemet endres, noe som er forårsaket av "trekking" av ett atom inn i det indre nukleære rommet elektronisk sky en annen. Jo mer omfattende den gjensidige overlappingen av elektronskyer er, desto sterkere anses forbindelsen.
Herfra, kovalent binding- dette er en formasjon som oppsto gjennom gjensidig sosialisering av to elektroner som tilhører to atomer.
Som regel stoffer med molekylær krystallgitter dannes gjennom kovalente bindinger. Karakteristiske trekk inkluderer smelting og koking ved lave temperaturer, dårlig løselighet i vann og lav elektrisk ledningsevne. Fra dette kan vi konkludere: strukturen til elementer som germanium, silisium, klor og hydrogen er basert på en kovalent binding.
Egenskaper som er karakteristiske for denne typen tilkobling:
- Metningsevne. Denne egenskapen forstås vanligvis som det maksimale antallet bindinger som spesifikke atomer kan etablere. Denne mengden bestemmes av det totale antallet orbitaler i atomet som kan delta i dannelsen av kjemiske bindinger. Valensen til et atom kan derimot bestemmes av antall orbitaler som allerede er brukt til dette formålet.
- Fokus. Alle atomer streber etter å danne så mye som mulig sterke forbindelser. Den største styrken oppnås når den romlige orienteringen til elektronskyene til to atomer faller sammen, siden de overlapper hverandre. I tillegg er det nettopp denne egenskapen til en kovalent binding, for eksempel retningsbestemt, som påvirker det romlige arrangementet av molekyler, det vil si at det er ansvarlig for deres "geometriske form".
- Polariserbarhet. Denne posisjonen er basert på ideen om at det finnes to typer kovalente bindinger:
- polar eller asymmetrisk. En binding av denne typen kan kun dannes av atomer av forskjellige typer, dvs. de hvis elektronegativitet varierer betydelig, eller i tilfeller der det delte elektronparet er asymmetrisk delt.
- oppstår mellom atomer hvis elektronegativitet er praktisk talt lik og hvis elektrontetthetsfordeling er jevn.
I tillegg er det visse kvantitative:
- Kommunikasjonsenergi. Denne parameteren karakteriserer polar tilkobling når det gjelder dens styrke. Energi refererer til mengden varme som var nødvendig for å bryte bindingen mellom to atomer, samt mengden varme som ble frigjort under forbindelsen deres.
- Under bindingslengde og i molekylær kjemi forstås lengden av en rett linje mellom kjernene til to atomer. Denne parameteren karakteriserer også styrken til forbindelsen.
- Dipolmoment- en mengde som karakteriserer polariteten til valensbindingen.
kovalent binding
type kjemisk binding; utføres av et elektronpar som deles av de to atomene som danner bindingen. Atomer i et molekyl kan kobles sammen med en enkelt kovalent binding (H2, H3C-CH3), dobbel (H2C=CH2) eller trippel (N2, HCCH). Atomer som er forskjellige i elektronegativitet danner den såkalte. polar kovalent binding (HCl, H3C-Cl).
Kovalent binding
en av typene kjemiske bindinger mellom to atomer, som utføres av et felles elektronpar (ett elektron fra hvert atom). K. s. finnes både i molekyler (i alle aggregeringstilstander), og mellom atomene som danner krystallgitteret. K. s. kan binde identiske atomer (i H2, Cl2-molekyler, i diamantkrystaller) eller forskjellige (i vannmolekyler, i SiC-karborundumkrystaller). Nesten alle typer grunnleggende bindinger i molekyler av organiske forbindelser er kovalente (C ≈ C, C ≈ H, C ≈ N, etc.). K. s. veldig slitesterk. Dette forklarer den lave kjemiske aktiviteten til parafinhydrokarboner. Mange uorganiske forbindelser, hvis krystaller har et atomgitter, det vil si dannes ved hjelp av karbondioksid, er ildfaste, har høy hardhet og slitestyrke. Disse inkluderer noen karbider, silicider, borider, nitrider (spesielt de velkjente borazon BN), som har funnet anvendelse i ny teknologi. Se også Valens og Chemical Bond.
══V. A. Kireev.
Wikipedia
Kovalent binding
Kovalent binding(fra lat. co- "sammen" og vales- "å ha kraft") - kjemisk binding, dannet av overlappingen av et par valenselektronskyer. Elektroniske skyer som gir kommunikasjon kalles delt elektronpar.
Begrepet kovalent binding ble først introdusert av prisvinneren Nobelprisen Irving Langmuir i 1919. Begrepet refererte til en kjemisk binding på grunn av deling av elektroner, i motsetning til en metallisk binding, der elektronene var frie, eller en ionisk binding, der ett av atomene ga fra seg et elektron og ble et kation, og et annet atom aksepterte et elektron og ble et anion.
Senere (1927) ga F. London og W. Heitler, ved å bruke eksemplet med et hydrogenmolekyl, den første beskrivelsen av en kovalent binding fra kvantemekanikkens synspunkt.
Tatt i betraktning den statistiske tolkningen av M. Born-bølgefunksjonen, er sannsynlighetstettheten for å finne bindingselektroner konsentrert i rommet mellom kjernene til molekylet (fig. 1). Teorien om elektronparrepulsion vurderer de geometriske dimensjonene til disse parene. For elementer i hver periode er det således en viss gjennomsnittlig radius for et elektronpar:
0,6 for elementer opp til neon; 0,75 for elementer opp til argon; 0,75 for elementer opp til krypton og 0,8 for elementer opp til xenon.
De karakteristiske egenskapene til en kovalent binding - retningsbestemt, metning, polaritet, polariserbarhet - bestemmer de kjemiske og fysiske egenskapene til forbindelser.
Retningen til forbindelsen bestemmes av stoffets molekylære struktur og den geometriske formen til molekylet. Vinklene mellom to bindinger kalles bindingsvinkler.
Mettbarhet er atomers evne til å danne et begrenset antall kovalente bindinger. Antall bindinger dannet av et atom er begrenset av antallet ytre atomorbitaler.
Polariteten til bindingen skyldes ujevn fordeling av elektrontetthet på grunn av forskjeller i elektronegativiteten til atomene. På dette grunnlag er kovalente bindinger delt inn i ikke-polare og polare (ikke-polare - et diatomisk molekyl består av identiske atomer (H, Cl, N) og elektronskyene til hvert atom er fordelt symmetrisk i forhold til disse atomene; polar - et diatomisk molekyl består av forskjellige atomer kjemiske elementer, og den generelle elektronskyen skifter mot et av atomene, og danner derved en asymmetri i fordelingen av elektrisk ladning i molekylet, og genererer dipolmoment molekyler).
Polariserbarheten til en binding uttrykkes i forskyvningen av bindingselektronene under påvirkning av et eksternt elektrisk felt, inkludert det til en annen reagerende partikkel. Polariserbarhet bestemmes av elektronmobilitet. Polariteten og polariserbarheten til kovalente bindinger bestemmer reaktiviteten til molekyler mot polare reagenser.
To ganger nobelprisvinner L. Pauling påpekte imidlertid at «i noen molekyler er det kovalente bindinger på grunn av ett eller tre elektroner i stedet for et felles par». En kjemisk binding med ett elektron blir realisert i det molekylære hydrogenionet H.
Det molekylære hydrogenionet H inneholder to protoner og ett elektron. Enkeltelektronet i det molekylære systemet kompenserer for den elektrostatiske frastøtningen av de to protonene og holder dem i en avstand på 1,06 Å (kjemisk bindingslengde H). Sentrum av elektrontettheten til elektronskyen til molekylsystemet er like langt fra begge protonene ved Bohr radiusα=0,53 A og er symmetrisenteret til det molekylære hydrogenionet H.













