Stor oppslagsbok om kjemi eksamen. Kjemi: En komplett guide til forberedelse til Unified State Exam
Oppslagsboken inneholder alt det teoretiske materialet for kjemikurset som kreves for å bestå Unified State Exam. Den inkluderer alle innholdselementene som er testet på Unified State Exam i kjemi, og bidrar til å generalisere og systematisere kunnskap og ferdigheter for et videregående kurs. Teoretisk materiale presenteres i en kortfattet, tilgjengelig form. Hver del er ledsaget av eksempler på testoppgaver som lar deg teste kunnskapen din og graden av beredskap for sertifiseringseksamenen. Praktiske oppgaver samsvarer Unified State Exam-format. På slutten av manualen er det gitt svar på tester som vil hjelpe skoleelever og søkere til å teste seg selv og fylle ut eksisterende hull. Manualen er rettet til elever på videregående skole, søkere og lærere.
Mønstre for endringer i egenskapene til grunnstoffer og deres forbindelser etter perioder og grupper.
Moderne formulering av den periodiske loven av D.I. Mendeleev:
- egenskaper ved elementer, samt de enkle og komplekse stoffer er periodisk avhengig av ladningen til atomkjernen, lik grunnstoffets atomnummer.
Periodiske tabell kjemiske elementer - en naturlig klassifisering av kjemiske elementer, som er et tabellmessig uttrykk for den periodiske loven til D.I. Mendeleev. Det er en tabell som består av perioder (horisontale rader) og grupper (vertikale kolonner) av elementer.
Gruppenummer A = Antall valenselektroner: ns og np
Gruppe B-tall = Antall valenselektroner:ns og (n-1)d
I kortperiodeversjonen av det periodiske systemet er det 8 grupper. De er delt inn i undergrupper A (hoved) og B (sekundær).
I langperiodeversjonen av det periodiske system er det 18 grupper. De betegnes enten på samme måte som i korttidsversjonen, eller ganske enkelt med tall fra 1 til 18 (for eksempel gruppe IA eller 1, VIIB eller 17).
Periodenummer = Antall energinivåer fylt med elektroner = Betegnelse på siste energinivå (EL)
Det moderne periodiske system inkluderer 7 perioder. Hver periode begynner med et grunnstoff i hvis atom et elektron først dukker opp på det tilsvarende energinivået (hydrogen eller et alkalisk grunnstoff), og slutter med et grunnstoff i hvis atom nivået med samme nummer (edelgass) er fullstendig fylt.
Gratis nedlasting e-bok i et praktisk format og les:
- Håndbok til en analytisk kjemiker, Lazarev L.I., Kharlamov I.P., Yakovlev P.Ya., Yakovleva E.F., 1970
- Håndbok til en ung laboratoriekjemiker, Tikunova I.V., Artemenko A.I., Malevanny V.A., 1985
Følgende lærebøker og bøker:
- Nitrogenists håndbok, Fysisk-kjemiske egenskaper av gasser og væsker, Produksjon av prosessgasser, Rensing av prosessgasser, Ammoniakksyntese, 1986
E.V. Savinkina
Forlegger: AST
ISBN: 978-5-17-100943-4
Sjanger: Kjemi
Format: PDF
Kvalitet: Fin skanning
Illustrasjoner: Svart og hvit
Størrelse 10,5 MB
Beskrivelse: Oppslagsboken inneholder alt det teoretiske materialet for kjemikurset som kreves for å bestå Unified State Exam. Den inkluderer alle innholdselementene som er testet på Unified State Exam i kjemi, og bidrar til å oppsummere og systematisere kunnskap og ferdigheter for et videregående (videregående) kurs. Det teoretiske materialet presenteres i en kortfattet, tilgjengelig form. Hver del er ledsaget av eksempler på testoppgaver som lar deg teste kunnskapen din og graden av beredskap for sertifiseringseksamenen. Praktiske oppgaver tilsvarer Unified State Exam-formatet. På slutten av manualen er det gitt svar på tester som vil hjelpe skoleelever og søkere til å teste seg selv og fylle ut eksisterende hull. Manualen er rettet til elever på videregående skole, søkere og lærere.
Last ned Chemistry: en ny komplett oppslagsbok for forberedelse til Unified State Exam (2017) PDF
Kjemi: en ny komplett oppslagsbok for forberedelse til Unified State Exam (2017) PDF-nedlasting gratis og uten registrering:
Den elektroniske versjonen av boken "Chemistry: a new complete reference book for preparing for the Unified State Exam (2017) PDF" i utdanningssjangeren er gitt til informasjonsformål. Vi tar ikke gebyr for å laste ned boken, så hvis du likte boken Chemistry: a new komplett referansebok for forberedelse til Unified State Exam (2017) PDF, så takk forfatteren av boken ved å kjøpe boken i den offisielle e-bokbutikk. Vårt elektroniske bibliotek har ikke kommersielle formål; alt materiale er hentet fra åpne kilder på Internett som er fritt tilgjengelig. Du kan også laste ned andre bøker av sjangeren gratis og uten registrering. 


R.A. Lidin
Kjemi: Komplett guide for å forberede seg til Unified State-eksamenen
Forord
Oppslagsboken inneholder alt det teoretiske materialet fra skolekjemikurset som kreves for å bestå Unified State Exam, den endelige sertifiseringen av studenter. Dette materialet er fordelt i 14 seksjoner, hvis innhold tilsvarer emnene testet på Unified State Exam - fire innholdsblokker: "Kjemisk element", "Substans", "Kemisk reaksjon", "Kunnskap og anvendelse av stoffer og kjemiske reaksjoner ". For hver del gis det opplæringsoppgaver fra del A og B – med svarvalg og kort besvarelse. Seksjon 15 er i sin helhet viet til å løse regneoppgavene som inngår i eksamensdel C.
Testoppgaver er satt sammen på en slik måte at eleven ved å svare på dem vil kunne gjenta hovedbestemmelsene i skolekjemikurset mer rasjonelt.
På slutten av manualen er det gitt svar på tester som vil hjelpe skoleelever og søkere til å teste seg selv og fylle ut eksisterende hull.
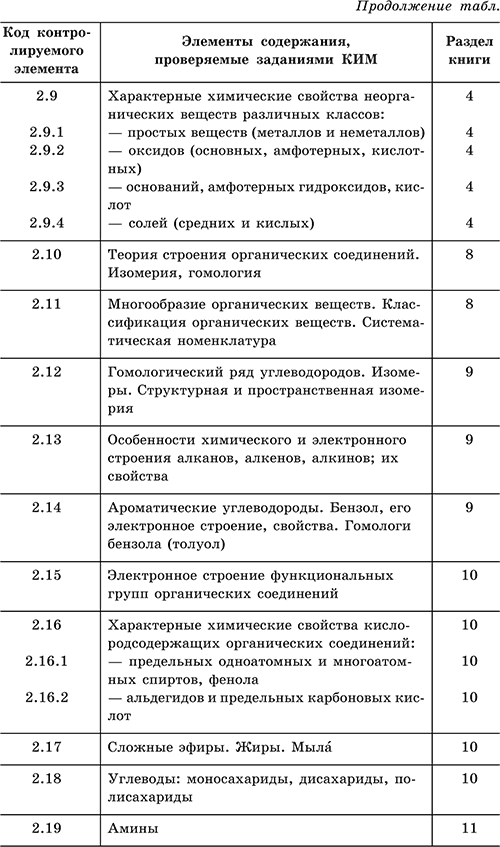
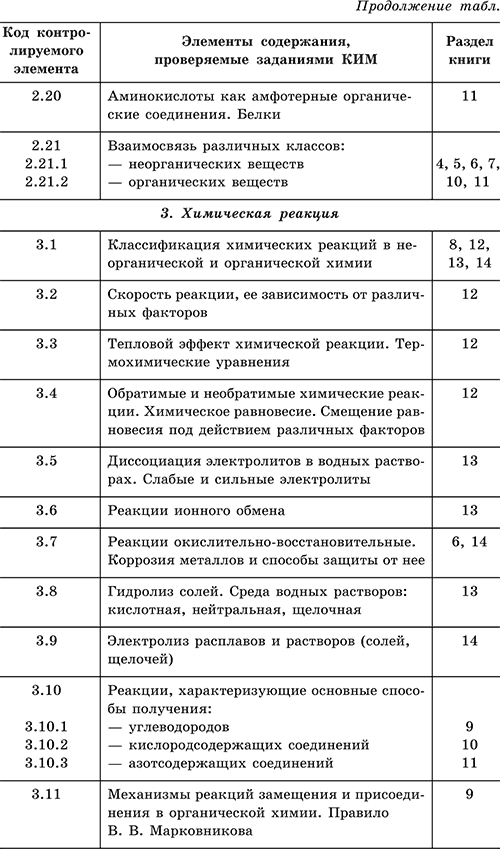
For å gjøre det lettere å jobbe med denne oppslagsboken, er det gitt en tabell som viser samsvaret mellom emnene for eksamen og delene av boken.
Manualen er rettet til elever på videregående skole, søkere og lærere.




1. Felleselementer. struktur av atomer. Elektroniske skjell. Orbitaler
Et kjemisk grunnstoff er en spesifikk type atom, betegnet med et navn og symbol og karakterisert ved et atomnummer og relativ atommasse.
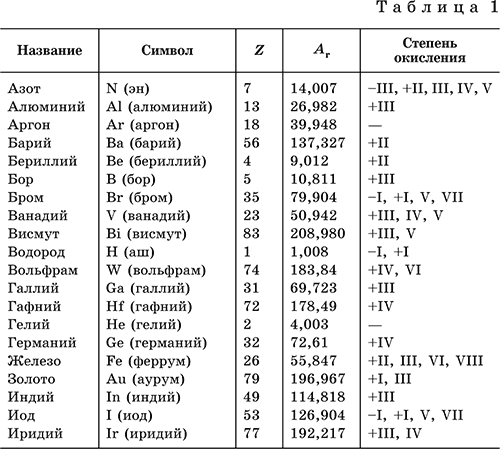
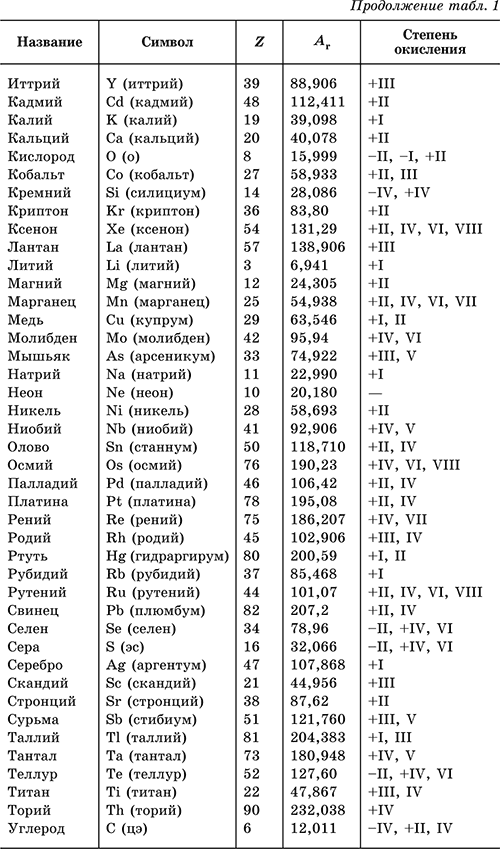
I tabellen 1 lister vanlige kjemiske elementer, symbolene som de er betegnet med (uttale i parentes), serienummer, relative atommasser, karakteristiske oksidasjonstilstander er gitt.
Null oksidasjonstilstanden til et grunnstoff i sin enkel sak(stoffer) er ikke angitt i tabellen.
Alle atomer av samme grunnstoff har like mange protoner i kjernen og like mange elektroner i skallet. Således, i et atom av grunnstoffet hydrogen H er det 1 p + i kjernen og i periferien 1 e -; i et atom av grunnstoffet oksygen O er det 8 p + i kjernen og 8 e - i skallet; et atom av grunnstoffet aluminium Al inneholder 13 p + i kjernen og 13 e - i skallet.
Atomer av samme grunnstoff kan variere i antall nøytroner i kjernen; slike atomer kalles isotoper. Dermed har grunnstoffet hydrogen H tre isotoper: hydrogen-1 (spesialnavn og symbol protium 1 H) med 1 p + i kjernen og 1 e - i skallet; hydrogen-2 (deuterium 2 H eller D) med 1 p + og 1 p 0 i kjernen og 1 e - i skallet; hydrogen-3 (tritium 3 H, eller T) med 1 p + og 2 p 0 i kjernen og 1 e - i skallet. I symbolene 1 H, 2 H og 3 H angir overskriften massetallet - summen av antall protoner og nøytroner i kjernen. Andre eksempler:

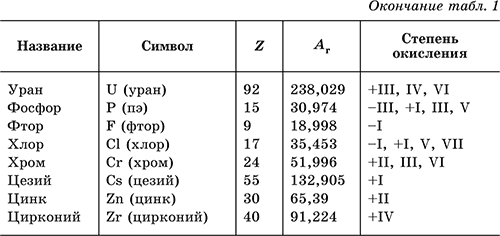
Den elektroniske formelen til et atom av et hvilket som helst kjemisk element i samsvar med plasseringen i D.I. Mendeleevs periodiske system for grunnstoffer kan bestemmes fra tabellen. 2.

Elektronskallet til ethvert atom er delt inn i energinivåer (1., 2., 3., etc.), nivåene er delt inn i undernivåer (betegnet med bokstavene s, p, d, f). Undernivåer består av atomorbitaler– områder i rommet der elektroner sannsynligvis vil oppholde seg. Orbitaler er utpekt som 1s (orbital av 1. nivå av s-undernivået), 2 s, 2 p, 3 s, 3 p, 3d, 4 s... Antall orbitaler i undernivåer:
Fyllingen av atomorbitaler med elektroner skjer i samsvar med tre forhold:
1) prinsippet om minimumsenergi
Elektroner fyller orbitalene, og starter med undernivået med lavere energi.Sekvensen med økende energi av undernivåer:
1 s< 2 c < 2 p < 3 s < 3 p < 4 s ? 3 d < 4 p < 5 s ? 4 d < 5 p < 6 s …2) eksklusjonsregel (Pauli-prinsippet)
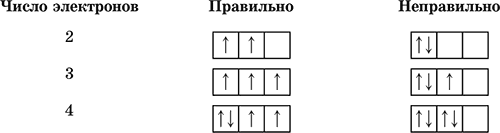
Hver orbital kan ikke romme mer enn to elektroner.Ett elektron i en orbital kalles uparet, to elektroner kalles et elektronpar:

3) prinsippet om maksimal multiplisitet (Hunds regel)
Innenfor et undernivå fyller elektroner først alle orbitaler halvveis, og deretter helt.Hvert elektron har sin egen karakteristikk - spinn (konvensjonelt representert med en pil opp eller ned). Elektronspinnene summerer seg som vektorer; summen av spinnene til et gitt antall elektroner på et undernivå må være maksimum(mangfoldighet):
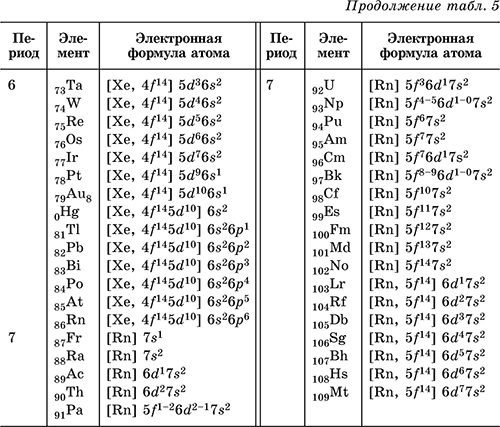
Fyllingen av nivåer, undernivåer og orbitaler av atomer av elementer fra H (Z = 1) til Kr (Z = 36) med elektroner er vist i energidiagrammet (tallene tilsvarer fyllingssekvensen og sammenfaller med ordenstallene til elementene):

Fra de fullførte energidiagrammene er de elektroniske formlene til grunnstoffenes atomer utledet. Antall elektroner i orbitalene til et gitt undernivå er angitt i overskriften til høyre for bokstaven (for eksempel er 3 d 5 5 elektroner i 3 d-undernivået); først kommer elektronene på 1. nivå, deretter 2., 3. osv. Formlene kan være fullstendige og korte, sistnevnte inneholder i parentes symbolet på den tilsvarende edelgassen, som formidler formelen, og dessuten starter med Zn , fylt indre d-undernivå. Eksempler:
3 Li = 1s 2 2s 1 = [ 2 He]2s 1
8 O = 1s 2 2s 2 2p 4= [2 Han] 2s 2 2p 4
13 Al = 1s 2 2s 2 2p 6 3s 2 3p 1= [10 Ne] 3s 2 3p 1
17 Cl = 1s 2 2s 2 2p 6 3s 2 3p 5 =
Tittel: Kjemi. En komplett veiledning for forberedelse til Unified State-eksamenen.
Oppslagsboken inneholder alt det teoretiske materialet fra skolekjemikurset som kreves for å bestå Unified State Exam, den endelige sertifiseringen av studenter. Dette materialet er fordelt i 14 seksjoner, hvis innhold tilsvarer emnene testet på Unified State Exam - fire innholdsblokker: "Kjemisk element", "Substans", "Kemisk reaksjon", "Kunnskap og anvendelse av stoffer og kjemiske reaksjoner ". For hver del gis det opplæringsoppgaver fra del A og B – med svarvalg og kort besvarelse. Seksjon 15 er i sin helhet viet til å løse regneoppgavene som inngår i eksamensdel C.
Testoppgavene er utformet på en slik måte at eleven ved å svare på dem vil kunne gjenta hovedbestemmelsene i skolekjemikurset mer rasjonelt.
På slutten av manualen er det gitt svar på tester som vil hjelpe skoleelever og søkere til å teste seg selv og fylle ut eksisterende hull.
For å gjøre det lettere å jobbe med denne oppslagsboken, er det gitt en tabell som viser samsvaret mellom emnene for eksamen og delene av boken.
Manualen er rettet til elever på videregående skole, søkere og lærere.
Et kjemisk grunnstoff er en spesifikk type atom, betegnet med et navn og symbol og karakterisert ved et atomnummer og relativ atommasse.
I tabellen Tabell 1 viser vanlige kjemiske elementer, gir symbolene de er betegnet med (uttale i parentes), serienummer, relative atommasser og karakteristiske oksidasjonstilstander.
Nulloksidasjonstilstanden til et grunnstoff i dets enkle stoff(er) er ikke angitt i tabellen.
Elektronskallet til ethvert atom er delt inn i energinivåer (1., 2., 3., etc.), nivåene er delt inn i undernivåer (betegnet med bokstavene s, p, d, f). Undernivåer består av atomorbitaler - områder i rommet der elektroner sannsynligvis vil oppholde seg. Orbitaler er utpekt som 1s (orbital av 1. nivå av s undernivå), 2s, 2p, 3s, 3p, 3d, 4s...
Innhold
Forord
1. Felleselementer. struktur av atomer. Elektroniske skjell. Orbitaler
2. Periodisk lov. Periodisk system. Elektronegativitet. Oksidasjonstilstander
3. Molekyler. Kjemisk forbindelse. Struktur av stoffer
4. Klassifisering og forhold av uorganiske stoffer
5. Metaller fra hovedundergruppene i gruppene I–III
5.1. Natrium
5.2. Kalium
5.3. Kalsium
5.4. Vannets hardhet
5.5. Aluminium
6. Overgangsmetaller i 4. periode. Egenskaper, produksjonsmetoder. Generelle egenskaper til metaller
6.1. Krom
6.2. Mangan
6.3. Jern
6.4. Generelle egenskaper til metaller. Korrosjon
7. Ikke-metaller i hovedundergruppene i gruppene IV–VII
7.1. Hydrogen
7.2. Halogener
7.2.1. Klor. Hydrogenklorid
7.2.2. Klorider
7.2.3. Hypokloritter. Klorater
7.2.4. Bromider. Jodider
7.3. Kalkogener
7.3.1. Oksygen
7.3.2. Svovel. Hydrogensulfid. Sulfider
7.3.3. Svoveldioksid. Sulfitter
7.3.4. Svovelsyre. Sulfater
7.4. Ikke-metaller VA-gruppe
7.4.1. Nitrogen. Ammoniakk
7.4.2. Nitrogenoksider. Salpetersyre
7.4.3. Nitritter. Nitrater
7.4.4. Fosfor
7.5. Ikke-metaller fra gruppe IVA
7.5.1. Gratis karbon
7.5.2. Karbonoksider
7.5.3. Karbonater
7.5.4. Silisium
8. Teori om struktur, mangfold, klassifisering og nomenklatur av organiske forbindelser. Typer kjemiske reaksjoner
9. Hydrokarboner. Homologi og isomeri. Kjemiske egenskaper og metoder for å skaffe
9.1. Alkaner. Sykloalkaner
9.2. Alkenes. Alcadienes
9.3. Alkyner
9.4. Arenaer
10. Oksygenholdige organiske forbindelser
10.1. Alkoholer. Etere. Fenoler
10.2. Aldehyder og ketoner
10.3. Karboksylsyrer. Estere. Fett
10.4. Karbohydrater
11. Nitrogenholdige organiske forbindelser
11.1. Nitroforbindelser. Aminer
11.2. Aminosyrer. Ekorn
12. Kjemiske reaksjoner. Hastighet, energi og reversibilitet
12.1. Reaksjonshastighet
12.2. Energi av reaksjoner
12.3. Reversibilitet av reaksjoner
13. Vandige løsninger. Løselighet og dissosiasjon av stoffer. Ionbytte. Hydrolyse av salter
13.1. Løselighet av stoffer i vann
13.2. Elektrolytisk dissosiasjon
13.3. Dissosiasjon av vann. Løsningsmedium
13.4. Ionebytterreaksjoner
13.5. Hydrolyse av salter
14. Redoksreaksjoner. Elektrolyse
14.1. Oksydasjonsmidler og reduksjonsmidler
14.2. Valg av odds ved hjelp av elektronisk balansemetode
14.3. Metallspenningsområde
14.4. Elektrolyse av smelte og løsning
15. Løse regneoppgaver
15.1. Massefraksjon av oppløst stoff. Fortynning, konsentrasjon og blanding av løsninger
15.2. Gassvolumforhold
15.3. Masse av et stoff (volum gass) basert på en kjent mengde av en annen reaktant (produkt)
15.4. Termisk effekt av reaksjon
15.5. Masse (volum, mengde stoff) av produktet ved reagens i overskudd eller med urenheter
15.6. Masse (volum, mengde stoff) av et produkt basert på et reagens med en kjent massefraksjon i løsning
15.7. Finne molekylformelen til en organisk forbindelse
Svar
Last ned e-boken gratis i et praktisk format og les: