Kommunikasjon mellom atomer. Typer interatomiske bindinger
Foreløpig alle typer kjemisk binding De er delt inn i kovalent, ionisk, donor-akseptor, van der Waals, hydrogen, metall.
Kovalent binding dannes når to atomer kan "dele" elektroner:
A. + B. → A:B
Ioniskforbindelse dannes når "utvekslingen" blir så ulik at et elektron blir revet fra atomet sitt EN og går helt til atomet B, noe som resulterer i dannelsen av et par ioner:
A. + B. → A + :B -
Det tror vi ionisk binding Det er et ekstremt tilfelle av denne typen kjemisk binding som kovalent.
Polar kovalent binding
Hvis det ikke er noe som heter en "absolutt ionisk" binding, er det kanskje en helt kovalent? Svaret er ja. Dette er tilfellet når to kjerner tiltrekker seg et elektron med lik kraft. Denne posisjonen er garantert for homonukleære diatomiske molekyler - molekyler som består av to identiske atomer. Altså i Cl2, O2, H2 elektroner deles likt mellom to identiske atomer. I slike molekyler faller midten av den positive ladningen nøyaktig sammen med sentrum av den negative ladningen - midt mellom de to kjernene. Bindingselektroner finnes i rommet mellom atomene som bindes.
Et trekk ved en kovalent binding er også dens polariserbarhet. Hvis et molekyl består av to atomer som er forbundet med en polar binding, så er et slikt molekyl polart molekyl, dvs. representerer .
Donor-akseptorbinding
En annen type kjemisk binding er donor-akseptor. Det er utveksling og giver-akseptor mekanisme for bindingsdannelse. En kovalent binding dannet av en donor-akseptor-mekanisme (dvs. på grunn av et par elektroner i ett av atomene) kalles donor-akseptor. Så eksemplet ovenfor med LiF er et eksempel på en donor-akseptor-binding.
A: + B → A: B
Intermolekylær interaksjon - interaksjon mellom molekyler som ikke fører til brudd eller dannelse av nye kjemiske bindinger. De er basert, som grunnlaget for en kjemisk binding, på elektriske interaksjoner.
Van der Waals styrker
Van der Waals-krefter inkluderer alle typer intermolekylær tiltrekning og frastøting(interaksjon av molekyler med hverandre). De ble navngitt til ære for Ya.D. Van der Waals, som var den første som tok hensyn til intermolekylære interaksjoner for å forklare egenskapene til ekte gasser og væsker.
Grunnlaget for van der Waals-krefter er også Coulomb-interaksjonskreftene mellom elektronene og kjernene til ett molekyl og kjernene og elektronene til et annet. Ved en viss avstand mellom molekylene balanserer tiltreknings- og frastøtningskreftene hverandre, og det dannes et stabilt system.
![]()
Fig. 1 Van der Waals styrker
Van der Waals krefter er merkbart dårligere enn enhver type kjemisk binding. For eksempel er kreftene som holder kloratomer i et klormolekyl nesten ti ganger større enn kreftene som binder Cl 2-molekyler sammen. Men uten denne svake intermolekylære tiltrekningen kan flytende og fast klor ikke oppnås.
Hydrogenbindinger
Hydrogenholdige grupper av atomer (der et hydrogenatom er koblet til et atom av fluor, oksygen eller nitrogen, sjeldnere: klor, svovel eller andre ikke-metaller) danner ofte en stabil kjemisk binding med elektronegative atomer som er en del av et annet eller det samme molekylet. Denne typen kjemisk binding kalles hydrogenbinding. Dette er et spesielt tilfelle av van der Waals-styrker.
Kovalent H-O-bindinger, H-F, H-N er svært polare, på grunn av hvilke en overflødig positiv ladning akkumuleres på hydrogenatomet, og en overflødig negativ ladning på de motsatte polene. Mellom motsatt ladede poler oppstår krefter av elektrostatisk tiltrekning - hydrogenbindinger. Hydrogentypen av kjemisk binding kan enten være intermolekylær eller intramolekylær. Energien til en hydrogenbinding er omtrent ti ganger mindre enn energien til en konvensjonell kovalent binding, men likevel spiller hydrogenbindinger en viktig rolle i mange fysisk-kjemiske og biologiske prosesser. Spesielt er DNA-molekyler doble helixer der to kjeder av nukleotider er koblet sammen med hydrogenbindinger.
Et av tegnene på denne typen kjemisk binding kan være avstanden mellom hydrogenatomet og det andre atomet som danner det. Det må være mindre enn summen av radiene til disse atomene. Oftere er det asymmetriske hydrogenbindinger, hvor avstanden H...B er større enn A-B. Men i sjeldne tilfeller (hydrogenfluorid, noen karboksylsyrer) hydrogenbinding er symmetrisk. De sterkeste hydrogenbindingene dannes med deltakelse av fluoratomer. I et symmetrisk ion er energien til en hydrogenbinding 155 kJ/mol og kan sammenlignes med energien til en annen type binding - en kovalent binding. Energien til hydrogenbindinger mellom vannmolekyler er allerede merkbart lavere (25 kJ/mol).

Ris. 2. Hydrogenbinding mellom vannmolekyler
Som kjent kan atomer kombineres med hverandre for å danne både enkle og komplekse stoffer. I dette tilfellet dannes ulike typer kjemiske bindinger: ioniske, kovalente (ikke-polare og polare), metalliske og hydrogen. En av de mest essensielle egenskapene til atomer av elementer, som bestemmer hva slags binding som dannes mellom dem - ionisk eller kovalent, er elektronegativitet, dvs. evnen til atomer i en forbindelse til å tiltrekke seg elektroner.
En betinget kvantitativ vurdering av elektronegativitet er gitt av den relative elektronegativitetsskalaen.
I perioder er det en generell tendens til at elektronegativiteten til elementer øker, og i grupper - for deres reduksjon. Elementer er ordnet i en serie i henhold til deres elektronegativitet, på grunnlag av hvilken elektronegativiteten til elementer lokalisert i forskjellige perioder kan sammenlignes.
Typen kjemisk binding avhenger av hvor stor forskjellen i elektronegativitetsverdiene til de forbindende atomene til elementene er. Jo mer atomene til elementene som danner bindingen er forskjellige i elektronegativitet, jo mer polar er den kjemiske bindingen. Det er umulig å trekke en skarp grense mellom typene kjemiske bindinger. I de fleste forbindelser er typen kjemisk binding mellomliggende; for eksempel er en svært polar kovalent kjemisk binding nær en ionisk binding. Avhengig av hvilket av de begrensende tilfellene en kjemisk binding er nærmere i naturen, er den klassifisert som enten en ionisk eller en kovalent polar binding.
Ionebinding
En ionisk binding dannes ved samspillet mellom atomer som skiller seg kraftig fra hverandre i elektronegativitet. For eksempel danner de typiske metallene litium (Li), natrium (Na), kalium (K), kalsium (Ca), strontium (Sr), barium (Ba) ioniske bindinger med typiske ikke-metaller, hovedsakelig halogener.
I tillegg til alkalimetallhalogenider dannes det også ioniske bindinger i forbindelser som alkalier og salter. For eksempel, i natriumhydroksid (NaOH) og natriumsulfat (Na 2 SO 4 ) eksisterer ioniske bindinger bare mellom natrium- og oksygenatomer (de resterende bindingene er polare kovalente).
Kovalent upolar binding
Når atomer med samme elektronegativitet samhandler, dannes molekyler med kovalent binding. ikke-polar binding. En slik binding eksisterer i følgende molekyler enkle stoffer: H2, F2, Cl2, O2, N2. Kjemiske bindinger i disse gassene dannes gjennom delte elektronpar, dvs. når de tilsvarende elektronskyene overlapper hverandre, på grunn av elektron-kjernevekselvirkningen, som oppstår når atomer nærmer seg hverandre.
Når du komponerer elektroniske formler for stoffer, bør det huskes at hvert vanlig elektronpar er et konvensjonelt bilde av økt elektrontetthet som følge av overlappingen av de tilsvarende elektronskyene.
Kovalent polar binding
Når atomer samhandler, hvis elektronegativitetsverdier er forskjellige, men ikke skarpt, skifter det vanlige elektronparet til et mer elektronegativt atom. Dette er den vanligste typen kjemisk binding, som finnes i både uorganiske og organiske forbindelser.
Kovalente bindinger inkluderer også fullt ut de bindingene som er dannet av en donor-akseptormekanisme, for eksempel i hydronium- og ammoniumioner.
Metallkobling
Bindingen som dannes som et resultat av interaksjonen av relativt frie elektroner med metallioner kalles en metallisk binding. Denne typen binding er typisk for enkle stoffer - metaller.
Essensen av utdanningsprosessen metallforbindelse er som følger: metallatomer gir lett fra seg valenselektroner og blir til positivt ladede ioner. Relativt frie elektroner løsrevet fra atomet beveger seg mellom positive metallioner. En metallisk binding oppstår mellom dem, det vil si at elektroner, som det var, sementerer de positive ionene i krystallgitteret til metaller.
Hydrogenbinding
Bindingen som dannes mellom hydrogenatomene til ett molekyl og atomet til et sterkt elektronegativt element (O, N, F) i et annet molekyl kalles en hydrogenbinding.
Spørsmålet kan oppstå: hvorfor danner hydrogen en så spesifikk kjemisk binding?
Dette forklares med det faktum at atomradius hydrogen er veldig lite. I tillegg, når man fortrenger eller fullstendig donerer sitt eneste elektron, får hydrogen en relativt høy positiv ladning, på grunn av hvilken hydrogenet til ett molekyl interagerer med atomer av elektronegative elementer som har en delvis negativ ladning som går inn i sammensetningen av andre molekyler (HF). , H20, NH3).
La oss se på noen eksempler. Vanligvis skildrer vi sammensetningen av vann kjemisk formel H 2 O. Dette er imidlertid ikke helt nøyaktig. Det vil være mer korrekt å betegne vannsammensetningen med formelen (H 2 O)n, hvor n = 2,3,4 osv. Dette forklares med at individuelle vannmolekyler er forbundet med hverandre gjennom hydrogenbindinger .
Hydrogenbindinger er vanligvis betegnet med prikker. Det er mye svakere enn ionisk eller kovalent binding, men sterkere enn vanlig intermolekylær interaksjon.
Tilstedeværelsen av hydrogenbindinger forklarer økningen i vannvolum med synkende temperatur. Dette skyldes det faktum at når temperaturen synker, blir molekylene sterkere og derfor reduseres tettheten av deres "pakking".
Når du studerte organisk kjemi, oppsto følgende spørsmål: hvorfor er kokepunktene til alkoholer mye høyere enn de tilsvarende hydrokarboner? Dette forklares med at det også dannes hydrogenbindinger mellom alkoholmolekyler.
En økning i kokepunktet til alkoholer oppstår også på grunn av utvidelsen av molekylene deres.
Hydrogenbinding er også karakteristisk for mange andre organiske forbindelser (fenoler, karboksylsyrer, etc.). Fra kurs i organisk kjemi og generell biologi vet du at tilstedeværelsen av en hydrogenbinding forklarer den sekundære strukturen til proteiner, strukturen til dobbelthelixen til DNA, dvs. fenomenet komplementaritet.
Det er ingen enhetlig teori om kjemiske bindinger er konvensjonelt delt inn i kovalent (en universell type binding), ionisk (et spesielt tilfelle av en kovalent binding), metallisk og hydrogen.
Kovalent binding
Dannelsen av en kovalent binding er mulig ved tre mekanismer: utveksling, donor-akseptor og dativ (Lewis).
Ifølge metabolsk mekanisme Dannelsen av en kovalent binding skjer på grunn av deling av vanlige elektronpar. I dette tilfellet har hvert atom en tendens til å tilegne seg et skall av en inert gass, dvs. oppnå et fullført eksternt energinivå. Dannelsen av en kjemisk binding etter utvekslingstype er avbildet ved hjelp av Lewis-formler, der hvert valenselektron i et atom er representert med prikker (fig. 1).
Ris. 1 Dannelse av en kovalent binding i HCl-molekylet ved utvekslingsmekanismen
Med utviklingen av teorien om atomstruktur og kvantemekanikk dannelsen av en kovalent binding er representert som overlappingen av elektroniske orbitaler (fig. 2).

Ris. 2. Dannelse av en kovalent binding på grunn av overlapping av elektronskyer
Jo mer overlapping atomorbitaler, de sterkere forbindelse, bindingslengden er kortere og energien er høyere. En kovalent binding kan dannes ved å overlappe forskjellige orbitaler. Som et resultat av s-ene overlapping, s-p orbitaler, samt d-d, p-p, d-p orbitaler med laterale lober, oppstår dannelsen av bindinger. En binding dannes vinkelrett på linjen som forbinder kjernene til 2 atomer. En - og en - binding er i stand til å danne en multippel (dobbelt) kovalent binding, karakteristisk for organisk materiale klasse alkener, alkadiener osv. En og to bindinger danner en multippel (trippel) kovalent binding, karakteristisk for organiske stoffer av klassen alkyner (acetylener).
Dannelse av en kovalent binding ved giver-akseptor mekanisme La oss se på eksemplet med ammoniumkation:
NH3 + H+ = NH4+
7 N 1s 2 2s 2 2p 3
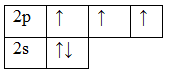
Nitrogenatomet har et fritt enkelt elektronpar (elektroner som ikke er involvert i dannelsen av kjemiske bindinger i molekylet), og hydrogenkationen har en fri orbital, så de er henholdsvis en elektrondonor og -akseptor.
La oss vurdere dativmekanismen for kovalent bindingsdannelse ved å bruke eksemplet med et klormolekyl.
17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5
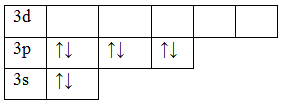
Kloratomet har både et fritt ensomt elektronpar og ledige orbitaler, derfor kan det vise egenskapene til både en donor og en akseptor. Derfor, når et klormolekyl dannes, fungerer det ene kloratomet som en donor og det andre som en akseptor.
Hoved egenskaper ved en kovalent binding er: metning (mettede bindinger dannes når et atom fester så mange elektroner til seg selv som dets valensevne tillater; umettede bindinger dannes når antallet festede elektroner er mindre enn atomets valensevne); retningsbestemt (denne verdien er relatert til molekylets geometri og konseptet "bindingsvinkel" - vinkelen mellom bindinger).
Ionebinding
Det er ingen forbindelser med en ren ionisk binding, selv om dette forstås som en kjemisk bundet tilstand av atomer der et stabilt elektronisk miljø av atomet skapes når den totale elektrontettheten er fullstendig overført til atomet til et mer elektronegativt element. Ionebinding er bare mulig mellom atomer av elektronegative og elektropositive elementer som er i tilstanden til motsatt ladede ioner - kationer og anioner.
DEFINISJON
Ion er elektrisk ladede partikler dannet ved fjerning eller tilsetning av et elektron til et atom.
Ved overføring av et elektron har metall- og ikke-metallatomer en tendens til å danne en stabil elektronskallkonfigurasjon rundt kjernen. Et ikke-metallatom lager et skall av den påfølgende inerte gassen rundt kjernen, og et metallatom lager et skall av den forrige inerte gassen (fig. 3).
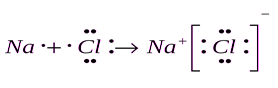
Ris. 3. Dannelse av en ionisk binding ved å bruke eksempelet på et natriumkloridmolekyl
Molekyler der ioniske bindinger eksisterer i sin rene form, finnes i stoffets damptilstand. Ionebindingen er veldig sterk, og derfor har stoffer med denne bindingen et høyt smeltepunkt. I motsetning til kovalente bindinger, er ikke ioniske bindinger preget av retning og metning, siden det elektriske feltet skapt av ioner virker likt på alle ioner på grunn av sfærisk symmetri.
Metallkobling
Den metalliske bindingen realiseres bare i metaller - dette er interaksjonen som holder metallatomer i et enkelt gitter. Bare valenselektronene til metallatomene som tilhører hele volumet deltar i dannelsen av en binding. I metaller fjernes elektroner konstant fra atomer og beveger seg gjennom hele metallets masse. Metallatomer, fratatt elektroner, blir til positivt ladede ioner, som har en tendens til å akseptere bevegelige elektroner. Denne kontinuerlige prosessen danner den såkalte "elektrongassen" inne i metallet, som binder alle metallatomene fast sammen (fig. 4).
Den metalliske bindingen er sterk, derfor er metaller preget av et høyt smeltepunkt, og tilstedeværelsen av "elektrongass" gir metaller formbarhet og duktilitet.
Hydrogenbinding
En hydrogenbinding er en spesifikk intermolekylær interaksjon, fordi dens forekomst og styrke avhenger av kjemisk natur stoffer. Det dannes mellom molekyler der et hydrogenatom er bundet til et atom med høy elektronegativitet (O, N, S). Forekomsten av en hydrogenbinding avhenger av to årsaker: For det første har et hydrogenatom bundet til et elektronegativt atom ikke elektroner og kan lett inkorporeres i elektroniske skyer andre atomer, og for det andre, med en valens s-orbital, er hydrogenatomet i stand til å akseptere et ensomt elektronpar fra et elektronegativt atom og danne en binding med det via donor-akseptor-mekanismen.
3.3.1 Kovalent binding er en to-senter, to-elektronbinding dannet på grunn av overlapping av elektronskyer som bærer uparrede elektroner med antiparallelle spinn. Som regel dannes det mellom atomer av ett kjemisk element.
Det er kvantitativt preget av valens. Valens av elementet - dette er dens evne til å danne et visst antall kjemiske bindinger på grunn av frie elektroner lokalisert i atomvalensbåndet.
En kovalent binding dannes bare av et par elektroner plassert mellom atomer. Det kalles et delt par. De gjenværende elektronparene kalles ensomme par. De fyller skjellene og er ikke med på å binde. Forbindelsen mellom atomer kan utføres ikke bare av ett, men også av to og til og med tre delte par. Slike forbindelser kalles dobbelt osv sverm - flere tilkoblinger.
3.3.1.1 Kovalent upolar binding. En binding oppnådd gjennom dannelsen av elektronpar som tilhører likt begge atomene kalles kovalent ikke-polar. Det forekommer mellom atomer med praktisk talt lik elektronegativitet (0,4 > ΔEO > 0) og derfor en jevn fordeling av elektrontetthet mellom atomkjernene i homonukleære molekyler. For eksempel H 2, O 2, N 2, Cl 2 osv. Dipolmomentet til slike bindinger er null. CH-bindingen i mettede hydrokarboner (for eksempel i CH 4) regnes som praktisk talt upolar, fordi ΔEO = 2,5 (C) - 2,1 (H) = 0,4.
3.3.1.2 Kovalent polar binding. Hvis et molekyl dannes av to forskjellige atomer, så forskyves overlappingssonen til elektronskyer (orbitaler) mot ett av atomene, og en slik binding kalles polar . Med en slik binding er sannsynligheten for å finne elektroner nær kjernen til et av atomene høyere. For eksempel HCl, H 2 S, PH 3.
Polar (usymmetrisk) kovalent binding - binding mellom atomer med ulik elektronegativitet (2 > ΔEO > 0,4) og asymmetrisk fordeling av det vanlige elektronparet. Vanligvis dannes det mellom to ikke-metaller.
Elektrontettheten til en slik binding forskyves mot et mer elektronegativt atom, noe som fører til at det vises en delvis negativ ladning (delta minus) på den, og en delvis positiv ladning (delta pluss) på den mindre elektronegativt atom.
C .
Retningen for elektronforskyvning er også indikert med en pil:
CCl, CO, CN, OH, CMg.
Jo større forskjellen er i elektronegativitet til de bundne atomene, desto høyere er polariteten til bindingen og desto større er dipolmomentet. Ytterligere tiltrekningskrefter virker mellom partielle ladninger med motsatt fortegn. Derfor enn mer polar tilkobling, jo sterkere er den.
Unntatt polariserbarhet kovalent binding har eiendommen metning – et atoms evne til å danne like mange kovalente bindinger som det har energisk tilgjengelige atomorbitaler. Den tredje egenskapen til en kovalent binding er dens retning.
3.3.2 Ionebinding. Drivkraften bak dannelsen er det samme ønsket til atomer for oktettskallet. Men i noen tilfeller kan et slikt "oktett"-skall bare oppstå når elektroner overføres fra ett atom til et annet. Derfor dannes det som regel en ionisk binding mellom et metall og et ikke-metall.
Tenk som et eksempel på reaksjonen mellom natrium (3s 1) og fluor (2s 2 3s 5) atomer. Elektronegativitetsforskjell i NaF-forbindelse
EO = 4,0 - 0,93 = 3,07
Natrium, etter å ha gitt sitt 3s 1 elektron til fluor, blir et Na + ion og forblir med et fylt 2s 2 2p 6 skall, som tilsvarer den elektroniske konfigurasjonen til neonatomet. Akkurat det samme elektronisk konfigurasjon får fluor ved å akseptere ett elektron donert av natrium. Som et resultat oppstår elektrostatiske tiltrekningskrefter mellom motsatt ladede ioner.
Ionebinding - et ekstremt tilfelle av polar kovalent binding, basert på elektrostatisk tiltrekning av ioner. En slik binding oppstår når det er stor forskjell i elektronegativiteten til de bundne atomene (EO > 2), når et mindre elektronegativt atom nesten fullstendig gir fra seg valenselektronene og blir til et kation, og et annet, mer elektronegativt atom, fester seg disse elektronene og blir et anion. Samspillet mellom ioner av motsatt fortegn er ikke avhengig av retningen, og Coulomb-krefter har ikke egenskapen til metning. På grunn av dette ionisk binding har ingen romlig fokus Og metning , siden hvert ion er assosiert med et visst antall motioner (ionekoordinasjonsnummer). Derfor har ikke ionbundne forbindelser molekylstruktur og er faste stoffer som danner ioniske krystallgitter, med høye smelte- og kokepunkter, de er svært polare, ofte saltaktige og elektrisk ledende i vandige løsninger. For eksempel MgS, NaCl, A 2 O 3. Det er praktisk talt ingen forbindelser med rent ioniske bindinger, siden en viss mengde kovalens alltid forblir på grunn av det faktum at en fullstendig overføring av ett elektron til et annet atom ikke observeres; i de mest "ioniske" stoffene overstiger ikke andelen bindingsionisitet 90%. For eksempel, i NaF er bindingspolarisasjonen omtrent 80%.
I organiske forbindelser er ioniske bindinger ganske sjeldne, fordi Et karbonatom har en tendens verken til å miste eller få elektroner for å danne ioner.
Valence elementer i forbindelser med ioniske bindinger er svært ofte karakterisert oksidasjonstilstand , som igjen tilsvarer ladningsverdien til grunnstoffionet i en gitt forbindelse.
Oksidasjonstilstand - dette er en konvensjonell ladning som et atom får som et resultat av omfordeling av elektrontetthet. Kvantitativt er det preget av antall elektroner som er forskjøvet fra et mindre elektronegativt element til et mer elektronegativt. Et positivt ladet ion dannes fra grunnstoffet som ga fra seg elektronene sine, og et negativt ion dannes fra grunnstoffet som tok imot disse elektronene.
Elementet som ligger i høyeste oksidasjonstilstand (maksimalt positivt), har allerede gitt opp alle valenselektronene som ligger i AVZ. Og siden antallet deres er bestemt av nummeret til gruppen der elementet er plassert, da høyeste oksidasjonstilstand for de fleste elementer og vil være like gruppenummer . Angående laveste oksidasjonstilstand (maksimalt negativ), så vises det under dannelsen av et åtte-elektronskall, det vil si i tilfellet når AVZ er helt fylt. Til ikke-metaller det beregnes med formelen Gruppenummer – 8 . Til metaller lik null , siden de ikke kan akseptere elektroner.
For eksempel har AVZ av svovel formen: 3s 2 3p 4. Hvis et atom gir fra seg alle elektronene (seks), vil det få den høyeste oksidasjonstilstanden +6 , lik gruppenummeret VI , hvis det tar de to nødvendige for å fullføre det stabile skallet, vil det oppnå den laveste oksidasjonstilstanden –2 , lik Gruppenummer – 8 = 6 – 8= –2.
3.3.3 Metallbinding. De fleste metaller har en rekke egenskaper som er generelle i naturen og skiller seg fra egenskapene til andre stoffer. Slike egenskaper er relativt høye smeltetemperaturer, evnen til å reflektere lys og høy termisk og elektrisk ledningsevne. Disse funksjonene forklares av eksistensen av en spesiell type interaksjon i metaller – metallforbindelse.
I samsvar med deres posisjon i det periodiske systemet har metallatomer et lite antall valenselektroner, som er ganske svakt bundet til kjernene og lett kan løsnes fra dem. Som et resultat vises positivt ladede ioner i metallets krystallgitter, lokalisert i visse posisjoner av krystallgitteret, og et stort antall delokaliserte (frie) elektroner, beveger seg relativt fritt i feltet med positive sentre og kommuniserer mellom alt metall. atomer på grunn av elektrostatisk tiltrekning.
Dette er en viktig forskjell mellom metalliske bindinger og kovalente bindinger, som har en streng orientering i rommet. Bindingskrefter i metaller er ikke lokaliserte eller rettet, og frie elektroner som danner en "elektrongass" forårsaker høy termisk og elektrisk ledningsevne. Derfor er det i dette tilfellet umulig å snakke om retningen til bindingene, siden valenselektronene er fordelt nesten jevnt over hele krystallen. Det er dette som forklarer for eksempel plastisiteten til metaller, dvs. muligheten for forskyvning av ioner og atomer i alle retninger
3.3.4 Giver-akseptor-binding. I tillegg til mekanismen for kovalent bindingsdannelse, ifølge hvilken et delt elektronpar oppstår fra samspillet mellom to elektroner, er det også en spesiell giver-akseptor mekanisme . Det ligger i det faktum at en kovalent binding dannes som et resultat av overgangen til et allerede eksisterende (ensomt) elektronpar giver (elektronleverandør) for felles bruk av giveren og akseptor (leverandør av fri atomorbital).
Når den først er dannet, er den ikke forskjellig fra kovalent. Donorakseptormekanismen er godt illustrert av skjemaet for dannelse av et ammoniumion (figur 9) (stjerner indikerer elektronene til det ytre nivået av nitrogenatomet):
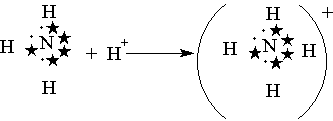
Figur 9 - Skjema for dannelse av ammoniumion
Den elektroniske formelen til ABZ til nitrogenatomet er 2s 2 2p 3, det vil si at den har tre uparrede elektroner som går inn i en kovalent binding med tre hydrogenatomer (1s 1), som hver har ett valenselektron. I dette tilfellet dannes et ammoniakkmolekyl NH 3, der det ensomme elektronparet nitrogen beholdes. Hvis et hydrogenproton (1s 0), som ikke har noen elektroner, nærmer seg dette molekylet, vil nitrogen overføre elektronparet sitt (donor) til denne hydrogenatomorbitalen (akseptoren), noe som resulterer i dannelsen av et ammoniumion. I den er hvert hydrogenatom koblet til et nitrogenatom med et felles elektronpar, hvorav det ene implementeres via en donor-akseptormekanisme. Det er viktig å merke seg at H-N-bindinger dannet av forskjellige mekanismer ikke har noen forskjeller i egenskaper. Dette fenomenet skyldes det faktum at i øyeblikket av bindingsdannelse endrer orbitalene til 2s og 2p elektronene til nitrogenatomet form. Som et resultat vises fire orbitaler med nøyaktig samme form.
Atomer med et stort antall elektroner, men har et lite antall uparrede elektroner. For elementer fra periode II, i tillegg til nitrogenatomet, er en slik mulighet tilgjengelig for oksygen (to ensomme par) og fluor (tre ensomme par). For eksempel er hydrogenionet H + i vandige løsninger aldri i fri tilstand, siden hydroniumionet H 3 O + alltid dannes fra vannmolekylene H 2 O og H + ionet. Hydroniumionet er tilstede i alle vandige løsninger , selv om det for enkelhets skyld er bevart symbolet H+.
3.3.5 Hydrogenbinding. Et hydrogenatom assosiert med et sterkt elektronegativt grunnstoff (nitrogen, oksygen, fluor, etc.), som "trekker" et vanlig elektronpar på seg selv, opplever mangel på elektroner og får en effektiv positiv ladning. Derfor er den i stand til å samhandle med det ensomme elektronparet til et annet elektronegativt atom (som får en effektiv negativ ladning) av det samme (intramolekylær binding) eller et annet molekyl (intermolekylær binding). Som et resultat er det hydrogenbinding , som er grafisk indikert med prikker:
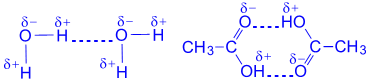
Denne bindingen er mye svakere enn andre kjemiske bindinger (energien til dannelsen er 10 – 40 kJ/mol) og har hovedsakelig en delvis elektrostatisk, delvis donor-akseptorkarakter.
Hydrogenbinding spiller en ekstremt viktig rolle i biologiske makromolekyler, slike uorganiske forbindelser som H 2 O, H 2 F 2, NH 3. For eksempel har OH-bindinger i H2O en merkbar polar karakter med et overskudd av negativ ladning – på oksygenatomet. Hydrogenatomet får tvert imot en liten positiv ladning + og kan samhandle med de ensomme elektronparene til oksygenatomet til nabovannmolekylet.
Interaksjonen mellom vannmolekyler viser seg å være ganske sterk, slik at selv i vanndamp er det dimerer og trimerer av sammensetningen (H 2 O) 2, (H 2 O) 3, etc. I løsninger, lange kjeder av assosiasjoner av denne typen kan vises:
fordi oksygenatomet har to ensomme elektronpar.
Tilstedeværelsen av hydrogenbindinger forklarer de høye koketemperaturene til vann, alkoholer og karboksylsyrer. På grunn av hydrogenbindinger er vann preget av så høye smelte- og koketemperaturer sammenlignet med H 2 E (E = S, Se, Te). Hvis det ikke fantes hydrogenbindinger, ville vann smelte ved –100 °C og koke ved –80 °C. Typiske tilfeller av assosiasjon er observert for alkoholer og organiske syrer.
Hydrogenbindinger kan oppstå både mellom ulike molekyler og innenfor et molekyl hvis dette molekylet inneholder grupper med donor- og akseptorevner. For eksempel er det intramolekylære hydrogenbindinger som spiller hovedrollen i dannelsen av peptidkjeder, som bestemmer strukturen til proteiner. H-bindinger påvirker de fysiske og kjemiske egenskapene til et stoff.
Atomer av andre grunnstoffer danner ikke hydrogenbindinger , siden kreftene til elektrostatisk tiltrekning av motsatte ender av polare bindingsdipoler (O-H, N-H, etc.) er ganske svake og virker bare på korte avstander. Hydrogen, som har den minste atomradiusen, gjør at slike dipoler kan komme så nærme at tiltrekningskreftene blir merkbare. Ingen andre grunnstoffer med stor atomradius er i stand til å danne slike bindinger.
3.3.6 Intermolekylære interaksjonskrefter (van der Waals-krefter). I 1873 antydet den nederlandske forskeren I. van der Waals at det er krefter som forårsaker tiltrekning mellom molekyler. Disse styrkene ble senere kalt van der Waals-styrker – den mest universelle typen intermolekylære bindinger. Energien til van der Waals-bindingen er mindre enn hydrogenbindingen og utgjør 2–20 kJ/∙mol.
Avhengig av metoden for forekomst, er krefter delt inn i:
1) orienterende (dipol-dipol eller ione-dipol) - oppstår mellom polare molekyler eller mellom ioner og polare molekyler. Når polare molekyler nærmer seg hverandre, orienterer de seg slik at den positive siden av den ene dipolen er orientert mot den negative siden av den andre dipolen (Figur 10).
|
Figur 10 - Orienteringsinteraksjon |
||||
2) induksjon (dipol - indusert dipol eller ion - indusert dipol) - oppstår mellom polare molekyler eller ioner og ikke-polare molekyler, men i stand til polarisering. Dipoler kan påvirke ikke-polare molekyler, og gjøre dem om til indikerte (induserte) dipoler. (Figur 11).
|
Figur 11 - Induktiv interaksjon |
||||
3) dispersiv (indusert dipol - indusert dipol) - oppstår mellom ikke-polare molekyler som er i stand til polarisering. I ethvert molekyl eller atom i en edelgass forekommer svingninger i elektrisk tetthet, noe som resulterer i utseendet av øyeblikkelige dipoler, som igjen induserer øyeblikkelige dipoler i nabomolekyler. Bevegelsen av øyeblikkelige dipoler blir konsistent, deres utseende og forfall skjer synkront. Som et resultat av samspillet mellom øyeblikkelige dipoler, avtar systemets energi (Figur 12).
|
Figur 12 - Dispersjonsinteraksjon |
|||||||
For å lette forståelsen av interatomisk interaksjon, vil vi vurdere typene kjemiske bindinger i en noe forenklet form, nemlig vi vil vurdere: a) homeopolar eller kovalent binding, b) heteropolar eller ionisk binding, c) metallisk binding og d) polarisasjonsbinding, eller Van bond -der-Waals.
Kombinasjonen av atomer til molekyler av et stoff, så vel som kombinasjonen av atomer eller ioner til fast skjer under påvirkning av kjemiske bindinger. Kombinasjonen av molekyler til et stoff i flytende eller gassform utføres under påvirkning av intermolekylære interaksjonskrefter, kalt van der Waals-krefter. Naturen til kjemiske og molekylære bindinger er den samme - elektriske. Det finnes flere typer kjemiske bindinger, de viktigste er kovalente og ioniske.
Kovalent binding utføres på grunn av dannelsen av ett eller flere vanlige elektronpar som tidligere tilhørte forskjellige atomer. En kovalent binding kan være enkelt (hydrogen, klor) eller multippel (for eksempel nitrogen - 3). En kovalent binding dannes mellom atomer av ett eller flere kjemiske elementer med nære ioniseringspotensialer. I sin rene form realiseres en kovalent binding gjennom samspillet mellom elementer og halvfylte elektronskall.
La oss vurdere den skjematiske strukturen til hydrogenatomet og molekylet, Fig. 1. Når man beveger seg i baner, er elektroner ofte plassert mellom kjerner, noe som bidrar til å bringe atomene nærmere hverandre. Radiusen til et hydrogenatom er 0,53 ångstrøm, og avstanden mellom atomkjernene i et hydrogenmolekyl er bare 0,74 ångstrøm.
Utseendet til et par negativt ladede elektroner mellom positivt ladede ioner fører til at begge ionene tiltrekkes av de delte elektronene og dermed tiltrekkes av hverandre. Hvert atom samhandler med et begrenset antall naboer, og antall naboer er lik antallet valenselektroner til atomet. Derfor er den kovalente bindingen mettet. I tillegg samhandler et atom bare med de naboene som det har utvekslet elektroner med, det vil si at den kovalente bindingen er rettet.
Forholdet mellom størrelsen på en positivt ladet kjerne og størrelsen på valenselektronskallet er ekstremt lite, derfor, når vi analyserer tiltrekningskraften, kan vi anta at punktladninger samhandler, det vil si at tiltrekningskraften er beskrevet av enkleste formen for Coulomb-loven: tiltrekningskraften er omvendt proporsjonal med kvadratet på avstanden mellom ladningene. Når atomer kommer nærmere, gjensidig frastøtning av indre elektroniske skall, og frastøtingen av atomer er beskrevet av en mer kompleks lov: frastøtningskraften er omvendt proporsjonal med avstanden mellom atomer i potensen n, hvor n >2.
En økning i atomnummeret til et grunnstoff fører til en økning i antall elektronskall som skjermer interaksjonen mellom positivt ladede kjerner og valenselektroner. Derfor avtar kraften til gjensidig tiltrekning og dybden av den potensielle brønnen avtar. Som et resultat, med en økning i serienummeret til elementet, synker smeltetemperaturen, den termiske ekspansjonskoeffisienten øker og elastisitetsmodulen avtar.
Hvis et molekyl består av atomer av det samme kjemiske elementet, faller sentrene for positive og negative ladninger i det sammen. Indre elektrisk dipolmoment μ av et slikt molekyl er null. Dielektrikumet som dannes av slike ikke-polare molekyler er også ikke-polart.
 Hvis et molekyl består av atomer av forskjellige kjemiske elementer, vil elektronparet skifte mot et av atomene som har en større elektronegativitet. Som et resultat vil polarisering av molekylet oppstå. Selve molekylet vil bli polart eller dipol. Elektrisk dipolmoment μ
et slikt molekyl vil være lik
Hvis et molekyl består av atomer av forskjellige kjemiske elementer, vil elektronparet skifte mot et av atomene som har en større elektronegativitet. Som et resultat vil polarisering av molekylet oppstå. Selve molekylet vil bli polart eller dipol. Elektrisk dipolmoment μ
et slikt molekyl vil være lik
μ = q * l, Kl*m
Hvor q– absolutt verdi av dipolladningen, l– dipolarm, avstanden mellom sentrene til ulik ladning. Dipolmoment måles ofte i debyes (D). 1D = 3,33∙10 -30 C∙m. Vannmolekylet er polart, siden elektronparene mellom oksygen og hydrogen forskyves mot oksygenatomet (fig. 2).
I nærvær av polare kovalente bindinger kan det også dannes upolare molekyler hvis dipolmomentene til disse bindingene balanserer hverandre. Dette fenomenet er typisk for komplekse organiske molekyler. For eksempel er polyetylen, transformatorolje og parafin ikke-polare stoffer, selv om karbon-hydrogenbindingen er polar.
Ionebinding oppstår mellom atomer som har veldig stor forskjell i elektronegativitet. I dette tilfellet forskyves elektronparet så kraftig mot et av atomene at det faktisk blir et negativt ion. Dermed dannes en ionisk binding på grunn av overføring av et elektron fra ett atom i molekylet til et annet. Et typisk eksempel på en slik sammenheng er bordsalt:
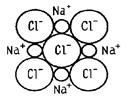 NaCl = Na+ + Cl-.
NaCl = Na+ + Cl-.
Grensene mellom polare kovalente og ioniske bindinger er veldig vilkårlige det er ingen grunnleggende forskjell i mekanismen for dannelse av disse bindingene. Men disse bindingene er svært forskjellige i mengden energi som må brukes for å bryte en slik binding.
En ionisk binding dannes ved interaksjon av atomer med et lite antall valenselektroner og atomer med et stort antall elektroner i valensskallene. I dette tilfellet overføres de ytre elektronene til atomer med lavt ioniseringspotensial til valensskallene til atomer med høyt ioniseringspotensial. Som et resultat dannes positivt og negativt ladede ioner, gjensidig tiltrukket av elektrostatiske krefter. En ionisk binding er umettet fordi hver av de negativt ladede ionene tiltrekker seg positivt ladede, og hver av de positivt ladede ionene tiltrekker seg alle negativt ladede. Imidlertid er ionisk binding retningsbestemt, siden ionet tiltrekker seg motsatt ladede ioner og frastøter sannsynlig ladede.
En reduksjon i størrelsen på ionet og en økning i ladningen fører til en økning i bindingsenergi, og følgelig til en økning i materialets smeltetemperatur, en reduksjon i termisk ekspansjonskoeffisient og en økning i elastisitetsmodulen.
Metallkobling dannes mellom atomer av ett eller flere kjemiske grunnstoffer der valenselektronskjellene er mindre enn halvfylte. Siden ioneenergien er minimal når den er helt fylt ytre skall, atomer gir fra seg sine ytre valenselektroner og blir til positivt ladede ioner, mellom hvilke det er frie elektroner (elektrongass).
Hvert av de positivt ladede ionene tiltrekkes av frie elektroner, og dermed trekkes ionene til hverandre. Den metalliske bindingen er ikke-retningsbestemt og umettet, og antallet nærmeste naboer til et ion bestemmes hovedsakelig av geometriske og energetiske faktorer. Følgelig er krystallgitteret til metaller tettpakket. Under påvirkning av et elektrisk felt beveger elektroner som ikke er assosiert med ioner, det vil si at metaller har høy elektrisk ledningsevne. Frie elektroner kan lett akselerere og bremse, det vil si endre kinetisk energi. Som et resultat absorberer metalliske materialer kvanter elektromagnetisk felt all energi, det vil si metaller er ugjennomsiktige for radio- og lysbølger i et bredt spekter av frekvenser. Etter å ha absorbert et kvantum av det elektromagnetiske feltet, blir det frie elektronet begeistret og, når det går over i en stasjonær tilstand, sender det ut et lignende kvante. Med andre ord reflekterer metalliske materialer radio- og lysbølger.
Polarisasjonskobling, eller van der Waals-kobling. Dannes når molekyler eller atomer av inerte gasser kommer sammen. La oss vurdere fremveksten av polarisasjonskobling ved å bruke eksemplet med inerte atomer.
Et enkelt atom har et symmetrisk elektronskall. Når to atomer nærmer seg hverandre, samhandler elektronskallene deres elektrisk og deformeres (se fig. 6). Som et resultat blir atomene til dipoler som tiltrekker hverandre. Jo høyere atomnummer, jo flere elektronskall har det, og derfor svekkes bindingen av valenselektroner med kjernen, og den blir lettere å deformere. Følgelig øker atomets dipolmoment og bindingsenergien mellom atomene øker. Derfor er kokepunktet for tunge inerte gasser merkbart høyere enn kokepunktet for lette gasser.
 Lignende prosesser oppstår når elektrisk nøytrale molekyler nærmer seg hverandre. Dessuten, jo høyere molekylvekt, jo større er dipolmomentet til molekylene og jo høyere bindingsenergi. Derfor er stoffer med lav molekylvekt ved romtemperatur gasser, stoffer med høy molekylvekt er væsker, og stoffer med enda høyere molekylvekt er faste stoffer.
Lignende prosesser oppstår når elektrisk nøytrale molekyler nærmer seg hverandre. Dessuten, jo høyere molekylvekt, jo større er dipolmomentet til molekylene og jo høyere bindingsenergi. Derfor er stoffer med lav molekylvekt ved romtemperatur gasser, stoffer med høy molekylvekt er væsker, og stoffer med enda høyere molekylvekt er faste stoffer.
Det er viktig å huske på at flere typer kjemiske bindinger kan oppstå samtidig i samme materiale. Så inne i et polyetylenmolekyl er bindingen kovalent, og mellom molekylene er den polarisert. I diamant er karbonatomer forbundet med en kovalent binding, og i grafitt danner tre elektroner en kovalent binding, ett elektron går til å danne en metallisk binding, og de resulterende flate molekylene er forbundet med en polarisasjonsbinding.
I noen tilfeller observeres en endring i type forbindelse når ytre forhold endres. Dermed er tinn et element i den fjerde gruppen, og en kovalent binding må realiseres i den, men tinn har fem elektronskall, og valenselektronene er svakt bundet til kjernen. Derfor, ved termisk eksitasjon, løsnes elektroner fra atomer og bindingen blir metallisk. Opp til en temperatur på 13 * C er den interatomiske bindingen i tinn kovalent, og det er en typisk halvleder - "grå" tinn. Over 13*C blir bindingen metallisk, og tinn oppfører seg som et typisk metall - "hvit" tinn. Det er viktig å merke seg at transformasjonen av hvitt tinn til grått tinn ikke kan skje strengt tatt ved 13*C. Dette er forårsaket av en betydelig forskjell i pakningstettheten til atomer. Under perestroika krystallgitter Elastiske spenninger oppstår i materialet, som øker energien i systemet. Derfor begynner transformasjonen med betydelig superkjøling. De elastiske spenningene som oppstår under transformasjonen ødelegger materialet, og det er grunnen til at grå tinn eksisterer i form av et pulver. Forvandlingen av hvitt tinn til grått var årsaken til døden til Robert Scotts ekspedisjon. Siden drivstoffboksene var loddet med tinn, ble det hvite tinnet grått når det ble avkjølt og drivstoffet lekket ut.