H2co3 løselig eller ikke. Salter av karbonsyre. Påføring av karbonsyresalter
Jo mer en person lærer om verden rundt seg, jo mer innser han begrensningene og ufullkommenhetene i kunnskapen hans. La oss ta kullsyrevann for eksempel. Som du vet, skiller denne drinken seg fra andre ved at den inneholder karbonsyre i små doser, som umiddelbart begynner å gå i oppløsning så snart vi skru av korken på flasken. Derfor er vi ikke i tvil om utsagnet i læreboken i kjemi om at dette stoffet er ekstremt ustabilt. I gassfasen blir det veldig raskt til en blanding av vanlig vann og vanlig karbondioksid. Men som nyere studier har vist, kan man argumentere med dette. Men først, la oss huske hva dette stoffet er.
Hva er karbonsyre?
Formelen for dette kjemisk forbindelse ser ganske enkel ut: H 2 CO 3. Tilstedeværelsen av to hydrogenatomer indikerer at denne syren er dibasisk, og dens ustabilitet indikerer dens svakhet. Som kjent skjer dissosiasjon av syrer i vann, og den aktuelle forbindelsen faller ikke inn under unntaket. Imidlertid er det en særegenhet her: på grunn av tilstedeværelsen av to baser, skjer denne prosessen i to stadier:
H 2 CO 3 ↔ H + + HCO 3 - ,
HCO 3 - ↔ H + + CO3 2- .
Ved reaksjon med en sterk base danner karbonsyre normale eller sure karbonater. Sistnevnte skiller seg ut ved at de ikke erstatter to, men bare ett hydrogenatom. Et godt eksempel på et normalt karbonat er vaskebrus (Na 2 CO 3 ), og natron (NaHCO 3) kan spille rollen som et bikarbonateksempel. 
Hva oppdaget forskerne?
Når vannfritt kaliumbikarbonat (KHCO 3) protoneres ved -110 o C, slår hydrogen ut K-atomet. Resultatet er svært ren karbonsyre. Senere ble enda mer funnet enkel måte- oppvarming i vakuum NH 4 HCO 3. Som et resultat av denne nedbrytningen av ammoniumbikarbonat frigjøres ammonium og det dannes vannfri karbonsyre. Sistnevnte viser utrolig stabilitet når den sublimeres i vakuum. Da forskerne begynte å utforske dette paradokset, viste det seg at årsaken ligger i betydningen av energibarrieren. For den vannfrie forbindelsen H 2 CO 3 er den 44 kcal/mol, og når det er vann er verdien nesten to ganger lavere - 24 kcal/mol. Så, under passende forhold, kan karbonsyre godt eksistere i en fri form. Imidlertid denne oppdagelsen interessant ikke bare fra kjemi-teoriens synspunkt. Dens praktiske verdi er at den tillot oss å studere pusteprosessen på en ny måte. Nå tror forskere at dannelsen av karbonsyre i en levende organisme akselereres ved hjelp av et spesielt enzym, og det er nettopp dette som gjør at karbondioksid raskt kan fjernes fra cellene, først inn i blodet og deretter inn i lungene.  Astronomer unnlot heller ikke å dra nytte av denne oppdagelsen: den frie tilstanden til karbondioksid tillot dem å utføre sin spektrale analyse, og nå kan denne forbindelsen identifiseres i atmosfæren til planetene rundt oss. Alt dette tyder på at verden fortsatt er full av forskjellige mysterier og hemmeligheter. Det ser ut til at moderne lærebøker må skrives om mer enn én gang, for å klargjøre gamle og oppdage ny kunnskap.
Astronomer unnlot heller ikke å dra nytte av denne oppdagelsen: den frie tilstanden til karbondioksid tillot dem å utføre sin spektrale analyse, og nå kan denne forbindelsen identifiseres i atmosfæren til planetene rundt oss. Alt dette tyder på at verden fortsatt er full av forskjellige mysterier og hemmeligheter. Det ser ut til at moderne lærebøker må skrives om mer enn én gang, for å klargjøre gamle og oppdage ny kunnskap.
Karbondioksid dannes hele tiden i naturen gjennom oksidasjon organisk materiale(råting av plante- og dyrerester, respirasjon, forbrenning av drivstoff). I store mengder det frigjøres fra vulkanske sprekker og fra vannet i mineralkilder.
I laboratorier oppnås karbondioksid vanligvis ved å behandle marmor med saltsyre i et Kipp-apparat:
I industrien produseres store mengder karbondioksid ved å brenne kalkstein:
Karbondioksid under normale forhold er en fargeløs gass, omtrent 1,5 ganger tyngre enn luft, på grunn av hvilken den kan helles som en væske fra en beholder til en annen. Massen under normale forhold er 1,98 g. Oppløseligheten av karbondioksid i vann er lav: 1 volum vann ved oppløser 0,88 volum, og ved volum. Karbondioksid brukes til produksjon av brus ved bruk av ammoniumkloridmetoden (se s. 426), til syntese av urea (s. 427), til produksjon av karbonsyresalter, samt til karbonisering av frukt og mineraler. vann og andre drikker.
Under trykk blir karbondioksid til en væske ved romtemperatur. Flytende karbondioksid lagres i stålsylindere. Når det raskt helles ut av beholderen, absorberes så mye varme på grunn av fordampning at det blir til en fast hvit snølignende masse, som uten å smelte sublimerer kl. Fast karbondioksid, kalt tørris, brukes til å kjøle ned lett bedervelige matvarer, til å lage og konservere iskrem, og i mange andre bruksområder der lave temperaturer kreves.
En løsning i vann har en sur smak og har en lett sur reaksjon på grunn av tilstedeværelsen i løsningen av små mengder karbonsyre, dannet som et resultat av en reversibel reaksjon:
Dermed er karbondioksid karbonsyreanhydrid.
Likevekten til den siste reaksjonen er sterkt forskjøvet til venstre; bare en svært liten mengde oppløst omdannes til karbonsyre.
Karbonsyre kan bare eksistere i vandig løsning. Når løsningen varmes opp, fordamper karbondioksid, formasjonslikevekten skifter til venstre, og til slutt blir det rent vann igjen.
Karbonsyre er veldig svak. I løsning dissosieres det hovedsakelig til ioner og danner bare i ubetydelige mengder ioner:
Dissosiasjonskonstanten til karbonsyre i det første trinnet, under hensyntagen til likevekten av ioner med hele mengden karbondioksid i løsning (både i form og i form av karbonsyre), uttrykkes ved forholdet:
![]()
Dissosiasjonskonstant i andre trinn;
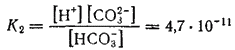
Som en dibasisk syre danner karbonsyre to serier salter - medium og sur; Mediumsalter kalles karbonater, sure salter kalles bikarbonater.
Salter av karbonsyre kan oppnås enten ved innvirkning av karbondioksid på alkali, eller ved utvekslingsreaksjoner mellom løselige salter av karbonsyre og salter av andre syrer. For eksempel:
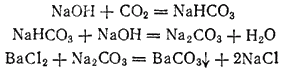
Med svake baser produserer karbonsyre i de fleste tilfeller bare basiske salter, et eksempel på dette er hydroksykobberkarbonat. Et naturlig forekommende mineral av denne sammensetningen kalles malakitt.
Når de utsettes for syrer, selv så svake som eddiksyre, brytes alle karbonater ned med frigjøring av karbondioksid. Denne reaksjonen brukes ofte for å oppdage karbonater, siden frigjøringen lett oppdages av den karakteristiske susende lyden.
Ved oppvarming brytes alle karbonater, unntatt alkalimetallsalter, ned og frigjøres. Nedbrytningsprodukter er i de fleste tilfeller oksider av de tilsvarende metallene, for eksempel:
![]()
Ved oppvarming omdannes alkalimetallhydrokarbonater til karbonater:
De fleste bikarbonater, så vel som kalium, natrium, rubidium, cesium og ammoniumkarbonater, er løselige i vann; karbonater av andre metaller er uløselige i vann.
Løsninger av alkalimetallkarbonater har en svært alkalisk reaksjon på grunn av hydrolyse
Av salter av karbonsyre er kalsiumkarbonat ekstremt vanlig i naturen. Det finnes i form av kalkstein, kritt og marmor.
Kalsiumkarbonat er uløselig i vann. Derfor blir kalkvann (kalsiumhydroksidløsning) grumsete når karbondioksid passerer gjennom det:
Men hvis du passerer gjennom kalkvann i lang tid, lysner den i utgangspunktet uklare væsken gradvis og blir til slutt helt gjennomsiktig. Oppløsning skjer på grunn av dannelsen av et surt salt - kalsiumbikarbonat:
Kalsiumbikarbonat er et skjørt stoff. Når løsningen kokes eller står i luften i lang tid, brytes bikarbonatet ned med frigjøring og dannelse av et middels salt.
Løseligheten til hydrokarbonater i vann forklarer den konstante bevegelsen av karbonater i naturen. Grunnvann og grunnvann som inneholder kalsium, siver gjennom jorda og spesielt gjennom lag av kalkstein, løser opp kalsiumkarbonat og fører det med seg i form av bikarbonat ut i bekker, elver og hav. Derfra går det inn i organismene til marine dyr og brukes til å bygge skjelettene deres, eller ved å frigjøre karbondioksid blir det igjen til kalsiumkarbonat og avsettes i form av lag.
I tillegg til kalsiumkarbonat finnes magnesiumkarbonat, kjent som magnesit, i naturen i store mengder. Magnesiumkarbonat, som kalsiumkarbonat, løses lett opp i vannholdig, og blir til løselig bikarbonat.
Noen karbonater er verdifulle malmer og brukes til å oppnå metaller (for eksempel spartjernsmalm, galmay).
Natriumkarbonat, eller brus, . I form av krystallinsk hydrat tilsvarer brus formelen. Imidlertid eroderer dette krystallinske hydratet lett - det mister en del av krystallvannet.
Brus er et av hovedproduktene kjemisk industri. Det konsumeres i store mengder av glass, såpe, papirmasse og papir, tekstil, olje og andre industrier, og brukes også til å produsere ulike natriumsalter. Bakepulver brukes også i hverdagen, hovedsakelig som vaskemiddel.
For tiden produseres brus industrielt ved ammoniakk-klorid-metoden, basert på dannelsen av natriumbikarbonat under reaksjonen mellom natriumklorid og ammoniumbikarbonat i en vandig løsning.
En konsentrert løsning av natriumklorid mettes med ammoniakk, og deretter føres karbondioksid, oppnådd ved å brenne kalkstein, inn i den under trykk.
Når ammoniakk, karbondioksid og vann reagerer, dannes ammoniumbikarbonat
som går inn i en utvekslingsreaksjon med natriumklorid og danner ammoniumklorid og natriumbikarbonat:
Natriumbikarbonat er relativt lite løselig i kaldt vann og frigjøres i form av et bunnfall, som filtreres.
Ved kalsinering brytes natriumbikarbonat ned til karbonat, vann og karbondioksid, som igjen går i produksjon:
Ved å varme opp en løsning som inneholder ammoniumklorid med lesket kalk, frigjøres ammoniakk
som også settes tilbake i produksjon.
Dermed er det eneste produksjonsavfallet kalsiumklorid, som forblir i løsning etter frigjøring av ammoniakk og har begrenset bruk.
Natriumkarbonat oppnådd ved ammoniumkloridmetoden inneholder ikke krystallvann og kalles soda.
Noe av natriumbikarbonatet brukes uten videre bearbeiding. For eksempel, under navnet drikke, eller bikarbonat, brus, brukes det i medisin, i baking og i næringsmiddelindustrien.
Produksjonen av soda i Sovjetunionen vokser stadig. I 1957 utgjorde det . tonn, omtrent tre ganger produksjonsvolumet i 1940, og i 1985 nådde det .
Kaliumkarbonat, eller kalium, er et hvitt pulver som diffunderer i fuktig luft og er svært løselig i vann. Det brukes til å produsere såpe, i produksjon av ildfast glass og i fotografering. Potaske produseres ved virkningen av karbondioksid på en løsning av kaliumhydroksid dannet under elektrolysen av en løsning av kaliumklorid:
En praktisk talt viktig forbindelse, urea eller urea, oppnås ved å reagere karbondioksid med ammoniakk under trykk:
Denne metoden for å produsere urea ble oppdaget i 1870 av A.I.
Urea fremstår som hvite krystaller, svært løselig i vann. Den brukes i jordbruk som høykonsentrert nitrogengjødsel og som tilsetning i fôr til drøvtyggere. Billig plast, såkalt ureaplast, fås fra urea. Det fungerer også som et utgangsmateriale for produksjon av mange organiske stoffer og medisiner. Noen ureaderivater har ugressdrepende egenskaper - de brukes til å kontrollere ugress.
Generell informasjon Karbonsyre er en svak dibasisk syre. Ikke isolert i sin rene form. Dannes i små mengder ved oppløsning karbondioksid i vann, inkludert karbondioksid fra luften. Danner en rekke stabile uorganiske og organiske derivater: salter (karbonater og bikarbonater), estere, amider, etc.



Dekomponering Når temperaturen på løsningen øker og/eller partialtrykket av karbondioksid synker, skifter likevekten i systemet til venstre, noe som fører til nedbrytning av en del av kullsyren til vann og karbondioksid. Når løsningen koker, spaltes karbonsyre fullstendig:

Forberedelse Karbonsyre dannes når karbondioksid løses opp i vann. Karbonsyreinnholdet i løsningen øker med synkende løsningstemperatur og økende karbondioksidtrykk. Karbonsyre dannes også ved samspillet mellom dens salter (karbonater og bikarbonater) med en sterkere syre. I dette tilfellet brytes det meste av den dannede karbonsyren som regel ned i vann og karbondioksid

Bruksområde Karbonsyre er alltid tilstede i vandige løsninger av karbondioksid (kullsyreholdig vann). Biokjemi bruker egenskapen til et likevektssystem for å endre gasstrykket i forhold til endringen i innholdet av oksoniumioner (surhet) ved konstant temperatur. Dette lar deg registrere i sanntid fremdriften til enzymatiske reaksjoner som oppstår med endringer i pH i løsningen

Organiske derivater Karbonsyre kan formelt betraktes som en karboksylsyre med en hydroksylgruppe i stedet for en hydrokarbonrest. I denne egenskapen kan den danne alle derivater som er karakteristiske for karboksylsyrer. Noen representanter for slike forbindelser er oppført i tabellen. Klasse av forbindelser Eksempel på forbindelse Estere polykarbonater Syreklorider Fosgenamider Urea Nitrilycyansyre Anhydrider pyrokarbonsyre
Karbonmonoksid (IV), karbonsyre og dens salter
D karbonmonoksid CO 2 (karbondioksid) - under normale forhold er det en fargeløs og luktfri gass, litt sur smak, ca. 1,5 ganger tyngre enn luft, løselig i vann, flytende ganske lett (ved romtemperatur under et trykk på ca. 60 ∙ 10 5 Det kan gjøres om til væske). Når den avkjøles til -56,2ºС, størkner flytende karbondioksid og blir til en snølignende masse.
I alt aggregeringstilstander består av ikke-polare lineære molekyler. Kjemisk struktur CO 2 -molekylet bestemmes ved sp-hybridisering av det sentrale karbonatomet og dannelsen av ytterligere π r-r-forbindelser: O = C = O.
Noe av CO 2 oppløst i vil samvirke med den for å danne karbonsyre:
CO 2 + H 2 O ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3.
Karbondioksid absorberes veldig lett av alkaliløsninger for å danne karbonater og bikarbonater:
CO 2 + 2 NaOH = Na 2 CO 3 + H 2 O; CO 2 + NaOH = NaHCO 3.
CO 2 -molekyler er svært termisk stabile. Av denne grunn brenner ikke karbondioksid og støtter ikke forbrenning av konvensjonelt drivstoff. Men i atmosfæren brenner noen enkle stoffer, hvis atomer viser høy affinitet for oksygen, for eksempel magnesium, når det oppvarmes, antennes i en CO 2 -atmosfære.
Karbonsyre H 2 CO 3 er en svak forbindelse og finnes kun i vandige løsninger. Mesteparten av karbondioksidet oppløst i vann er i form av hydratiserte CO 2 molekyler, en mindre del danner kullsyre.
Vandige løsninger i likevekt med atmosfærisk CO2 er sure: = 0,04 M og pH ≈ 4.
Karbonsyre er tobasisk, tilhører svake elektrolytter, dissosieres trinnvis (K 1 = 4, 4 ∙ 10 −7; K 2 = 4, 8 ∙ 10 −11). Når CO 2 er oppløst i vann, etableres følgende dynamiske likevekt:
H 2 O + CO 2 ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 −
Når en vandig løsning av karbondioksid varmes opp, avtar gassens løselighet, CO 2 frigjøres fra løsningen, og likevekten skifter til venstre.
Å være dibasisk, danner karbonsyre to serier av salter: medium salter (karbonater) og sure salter (bikarbonater). De fleste karbonsyresalter er fargeløse. Av karbonatene er det kun alkalimetall- og ammoniumsalter som er løselige i vann.
I vann gjennomgår karbonater hydrolyse, og løsningene deres har derfor en alkalisk reaksjon:
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH.
Ytterligere hydrolyse med dannelse av karbonsyre skjer praktisk talt ikke under normale forhold.
Oppløsningen av hydrokarbonater i vann er også ledsaget av hydrolyse, men i mye mindre grad, og miljøet skapes lett alkalisk (pH ≈ 8).
Ammoniumkarbonat (NH 4) 2 CO 3 er svært flyktig ved høye og jevne ved vanlige temperaturer, spesielt i nærvær av vanndamp, som forårsaker alvorlig hydrolyse.
Sterke syrer og til og med svak eddiksyre fortrenger karbonsyre fra karbonater:
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 O + CO 2.
I motsetning til de fleste karbonater, er alle bikarbonater løselige i vann. Οʜᴎ er mindre stabile enn karbonater av de samme metallene, og når de varmes opp, brytes de lett ned og blir til de tilsvarende karbonatene:
2KHCO3 = K2CO3 + H2O + CO2;
Ca(HCO 3) 2 = CaCO 3 + H 2 O + CO 2.
Hydrokarbonater brytes ned med sterke syrer, som karbonater:
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + CO 2
Fra salter av karbonsyre høyeste verdi har natriumkarbonat (brus), kaliumkarbonat (potaske), kalsiumkarbonat (kritt, marmor, kalkstein), natriumbikarbonat ( natron) og basisk kobberkarbonat (CuOH) 2 CO 3 (malakitt).
Basiske salter av karbonsyre er praktisk talt uløselige i vann og brytes lett ned ved oppvarming:
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O.
Den termiske stabiliteten til karbonater avhenger av polarisasjonsegenskapene til ionene som utgjør karbonatet. Jo mer polariserende kationet har på karbonationet, desto lavere er nedbrytningstemperaturen til saltet. Hvis kationen lett kan deformeres, vil også selve karbonationet ha en polariserende effekt på kationen, noe som vil føre til en kraftig nedgang i saltets nedbrytningstemperatur.
Natrium- og kaliumkarbonater smelter uten nedbrytning, og de fleste andre karbonater, når de varmes opp, brytes ned til metalloksid og karbondioksid:
MgCO 3 = MgO + CO 2.
Karbonmonoksid
CO-molekylet har følgende struktur
: MED ≡ OM :
To bindinger dannes på grunn av sammenkoblingen av 2p-elektroner av karbon- og oksygenatomer, den tredje bindingen dannes av donor-akseptormekanismen på grunn av den frie 2p-orbitalen av karbon og 2p-elektronparet til oksygenatomet. Dipolmomentet til molekylet er ubetydelig, mens den effektive ladningen på karbonatomet er negativ, og på oksygenatomet er den positiv.
Siden strukturen til CO-molekylet er lik strukturen til nitrogenmolekylet, er deres fysiske egenskaper like. CO har svært lave smeltepunkter (-204ºС) og kokepunkter (-191,5ºС), det er en fargeløs, veldig giftig gass, luktfri og ganske mye lettere enn luft. Det er dårlig løselig i vann og interagerer ikke med det.
CO regnes som et ikke-saltdannende oksid, fordi under normale forhold interagerer det ikke med hverken syrer eller alkalier. Det dannes under forbrenning av kull og karbonforbindelser med begrenset tilgang til oksygen, samt under interaksjonen av karbondioksid med varmt kull: CO 2 + C = 2CO.
I laboratoriet oppnås den fra maursyre ved påvirkning av konsentrert svovelsyre på den når den oppvarmes:
HCOOH + H 2 SO 4 (konsentrert) = CO + H 2 SO 4 ∙ H 2 O.
Du kan også bruke oksalsyre. Svovelsyre i disse reaksjonene virker det som et vannfjernende middel.
Under normale forhold er CO kjemisk ganske inert, men når det varmes opp, viser det reduserende egenskaper, som er mye brukt i pyrometallurgi for å produsere visse metaller: Fe 2 O 3 + 3CO = 2Fe + 3CO 2.
I luft brenner CO med en blåaktig flamme og slipper ut stor mengde varme: 2CO + O 2 = 2CO 2 + 569 kJ.
I tillegg til oksygen, i direkte sollys eller i nærvær av en katalysator (aktivert karbon), kombineres CO med klor for å danne fosgen:
CO + Cl 2 = COCl 2.
Fosgen er en fargeløs gass med en karakteristisk lukt. Det er lett løselig i vann, men som karbonsyreklorid hydrolyseres det gradvis i henhold til følgende skjema: COCl 2 + 2H 2 O = 2HCl + H 2 CO 3. På grunn av sin høye toksisitet ble fosgen først brukt som et kjemisk krigføringsmiddel. verdenskrig. Den kan nøytraliseres med lesket kalk.
Ved oppvarming oksideres CO av svovel: CO + S = COS.
CO-molekylet kan fungere som en ligand i forskjellige komplekse forbindelser. På grunn av det ikke-bindende elektronparet av karbon, viser det σ-donoregenskaper, og på grunn av de frie π-antibindende orbitalene, viser det π-akseptoregenskaper. Karbonylkomplekser av d-metaller er av spesiell interesse, fordi Metaller med høy renhet oppnås ved termisk dekomponering av karbonyler.
Karbonsyre (formel H2CO3) er en svak dibasisk syre. Når oppløsninger varmes opp, brytes de ned til vann. Denne syren er av stor betydning ikke bare for dyr, men også for planter. I menneskekroppen er H2CO3, så vel som dets salter, en del av blodet. Det bidrar til å opprettholde syre-basebalansen i kroppen, som er nødvendig for normal funksjon. Dissosiasjonen av syrer i et vandig medium fører til dannelse av anioner og kationer. Ionekonsentrasjon har stor betydning for flyten til mange biokjemiske prosesser i kroppen til dyr og planter. For noen sykdommer aktiv reaksjon blod skifter til den sure (med duodenale og magesår) eller alkaliske (med sepsis, lungebetennelse) side. Ved acidose øker konsentrasjonen av hydrogenioner. Slike endringer provoserer i sin tur utvikling, som til slutt fører til selve dyrets død. Med alkalose øker konsentrasjonen av kationer i blodet, noe som fører til stivkrampe og dyrets død.
Karbonsyre dannes under reaksjonen av CO2 med H2O. De fleste forskere tror at den utrolige utviklingen av vegetasjon i den primitive verden er forbundet med en betydelig konsentrasjon av karbonsyre i atmosfæren. Den mest intense veksten ble observert i de plantene som ble dyrket med en høy (5-10%) konsentrasjon av karbonsyre i atmosfæren.
Det skal bemerkes at planter er halvt karbon. Karbonsyre gir næring til planten, samtidig som den fremmer løseligheten av mineralkomponentene i jorda. Derfor er det i dette tilfellet en nødvendig komponent i jorda. Siden karbonsyre hemmer nitrifiserende mikroorganismer, bør jorda inneholde minimumskonsentrasjonen.
Derfor, for å oppnå høye utbytter, er det nødvendig å balansere konsentrasjonen av denne syren. Forskere har slått fast i sine eksperimenter at med den daglige introduksjonen av karbonsyre (400 cm3) og luft (1200 cm3) i jorda, produserer den dobbelt så mange planter sammenlignet med jorda som ikke inneholdt disse forbindelsene.
Landlig jord er preget av en overflod av luft, så prosessene med nitrifikasjon og forfall foregår veldig intensivt. Det er fastslått at løv i skogen brytes fullstendig ned i løpet av et år. Slik kraftig nitrifikasjon forekommer også i steppene. Under nedbrytningsprosessen frigjøres en betydelig mengde karbonsyre. Sistnevnte er halvannen gang tyngre enn luft, så karbonsyre trenger dypere ned i jorda enn luft, og der har det en gunstig effekt på mineralkomponenter.
Ved dyppløying faller organiske rester ned i dypere jordlag, hvor det ikke er O2, men det er en overflod av karbonsyre. I dette tilfellet skjer nitrifikasjon ekstremt sakte. Under disse forholdene brytes ikke mineralkomponenter ned og nitrogenforbindelser dannes ikke. Store stykker gjødsel ligger i bakken i årevis uten å råtne. Grunneiere er tvunget til å kjøpe syntetisk gjødsel (kainitt, superfosfat. Innovative jorddyrkingsteknologier gjør det mulig å øke planteproduktiviteten. Dette skyldes først og fremst at det i prosessen med å dyrke jorda gjenstår organiske rester. Optimale forhold skapes for utvikling og reproduksjon av nitrifiserende mikroorganismer.
Fosfor, som er i jorda, blir ikke alltid absorbert av planter. Tribasisk kalsiumfosfat er en lite løselig forbindelse. Derfor blir jord rik på fosforsyreforbindelser ufruktbar.