Mekanismen for dannelse av kovalente bindinger. Mekanisme for forbindelsesdannelse
Kjemisk binding.
Ulike stoffer har ulike strukturer. Av alle kjente stoffer til dags dato eksisterer bare inerte gasser i form av frie (isolerte) atomer, noe som skyldes den høye stabiliteten til deres elektroniske strukturer. Alle andre stoffer (og mer enn 10 millioner av dem er for tiden kjent) består av bundne atomer.
Merk: kursiv angir de delene av teksten du ikke trenger å lære eller forstå.
Dannelsen av molekyler fra atomer fører til en gevinst i energi, siden under normale forhold er molekyltilstanden mer stabil enn atomtilstanden.
Et atom kan ha fra ett til åtte elektroner i sitt ytre energinivå. Hvis antallet elektroner i det ytre nivået av et atom er det maksimale det kan romme, kalles et slikt nivå fullført. Fullførte nivåer er preget av stor styrke. Dette er de ytre nivåene av edelgassatomer: helium har to elektroner på det ytre nivået (s 2), resten har åtte elektroner (ns 2 np 6). De ytre nivåene av atomer til andre elementer er ufullstendige og i prosess kjemisk interaksjon de er fullført.
En kjemisk binding dannes av valenselektroner, men den oppstår på forskjellige måter. Det er tre hovedtyper kjemiske bindinger: kovalent, ionisk og metallisk.
Kovalent binding
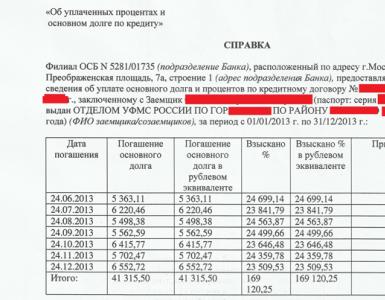
Forekomstmekanisme kovalent binding La oss se på eksemplet på dannelsen av et hydrogenmolekyl:
H + H = H2; Q = 436 kJ
Kjernen til et fritt hydrogenatom er omgitt av en sfærisk symmetrisk elektronsky dannet av et 1 s elektron. Når atomer kommer nærmere en viss avstand, overlapper deres elektronskyer (orbitaler) delvis.
Som et resultat dannes en molekylær to mellom sentrene til begge kjernene. elektronsky, som har den maksimale elektrontettheten i rommet mellom kjernene; en økning i den negative ladningstettheten favoriserer en sterk økning i tiltrekningskreftene mellom kjernene og molekylskyen.
Så en kovalent binding dannes som et resultat av overlappingen av elektronskyer av atomer, ledsaget av frigjøring av energi. Hvis avstanden mellom kjernene til hydrogenatomer som nærmer seg før berøring er 0,106 nm, er denne avstanden 0,074 nm etter at elektronskyene overlapper hverandre (dannelse av H2-molekylet). Den største overlappingen av elektronskyer skjer langs linjen som forbinder kjernene til to atomer (dette skjer når en σ-binding dannes). Jo større overlapping av elektronorbitaler er, desto sterkere er den kjemiske bindingen. Som et resultat av dannelsen av en kjemisk binding mellom to hydrogenatomer, når hver av dem elektronisk konfigurasjon atomet til edelgassen helium.
Kjemiske bindinger er vanligvis avbildet på forskjellige måter:
1) ved å bruke elektroner i form av punkter plassert ved kjemisk tegn element. Da kan dannelsen av et hydrogenmolekyl vises med diagrammet
H∙ + H∙ →H:H
2) ofte, spesielt i organisk kjemi, er en kovalent binding representert med en strek (primtall) (for eksempel H-H), som symboliserer et delt elektronpar.
Den kovalente bindingen i klormolekylet utføres også ved bruk av to delte elektroner, eller et elektronpar:
Enslige elektronpar, det er 3 i et atom
← Ensomme elektronpar,
Det er 6 av dem i et molekyl.
uparet elektron delt eller delt elektronpar
Som du kan se, har hvert kloratom tre ensomme par og ett uparet elektron. Dannelsen av en kjemisk binding skjer på grunn av de uparrede elektronene til hvert atom. Uparede elektroner binder seg til et delt elektronpar, også kalt et delt par.
Hvis én kovalent binding (ett felles elektronpar) har oppstått mellom atomer, så kalles det en enkeltbinding; hvis flere, så multiple doble (to delte elektronpar), trippel (tre delte elektronpar).
Enkel lenke er avbildet med en strek (slag), dobbel - med to, trippel - med tre. Bindestreken mellom to atomer viser at de har et delt elektronpar, som et resultat av at det dannes en kjemisk binding. Ved hjelp av slike streker skildrer de strukturformler molekyler.
Så i et klormolekyl har hvert av dets atomer et fullstendig ytre nivå på åtte elektroner (s 2 p 6), og to av dem (elektronpar) tilhører likt begge atomene. Overlappingen av elektroniske orbitaler under dannelsen av et molekyl er vist i fig.
I nitrogenmolekylet N2 har atomene tre vanlige elektronpar:
:N· + ·N: → :N:::N:
Tydeligvis et nitrogenmolekyl sterkere enn molekyler hydrogen eller klor, som står for den betydelige tregheten til nitrogen i kjemiske reaksjoner.
En kjemisk binding utført av elektronpar kalles kovalent.
Mekanismer for dannelse av kovalente bindinger.
En kovalent binding dannes ikke bare på grunn av overlapping enkelt-elektron skyer er en utvekslingsmekanisme for dannelse av kovalente bindinger.
I en utvekslingsmekanisme deler atomer det samme antall elektroner.
En annen mekanisme for dannelsen er også mulig - donor-akseptor. I dette tilfellet oppstår den kjemiske bindingen pga ikke delt elektronpar av ett atom og gratis orbitaler til et annet atom.
La oss som et eksempel se på mekanismen for dannelse av ammoniumionet NH4+
Når ammoniakk interagerer med HCl, oppstår en kjemisk reaksjon:
NH 3 + HCl = NH 4 Cl eller i forkortet ionisk form: NH 3 + H + = NH 4 +
Samtidig har nitrogenatomet i ammoniakkmolekylet ikke delt et par elektroner (to-elektron sky):
Billett nr. 11
Billett nr. 12
Billett nr. 13
Billett nr. 14
Billett nr. 15.
EKSAMENSBILLETT nr. 11
Redoksreaksjoner. Oksydasjonstilstanden til et grunnstoff.
Eksempler på oksidasjons- og reduksjonsmidler. Metode valensbindinger
(MVS). Utveksling og donor-akseptormekanismer for kovalent bindingsdannelse.
Svare:Redoksreaksjoner(ORR) – reaksjoner som oppstår ved endring i d.o. atomer.
Redoksreaksjoner er kjemiske reaksjoner som oppstår med en endring i oksidasjonstilstandene til atomene som utgjør de reagerende stoffene, realisert ved omfordeling av elektroner mellom det oksiderende atomet og det reduserende atomet.Oksidasjonstilstand
(s.o.) - ladning som er tilordnet et atom, betrakter det som et ionOksydasjonsmiddel (Okse
) – aksepterer elektroner.Reduser (Rød
) – donerer elektroner
Okse 1 + Rød 2 Rød 1 + Okse 2
Ox1 + ne– → Rød1
Cu2+ + 2e– → Cu0
CuS04 + Zn → ZnSO4 + Cu
Rød2 – ne– → Ox2
Zn0 – 2e– → Zn2+
Valensbindingsmetode

går ut fra det faktum at hver molekylær orbital er representert som en algebraisk sum (lineær kombinasjon) av atomorbitaler.), der den enkleste kjemiske bindingen kan være enten to- eller multisenter, i MBC er det alltid to-elektron og nødvendigvis to-senter. Antallet elementære kjemiske bindinger som et atom eller ion kan danne er lik dets valens. Valenselektroner deltar i dannelsen av en kjemisk binding.
|
Mekanismer for bindingsdannelse Utveksling : A + BA |
I Giver-akseptor : EN : A + BA BF 3 + F – – : NH 3 + H + + |
Mekanismen for dannelse av kovalente bindinger.
MBC lar en skille mellom tre mekanismer for kovalent bindingsdannelse: utveksling, donor-akseptor og dativ.
Byttemekanisme. Det inkluderer de tilfellene av dannelsen av en kjemisk binding når hvert av de to bundne atomene tildeler ett elektron for deling, som om de bytter dem. For å binde kjernene til to atomer, må elektroner være i rommet mellom kjernene. Denne regionen i molekylet kalles bindingsregionen (regionen der det er mest sannsynlig at et elektronpar befinner seg i molekylet). For at utveksling av uparrede elektroner mellom atomer skal skje, må atomorbitaler overlappe hverandre. Dette er virkningen av utvekslingsmekanismen for dannelsen av en kovalent kjemisk binding. Atomorbitaler kan bare overlappe hvis de har de samme symmetriegenskapene rundt den indre nukleære aksen.

|
|
Donor-akseptor- og dativmekanismer.
Donor-akseptormekanismen er assosiert med overføring av et ensomt elektronpar fra ett atom til et ledig atomorbital et annet atom. For eksempel dannelsen av ionet - :
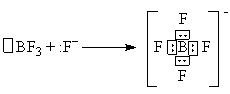
Den ledige p-AO i boratomet i BF 3-molekylet aksepterer et par elektroner fra fluoridionet (donor). I det resulterende anion er fire kovalente B-F-bindinger like i lengde og energi. I det opprinnelige molekylet ble alle tre B-F-bindingene dannet av utvekslingsmekanismen.
Atomer hvis ytre skall består kun av s- eller p-elektroner kan enten være donorer eller akseptorer av et ensomt elektronpar. Atomer hvis valenselektroner også er på d-AO kan samtidig fungere som både donorer og akseptorer. For å skille mellom disse to mekanismene ble begrepene om dativmekanismen for bindingsdannelse introdusert.
Eksamenskort nr. 12
Termodynamikkens andre lov.
Entropi, dens fysiske betydning og beregningsmetoder. Endring i entropi av systemet som et sannsynlighetskriterium for retningen av prosessen.
(MVS). Utveksling og donor-akseptormekanismer for kovalent bindingsdannelse.
Osmose. Osmotisk trykk. Van't Hoffs lov for ikke-elektrolyttløsninger.
Termodynamikkens andre lov I isolert
system, er en spontan prosess bare mulig med en økning i entropi.
(valensbindingsmetode) 1. Byttemekanisme består av å sammenkoble to elektroner som tilhører forskjellige atomer
og har motsatt rygg. Det kan uttrykkes med følgende diagram:– dannelsen av en kjemisk binding ved å gi ett atom et par elektroner for vanlig bruk, og det andre med en fri orbital. Et atom som gir et elektronpar kalles giver, og et atom som har en fri orbital er akseptor. Tilkoblingsskjema:
For å forklare det romlige arrangementet av atomer i et molekyl, brukes L. Paulings teori om hybridisering.
Hybridisering er prosessen med interaksjon av elektroniske orbitaler, deres sammenslåing, som fører til justering i form og energi Avhengig av hvilke orbitaler som er involvert i dannelsen av hybridorbitaler, vurderes ulike typer hybridisering og romlige konfigurasjoner av de resulterende hybridorbitalene (fig. 2).
Ris. 2. Romlig ordning av elektronisk
skyer for ulike typer hybridisering.
sp hybridisering: en s- og en p-orbital samhandler, noe som resulterer i dannelsen av to nye typer orbitaler, som kalles sp-hybrid; disse orbitalene har form av en uregelmessig åttefigur, deres akser ligger på samme rette linje og danner en vinkel på 180 0, molekylet har en lineær struktur;
sp 2 hybridisering: en s- og to p-orbitaler samhandler, noe som resulterer i dannelsen av tre orbitaler av en ny type, som kalles sp 2-hybrid; aksene til disse orbitalene ligger i samme plan, vinklene mellom dem er lik 120 0, molekylet har formen av en vanlig trekant;
sp 3 hybridisering: En s- og tre p-orbitaler samhandler, som et resultat av hybridisering, dannes det fire nye sp 3 -hybride orbitaler, hvis akser er rettet fra sentrum til toppunktene til tetraederet, vinklene mellom aksene er 109 0 28′ har molekylet en tetraedrisk struktur.
I et molekyl ammoniakk(NH 3) nitrogenatomet er også i sp 3 hybrid tilstand, tre par elektroner deles med hydrogenatomer og deltar i dannelsen av bindinger, og ett elektronpar ( et enkelt elektronpar ) tilhører bare nitrogenatomet. For å forutsi geometrien til et ammoniakkmolekyl bør nitrogenatomet plasseres i sentrum av tetraederet, hydrogenatomene ved tre hjørner og det ensomme elektronparet i det fjerde toppunktet, og dermed gi ammoniakkmolekylet en pyramideformet form.
På samme måte kan vi vurdere strukturen til molekylet vann. I den okkuperer to ensomme elektronpar med oksygen to hjørner av tetraederet, og de to andre er okkupert av hydrogenatomer, noe som fører til vinkelformen til vannmolekylet.
Et ensomt elektronpar danner en mer diffus "elektronsky" enn en bindende (delt, delt), så det opptar et større volum, noe som fører til en reduksjon i bindingsvinkler sammenlignet med tetraedriske.
Valenselektroner befinner seg ikke bare i s- og p-orbitaler, men også i d, sistnevnte deltar også i dannelsen av hybridorbitaler. To saker gjennomføres hybridiseringer som involverer d-orbitaler : sp 3 d 2 og sp 3 d. I det første tilfellet har molekylet en oktaedrisk struktur, og i det andre dannes en trigonal bipyramid (tabell 7).
Tabell 7
Geometriske konfigurasjoner av molekyler
A – multivalent atom; X – atomer assosiert med atom A; n er antall atomer X; E – ensomt elektronpar; m – antall ensomme elektronpar.
Metallkobling. I motsetning til ionisk og kovalente forbindelser metaller har høy elektrisk og termisk ledningsevne. Den høye elektriske ledningsevnen til metaller indikerer at elektroner kan bevege seg fritt gjennom hele volumet, dvs. et metall kan betraktes som en krystall, i gitternodene som det er ioner forbundet med elektroner i vanlig bruk, dvs. i metaller er det en svært ikke-lokalisert kjemisk binding. Samlingen av elektroner som gir denne forbindelsen kalles elektrongass.
Flere generell tilnærming En forståelse av ioniske, kovalente og metalliske krystaller kan oppnås ved å anvende konseptene til den molekylære orbitalmetoden.
Komplekse forbindelser
Når man vurderer typene kjemiske bindinger, ble det bemerket at attraktive krefter oppstår ikke bare mellom atomer, men også mellom molekyler og ioner. Slik interaksjon kan føre til dannelsen av nye, mer komplekse komplekse (eller koordinasjons) forbindelser.
Omfattende er forbindelser som har aggregater av atomer (komplekser) ved nodene til krystallgitteret som er i stand til selvstendig tilværelse i løsning og har egenskaper som er forskjellige fra egenskapene til deres bestanddeler (atomer, ioner eller molekyler).
I molekylet til en kompleks forbindelse (for eksempel K 4) skilles følgende: strukturelle elementer: ion- kompleksdannende middel(for et gitt Fe-kompleks), er de festede partiklene koordinert rundt det ligander eller addender (CN -), komponenter sammen med et kompleksdannende middel intern koordinasjonssfære(4-), og de resterende partiklene inkludert i ekstern koordinasjonssfære(K+). Når komplekse forbindelser er oppløst, forblir liganden i sterk forbindelse med det kompleksdannende ionet, og danner et nesten ikke-dissosierende kompleksion. Antall ligander kalles koordinasjonsnummer(ved K 4 er koordinasjonstallet 6). Koordinasjonsnummeret bestemmes av det sentrale atomets og ligandens natur, og tilsvarer også den mest symmetriske geometriske konfigurasjonen: 2 (lineær), 4 (tetraedrisk eller kvadratisk) og 6 (oktaedrisk konfigurasjon).
Typiske kompleksdannende midler er følgende kationer: Fe 2+, Fe 3+, Co 3+, Co 2+, Cu 2+, Ag+, Cr 3+, Ni 2+. Evnen til å danne komplekse forbindelser er assosiert med elektronisk struktur atomer. Elementer i d-familien danner spesielt lett komplekse ioner, for eksempel: Ag +, Au +, Cu 2+, Hg 2+, Zn 2+, Fe 2+, Cd 2+, Fe 3+, Co 3+, Ni 2+, Pt 2+, Pt 4+ osv. Kompleksdannende midler kan være A1 3+ og noen ikke-metaller, for eksempel Si og B.
Ladede ioner kan tjene som ligander: F - , OH - , NO 3 - , NO 2 - , Cl - , Br - , I - , CO 3 2- , CrO 4 2- , S 2 O 3 2- , CN - , PO 4 3- osv., og elektrisk nøytral polare molekyler: NH 3, H 2 O, PH 3, CO, etc. Hvis alle ligandene til kompleksdannende middel er like, så er komplekset homogen forbindelse f.eks. Cl2; hvis liganden er forskjellige, så forbindelsen heterogen, for eksempel Cl. Koordinasjonsbindinger (donor-akseptor) etableres vanligvis mellom kompleksdannende middel og liganden. De dannes som et resultat av overlappingen av de elektronfylte orbitalene til liganden med de ledige orbitalene til sentralatomet. I komplekse forbindelser er det kompleksdannende middelet donoren og liganden er akseptoren.
Antallet kjemiske bindinger mellom det kompleksdannende middelet og liganden bestemmer koordinasjonstallet til det kompleksdannende middelet. Karakteristiske koordinasjonstall: Cu + , Ag + , Au + = 2; Cu2+, Hg2+, Pb2+, Pt2+, Pd2+ =4; Ni 2+, Ni 3+, Co 3+, Al 3+ = 4 eller 6; Fe 2+, Fe 3+, Pt 4+, Pd 4+, Ti 4+, Pb 4+, Si 4+ =6.
Ladningen til kompleksdanneren er lik den algebraiske summen av ladningene til dets bestanddeler, for eksempel: 4-, x + 6(-1) = 4-; x = 2.
De nøytrale molekylene som inngår i det komplekse ionet påvirker ikke ladningen. Hvis hele den indre sfæren bare er fylt med nøytrale molekyler, er ladningen til ionet lik ladningen til kompleksdannende middel. Så 2+-ionet har en ladning av kobber x = 2+. Ladningen til et komplekst ion er lik ladningen til ionene som ligger i den ytre sfæren. I K 4 er ladningen -4, siden det er 4 K + kationer i den ytre sfæren, og molekylet som helhet er elektrisk nøytralt.
Ligander i den indre sfæren kan erstatte hverandre mens de opprettholder samme koordinasjonsnummer.
Klassifisering og nomenklatur av komplekse forbindelser. Synspunkter ladning av en kompleks partikkel Alle komplekse forbindelser kan deles inn i kationiske, anioniske og nøytrale.
Kationiske komplekser danner metallkationer som koordinerer nøytrale eller anioniske ligander rundt seg, og den totale ladningen til liganden er mindre i absolutt verdi enn oksidasjonstilstanden til kompleksdannende middel, for eksempel Cl 3 . Kationiske kompleksforbindelser, i tillegg til hydroksokomplekser og salter, kan være syrer, for eksempel H – heksafluorantimonsyre.
Termodynamikkens andre lov anioniske komplekser, tvert imot er antallet ligandanioner slik at den totale ladningen til det komplekse anionet er negativ, for eksempel. I anioniske komplekser hydroksydanioner fungerer som ligander - disse er hydroxo-komplekser (for eksempel Na 2 -kaliumtetrahydroksozinkat), eller anioner av sure rester er syrekomplekser(for eksempel K 3 – kaliumheksacyanoferrat (III)) .
Nøytrale komplekser kan være av flere typer: et kompleks av et nøytralt metallatom med nøytrale ligander (for eksempel Ni(CO) 4 - nikkeltetrakarbonyl, [Cr(C 6 H 6) 2 ] - dibenzen krom). I nøytrale komplekser av en annen type balanserer ladningene til kompleksdannende middel og ligander hverandre (for eksempel heksamminplatina (IV)klorid, trinitrotriamminkobolt).
Komplekse forbindelser kan klassifiseres av ligandens natur. Blant forbindelsene med nøytrale ligander skilles vannkomplekser, ammoniakk og metallkarbonyler. Komplekse forbindelser som inneholder vannmolekyler som ligander kalles vannkomplekser . Når et stoff krystalliserer fra en løsning, fanger kationen opp noen av vannmolekylene som kommer inn i krystallgitter salt. Slike stoffer kalles krystallhydrater, for eksempel A1C1 3 · 6H 2 O. De fleste krystallinske hydrater er vannkomplekser, så det er mer nøyaktig å avbilde dem i form av et komplekst salt ([A1(H 2 O) 6 ]C1 3 - hexaaqua aluminiumklorid). Komplekse forbindelser med ammoniakkmolekyler som ligand kalles ammoniakk , for eksempel C1 4 – heksammin platina (IV) klorid. Metallkarbonyler er komplekse forbindelser hvor karbonoksidmolekyler (II) tjener som ligander, for eksempel jernpentakarbonyl, nikkeltetrakarbonyl.
Det er kjent komplekse forbindelser med to komplekse ioner i et molekyl, for hvilke det er et fenomen med koordinasjonsisomerisme, som er assosiert med ulik fordeling av ligander mellom kompleksdannende midler, for eksempel: – heksantrokoboltat (III) heksaamminnikkel (III).
Ved kompilering navn på komplekse forbindelser følgende regler gjelder:
1) hvis forbindelsen er et komplekst salt, kalles anion først i nominativ kasus, og deretter kation i genitiv kasus;
2) når man navngir et kompleksion, indikeres liganden først, deretter kompleksdannende middel;
3) molekylære ligander tilsvarer navnene på molekyler (bortsett fra vann og ammoniakk, begreper brukes for å betegne dem "aqua" Og "amin");
4) avslutningen - o legges til anioniske ligander, for eksempel: F - - fluor, C1 - - klor, O 2 - - oxo, CNS - - rhodano, NO 3 - - nitrat, CN - - cyano, SO 4 2 - - sulfato , S 2 O 3 2- – tiosulfato, CO 3 2- – carbonato, PO 4 3- – fosfato, OH - – hydroxo;
5) Greske tall brukes for å indikere antall ligander: 2 – di-, 3 – tre-, 4 – tetra-, 5 – penta-, 6 – heksa-;
6) hvis kompleksionet er en kation, brukes det russiske navnet på elementet for å navngi kompleksdannende middel, hvis anionet er latinsk;
7) etter navnet på kompleksdanneren, indikerer et romertall i parentes dets oksidasjonstilstand;
8) i nøytrale komplekser er navnet på sentralatomet gitt i det nominative tilfellet, og dets oksidasjonstilstand er ikke indikert.
Egenskaper til komplekse forbindelser. Kjemiske reaksjoner som involverer komplekse forbindelser er delt inn i to typer:
1) ytre sfære - under deres forekomst forblir den komplekse partikkelen uendret (utvekslingsreaksjoner);
2) intrasfærisk - under deres forekomst oppstår endringer i graden av oksidasjon av sentralatomet, i strukturen til liganden, eller endringer i koordinasjonssfæren (reduksjon eller økning i koordinasjonstallet).
En av de viktigste egenskapene til komplekse forbindelser er deres dissosiasjon i vandige løsninger. De fleste vannløselige ioniske komplekser er sterke elektrolytter, de dissosieres i ytre og indre sfærer: K 4 ↔ 4K + + 4 - .
Komplekse ioner er ganske stabile, det er de svake elektrolytter, trinnvis eliminering av ligander til en vandig løsning:
4 - ↔ 3- + CN - (antall trinn er lik antall ligander).
Hvis den totale ladningen til en partikkel av en kompleks forbindelse er null, har vi et molekyl ikke-elektrolytt, For eksempel.
Under utvekslingsreaksjoner beveger komplekse ioner seg fra en forbindelse til en annen uten å endre sammensetningen. Elektrolytisk dissosiasjon av komplekse ioner adlyder massehandlingsloven og er kvantitativt preget av en dissosiasjonskonstant, som kalles ustabilitetskonstanter Kn. Jo lavere ustabilitetskonstanten til komplekset er, jo mindre grad det spaltes til ioner, jo mer stabil er denne forbindelsen. I forbindelser karakterisert ved høy Kn er komplekse ioner ustabile, dvs. de er praktisk talt fraværende i løsning doble salter . Forskjellen mellom typiske representanter for komplekse og doble salter er at sistnevnte dissosierer for å danne alle ionene som er en del av dette saltet, for eksempel: KA1(SO 4) 2 ↔ K + + A1 3+ + 2SO 4 2- (dobbelt salt);
K ↔ 4K + + 4- (komplekst salt).
Litteratur
1. Glinka N. L. Generell kjemi. – M.: Kjemi, 2006. – 720 s.
2. Glinka N.L. Oppgaver og øvelser generell kjemi. – L. Chemistry, 1985. – 264 s.