Det periodiske systemet og strukturen til atomet kort. Den periodiske loven og det periodiske systemet av kjemiske elementer av D. I. Mendeleev basert på ideer om strukturen til atomet
1. formulering av den periodiske lov
D.I. Mendeleev i lys av teorien om atomstruktur.
Oppdagelse av den periodiske loven og utviklingen av det periodiske systemet kjemiske elementer D.I. Mendeleev var toppen av utviklingen av kjemi på 1800-tallet. En enorm mengde kunnskap om egenskapene til 63 grunnstoffer kjent på den tiden ble brakt i orden.
D.I. Mendeleev mente at hovedkarakteristikken til grunnstoffer er deres atomvekter, og i 1869 formulerte han først den periodiske loven.
Egenskapene til enkle legemer, så vel som formene og egenskapene til sammensetninger av elementer, er periodisk avhengig av atomvektene til elementene.
Mendeleev delte opp hele serien av elementer, ordnet i rekkefølge etter økende atommasser, i perioder, innenfor hvilke egenskapene til elementene endres sekvensielt, og plasserte periodene for å fremheve lignende elementer.
Til tross for den enorme betydningen av en slik konklusjon, representerte den periodiske loven og Mendeleevs system bare en strålende generalisering av fakta, og deres fysiske betydning forble uklar i lang tid. Bare som et resultat av utviklingen av fysikk på 1900-tallet - oppdagelsen av elektronet, radioaktivitet, utviklingen av teorien om atomstruktur - fastslo den unge, talentfulle engelske fysikeren G. Mosle at størrelsen på ladningene til atomkjerner øker konsekvent fra element til element med ett. Med denne oppdagelsen bekreftet Mosle den strålende gjetningen til Mendeleev, som tre steder i det periodiske systemet beveget seg bort fra den økende sekvensen av atomvekter.
Ved kompileringen plasserte Mendeleev således 27 Co foran 28 Ni, 52 Ti foran 5 J, 18 Ar foran 19 K, til tross for at dette var i strid med formuleringen av den periodiske loven, det vil si arrangementet av elementer i rekkefølge etter økende atomvekter.
Ifølge Mosles lov tilsvarte ladningene til kjernene til disse grunnstoffene deres plassering i tabellen.
I forbindelse med oppdagelsen av Mosles lov er den moderne formuleringen av den periodiske lov som følger:
egenskapene til grunnstoffene, så vel som formene og egenskapene til deres forbindelser, er periodisk avhengig av ladningen til kjernen til deres atomer.
Sammenhengen mellom den periodiske lov og det periodiske systemet og strukturen til atomer.
Så, hovedkjennetegn av et atom er ikke atommassen, men størrelsen på den positive ladningen til kjernen. Dette er mer generelt eksakt spesifikasjon et atom, og derfor et grunnstoff. Alle egenskapene til elementet og dets plassering i det periodiske systemet avhenger av størrelsen på den positive ladningen til atomkjernen. Dermed, Serienummeret til et kjemisk element sammenfaller numerisk med ladningen til kjernen til dets atom. Periodiske tabell elementer er en grafisk representasjon av den periodiske loven og gjenspeiler strukturen til grunnstoffenes atomer.
Teorien om atomstruktur forklarer de periodiske endringene i elementenes egenskaper. En økning i den positive ladningen til atomkjerner fra 1 til 110 fører til en periodisk repetisjon av de strukturelle elementene i det ytre energinivået i atomer. Og siden egenskapene til elementer hovedsakelig avhenger av antall elektroner på det ytre nivået; så gjentar de seg med jevne mellomrom. Dette er den fysiske betydningen av den periodiske loven.
Som et eksempel kan du vurdere endringen i egenskapene til de første og siste elementene i perioder. Hver periode i det periodiske systemet begynner med elementer av atomer, som på det ytre nivået har ett s-elektron (ufullstendige ytre nivåer) og derfor viser lignende egenskaper - de gir lett fra seg valenselektroner, som bestemmer deres metalliske karakter. Disse er alkalimetaller - Li, Na, K, Rb, Cs.
Perioden avsluttes med elementer hvis atomer på det ytre nivået inneholder 2 (s 2) elektroner (i den første perioden) eller 8 (s 1 p 6) elektroner (i alle påfølgende perioder), det vil si at de har et fullført ytre nivå. Dette er edelgasser He, Ne, Ar, Kr, Xe, som har inerte egenskaper.
Det er nettopp på grunn av likheten i strukturen til det ytre energinivået at deres fysiske og kjemiske egenskaper er like.
I hver periode med økende serienummer av elementer metalliske egenskaper gradvis svekkes og ikke-metalliske øker, avsluttes perioden med en inert gass. I hver periode, med en økning i ordenstallet til elementene, svekkes de metalliske egenskapene gradvis og de ikke-metalliske egenskapene øker, og perioden avsluttes med en inert gass.
I lys av læren om atomets struktur, blir inndelingen av alle elementer i syv perioder gjort av D. I. Mendeleev tydelig. Periodenummeret tilsvarer antallet energinivåer til atomet, det vil si at posisjonen til elementene i det periodiske systemet bestemmes av strukturen til atomene deres. Avhengig av hvilket undernivå som er fylt med elektroner, er alle grunnstoffene delt inn i fire typer.
1. s-elementer. S-underlaget til det ytre laget (s 1 - s 2) fylles. Dette inkluderer de to første elementene i hver periode.
2. p-elementer. P-undernivået til det eksterne nivået fylles ut (p 1 - s 6) - Dette inkluderer de seks siste elementene i hver periode, med start fra den andre.
3. d-elementer. D-subnivået til det siste nivået (d1 - d 10) er fylt, og 1 eller 2 elektroner forblir på det siste (ytre) nivået. Disse inkluderer elementer av plug-in tiår (10) med store perioder, fra den 4., plassert mellom s- og p-elementene (de kalles også overgangselementer).
4. f-elementer. F-undernivået til det dype (en tredjedel av det utenfor) nivået (f 1 -f 14) er fylt, og strukturen til det eksterne elektroniske nivået forblir uendret. Disse er lantanider og aktinider, lokalisert i den sjette og syvende perioden.
Dermed tilsvarer antall elementer i perioder (2-8-18-32) det maksimalt mulige antallet elektroner på de tilsvarende energinivåene: i den første - to, i den andre - åtte, i den tredje - atten, og i den fjerde - trettito elektroner. Inndelingen av grupper i undergrupper (hoved- og sekundær) er basert på forskjellen i fyllingen av energinivåer med elektroner. Hovedundergruppen består s - og p-elementer, og en sekundær undergruppe - d-elementer. Hver gruppe kombinerer elementer hvis atomer har en lignende struktur på det ytre energinivået. I dette tilfellet inneholder atomene til elementene i hovedundergruppene på de ytre (siste) nivåene et antall elektroner som er lik gruppenummeret. Dette er de såkalte valenselektronene.
Elementene side undergrupper Elektronene til ikke bare de ytre, men også de nest siste (andre ytre) nivåene er valens, som er hovedforskjellen i egenskapene til elementene i hoved- og sekundærundergruppene.
Det følger at gruppenummeret som regel indikerer antall elektroner som kan delta i dannelsen kjemiske bindinger. Dette er fysisk betydning av gruppenummeret.
Fra synspunktet til teorien om atomstruktur, er økningen i de metalliske egenskapene til elementene i hver gruppe med økende ladning av atomkjernen lett forklart. Sammenligner for eksempel fordelingen av elektroner på tvers av nivåer i atomene 9 F (1s 2 2s 2 2р 5) og 53J (1s 2 2s 2 2р 6 3s 2 Зр 6 3d 10 4s 2 4 s 6 4 d 10 5s 2 5p 5) det kan bemerkes at de har 7 elektroner i det ytre nivået, noe som indikerer lignende egenskaper. Imidlertid er de ytre elektronene i et jodatom lenger unna kjernen og holdes derfor mindre tett. Av denne grunn kan jodatomer donere elektroner eller med andre ord utvise metalliske egenskaper, noe som ikke er typisk for fluor.
Så strukturen til atomer bestemmer to mønstre:
a) endring i egenskapene til elementer horisontalt - i en periode, fra venstre til høyre, blir metalliske egenskaper svekket og ikke-metalliske egenskaper forbedret;
b) endring i egenskapene til elementer vertikalt - i en gruppe, med økende serienummer, øker metalliske egenskaper og ikke-metalliske egenskaper svekkes.
Dermed: Når ladningen til kjernen av atomer av kjemiske elementer øker, endres strukturen til deres elektroniske skall periodisk, noe som er årsaken til den periodiske endringen i egenskapene deres.
3. Struktur periodisk Systemer til D. I. Mendeleev.
Det periodiske systemet til D. I. Mendeleev er delt inn i syv perioder - horisontale sekvenser av elementer arrangert i stigende rekkefølge etter serienummer, og åtte grupper - sekvenser av elementer med samme type elektronisk konfigurasjon atomer og lignende kjemiske egenskaper.
De tre første periodene kalles små, resten - store. Den første perioden inkluderer to elementer, den andre og tredje perioden - åtte hver, den fjerde og femte - atten hver, den sjette - trettito, den syvende (ufullstendig) - tjueen elementer.
Hver periode (unntatt den første) begynner med et alkalimetall og slutter med en edelgass.
Elementer i periode 2 og 3 kalles typiske.
Små perioder består av en rad, store - av to rader: partall (øvre) og oddetall (nedre). Metaller er plassert i jevne rader av store perioder, og elementenes egenskaper endres litt fra venstre til høyre. I odde rader med store perioder endres egenskapene til elementene fra venstre til høyre, som i elementene i periode 2 og 3.
I det periodiske systemet, for hvert element dets symbol og serienummer, er navnet på elementet og dets relative atommasse indikert. Koordinatene til elementets plassering i systemet er periodenummer og gruppenummer.
Elementer med serienummer 58-71, kalt lantanider, og elementer med nummer 90-103 - aktinider - er plassert separat nederst på bordet.
Grupper av elementer, utpekt med romertall, er delt inn i hoved- og sekundære undergrupper. Hovedundergruppene inneholder 5 elementer (eller flere). De sekundære undergruppene inkluderer elementer av perioder som starter fra den fjerde.
De kjemiske egenskapene til grunnstoffer bestemmes av strukturen til deres atom, eller snarere strukturen elektronskall atomer. Sammenligning av strukturen til elektroniske skall med plasseringen av elementer i det periodiske systemet lar oss etablere en rekke viktige mønstre:
1. Periodetallet er lik det totale antallet energinivåer fylt med elektroner i atomene til et gitt grunnstoff.
2. I små perioder og odde serier av store perioder, når den positive ladningen til kjernene øker, øker antallet elektroner i det ytre energinivået. Dette er forbundet med svekkelse av metall og styrking ikke-metalliske egenskaper elementer fra venstre til høyre.
Gruppenummeret angir antall elektroner som kan delta i dannelsen av kjemiske bindinger (valenselektroner).
I undergrupper, når den positive ladningen til kjernene til elementære atomer øker, blir deres metalliske egenskaper sterkere og deres ikke-metalliske egenskaper svekkes.
Periodisk lov D.I. Mendeleev:Egenskaper til enkle legemer, samt former og egenskaper til forbindelserforskjeller av elementer er periodisk avhengig avverdiene til grunnstoffenes atomvekter. (Egenskapene til grunnstoffene er periodisk avhengig av ladningen til atomene i kjernene deres).
Periodisk system for grunnstoffer. Serier av elementer der egenskapene endres sekvensielt, for eksempel rekken av åtte elementer fra litium til neon eller fra natrium til argon, kalte Mendeleev perioder. Hvis vi skriver disse to periodene under hverandre slik at natrium er under litium og argon er under neon, får vi følgende oppstilling av elementer:
Med dette arrangementet inneholder de vertikale søylene elementer som er like i sine egenskaper og har samme valens, for eksempel litium og natrium, beryllium og magnesium, etc.
Etter å ha delt inn alle grunnstoffene i perioder og plassert en periode under en annen slik at elementer som ligner i egenskaper og type forbindelser som ble dannet ble plassert under hverandre, kompilerte Mendeleev en tabell som han kalte det periodiske systemet av grunnstoffer etter grupper og serier.
Betydningen av det periodiske systemetVi. Det periodiske system av grunnstoffer hadde stor innflytelse på den etterfølgende utviklingen av kjemi. Ikke bare var det den første naturlige klassifiseringen av kjemiske elementer, som viser at de danner et harmonisk system og er i nær forbindelse med hverandre, men det var også et kraftig verktøy for videre forskning.
7. Periodiske endringer i egenskapene til kjemiske elementer. Atomiske og ioniske radier. Ioniseringsenergi. Elektron affinitet. Elektronegativitet.
Atomradiusens avhengighet av ladningen til kjernen til et atom Z er periodisk. I løpet av en periode, når Z øker, er det en tendens til at størrelsen på atomet reduseres, noe som er spesielt tydelig observert i korte perioder
Med begynnelsen av konstruksjonen av et nytt elektronisk lag, mer fjernt fra kjernen, dvs. under overgangen til neste periode, øker atomradiusene (sammenlign for eksempel radiene til fluor- og natriumatomer). Som et resultat, innenfor en undergruppe, med økende kjernefysisk ladning, øker størrelsen på atomer.
Tapet av elektronatomer fører til en reduksjon i dens effektive størrelse, og tillegg av overflødige elektroner fører til en økning. Derfor er radiusen til et positivt ladet ion (kation) alltid mindre, og radiusen til et negativt ladet ikke (anion) er alltid større enn radius det tilsvarende elektrisk nøytrale atomet.
Innenfor en undergruppe øker radiene til ioner med samme ladning med økende kjerneladning Dette mønsteret forklares med en økning i antall elektroniske lag og den økende avstanden til ytre elektroner fra kjernen.
Den mest karakteristiske kjemiske egenskapen til metaller er atomenes evne til lett å gi fra seg eksterne elektroner og forvandle seg til positivt ladede ioner, mens ikke-metaller tvert imot er preget av evnen til å legge til elektroner for å danne negative ioner. For å fjerne et elektron fra et atom og transformere sistnevnte til et positivt ion, er det nødvendig å bruke litt energi, kalt ioniseringsenergi.
Ioniseringsenergi kan bestemmes ved å bombardere atomer med elektroner akselerert i et elektrisk felt. Den laveste feltspenningen der elektronhastigheten blir tilstrekkelig til å ionisere atomer kalles ioniseringspotensialet til atomene til et gitt grunnstoff og uttrykkes i volt. Med bruk av tilstrekkelig energi kan to, tre eller flere elektroner fjernes fra et atom. Derfor snakker de om det første ioniseringspotensialet (energien til fjerning av det første elektronet fra atomet) og det andre ioniseringspotensialet (energien til fjerning av det andre elektronet)
Som nevnt ovenfor kan atomer ikke bare donere, men også få elektroner. Energien som frigjøres når et elektron legges til et fritt atom kalles atomets elektronaffinitet. Elektronaffinitet, som ioniseringsenergi, uttrykkes vanligvis i elektronvolt. Dermed er elektronaffiniteten til hydrogenatomet 0,75 eV, oksygen - 1,47 eV, fluor - 3,52 eV.
Elektronaffinitetene til metallatomer er vanligvis nær null eller negative; Det følger av dette at for atomer av de fleste metaller er tilsetning av elektroner energetisk ugunstig. Elektronaffiniteten til ikke-metalliske atomer er alltid positiv og jo større, jo nærmere er ikke-metallet edelgassen i det periodiske system; dette indikerer en økning i ikke-metalliske egenskaper når slutten av perioden nærmer seg.
Kjemiske elementer av D.I. Mendeleev - grunnlaget for moderne kjemi. De viser til slike vitenskapelige lover som gjenspeiler fenomener som faktisk eksisterer i naturen, og derfor aldri vil miste sin betydning.
Oppdagelsen deres ble forberedt av hele historien om utviklingen av kjemi, men det krevde genialiteten til D.I. Mendeleev, hans gave til vitenskapelig framsyn, før disse mønstrene ble formulert og grafisk presentert i form av en tabell. Vi vil bruke moderne synonymer av begrepene som brukes av den store russiske kjemikeren.
Forutsetninger for oppdagelsen av den periodiske loven av D. I. Mendeleev
Opphopning av faktamateriale
Da den periodiske loven ble oppdaget, var 63 kjemiske grunnstoffer kjent, og sammensetningen og egenskapene til deres tallrike forbindelser ble beskrevet.
Forskerverk - forgjengere til D. I. Mendeleev
Berzelius klassifisering. Den fremragende svenske kjemikeren J. J. Berzelius delte alle grunnstoffer inn i metaller og ikke-metaller basert på forskjeller i egenskapene til de enkle stoffene og forbindelsene de dannet. Han bestemte at metaller tilsvarer basiske oksider og baser, og ikke-metaller tilsvarer sure oksider og syrer.
Men det var bare to grupper, de var store og inneholdt vesentlig forskjellige elementer fra hverandre. Tilstedeværelsen av amfotere oksider og hydroksider i noen metaller har forårsaket forvirring. Klassifiseringen var mislykket.
Döbereiners triader (1816). Den tyske kjemikeren I. W. Debereiner delte grunnstoffene i tre basert på likheten i egenskapene til stoffene de danner og slik at verdien som vi nå forstår som den relative atommassen (At) til det midterste elementet var lik det aritmetiske gjennomsnittet av de to ytre. Eksempel på en triade: Li, Na, K.
A r (Na) = (7 + 39): 2 = 23
Eksempler på andre triader inkluderer:
Arbeidet til I. Döbereiner fungerte som bekreftelse på ideen om at det er en viss sammenheng mellom atommasser og elementenes egenskaper. Men han klarte å komponere bare fire triader; han var ikke i stand til å klassifisere alle elementene som var kjent på den tiden.
Chancourtois-spiral (1862). Professor i Paris videregående skole A. Beguier de Chancourtois foreslo å arrangere elementene langs en spiral eller generatrise av en sylinder i økende rekkefølge av deres atommasser og påpekte at man i dette tilfellet kan legge merke til likheten mellom egenskapene til stoffene som dannes av elementene hvis de faller på samme vertikale linje på sylinderen, plassert under hverandre , For eksempel:
Newlands oktaver(1865). Den amerikanske kjemikeren D. A. R. Newlands prøvde å ordne grunnstoffene kjent for ham i rekkefølge etter økende atommasser og oppdaget en slående likhet mellom hvert åttende element, som startet med et hvilket som helst, lik strukturen til en musikalsk oktav bestående av åtte lyder. Han kalte oppdagelsen sin oktaverloven:
[]
Imidlertid var han ikke i stand til å forklare mønsteret han fant på en tilfredsstillende måte; dessuten var det i tabellen hans ikke plass for elementer som ennå ikke var oppdaget, og noen vertikale søyler inneholdt elementer som skilte seg kraftig i egenskapene deres. London Chemical Society hilste hans oktaverlov med likegyldighet og foreslo at Newlands skulle prøve å ordne elementene alfabetisk og identifisere ethvert mønster. Meyers bord (1864). Den tyske forskeren L. Meyer arrangerte også de kjemiske elementene i rekkefølge etter økende atommasser: 
Men Meyer inkluderte bare 27 elementer i denne tabellen, det vil si mindre enn halvparten kjent på den tiden. Plasseringen av de gjenværende elementene: B, Al, Cu, Ag osv. forble uklar, og strukturen til tabellen var usikker.
Før D.I. Mendeleev ble det gjort rundt 50 forsøk på å klassifisere kjemiske elementer. De fleste forskere har forsøkt å identifisere forholdet mellom de kjemiske egenskapene til grunnstoffer og deres forbindelser og atommasse. Men det var ikke mulig å lage en klassifisering som inkluderte alle de kjemiske grunnstoffene som var kjent på den tiden. Ingen av forsøkene har ført til opprettelsen av et system som gjenspeiler sammenkoblingen av elementer og avslører naturen til deres likheter og forskjeller. Oppdagelsen av den periodiske loven og konstruksjonen av det periodiske systemet for kjemiske elementer er fortjenesten til den store russiske vitenskapsmannen D.I. Mendeleev.
I motsetning til verkene til hans forgjengere, hadde tabellen i det periodiske systemet for kjemiske elementer foreslått av D. I. Mendeleev en klar struktur i form av grupper og perioder (med rader), der det ikke bare var et sted for alle grunnstoffer kjent på det tidspunktet. tid, men ble igjen tomme seter for de som ennå ikke er åpne. D.I. Mendeleevs system gjorde det mulig ikke bare å forutsi eksistensen av ukjente elementer, men også å forutsi deres egenskaper og korrigere feil bestemte atommasser av allerede kjente elementer.
Kjemikerkongressen i Karlsruhe
Den tredje forutsetningen for oppdagelsen av den periodiske lov var vedtakene fra den internasjonale kjemikerkongressen i Karlsruhe i 1860, da den endelig ble etablert atom-molekylær vitenskap, ble de første enhetlige definisjonene av begrepene molekyl og atom, samt atomvekt, som vi nå kaller relativ atommasse (Ar), tatt i bruk. Det var dette konseptet, som en uforanderlig karakteristikk av atomene til kjemiske elementer, som D. I. Mendeleev baserte sin klassifisering. Han skrev: «Massen til et stoff er nettopp en slik egenskap ved det, som alle andre egenskaper bør avhenge av. Derfor er det nærmest eller mest naturlig å se etter en sammenheng mellom egenskapene og likhetene til grunnstoffene på den ene siden og deres atomvekter på den andre.»
Forgjengerne til D.I. Mendeleev sammenlignet bare lignende elementer med hverandre, og kunne derfor ikke oppdage Periodisk lov. I motsetning til dette oppdaget D.I. Mendeleev periodisitet i endringer i egenskapene til kjemiske elementer arrangert i økende rekkefølge av deres atommasser, og sammenlignet med hverandre alle grunnstoffene som er kjent for ham, inkludert forskjellige.
D.I. Mendeleev stolte i sin oppdagelse på klart formulerte utgangspunkter:
Den felles uforanderlige egenskapen til atomene til alle kjemiske elementer er deres atommasse;
Egenskapene til grunnstoffer avhenger av deres atommasser;
Formen for denne avhengigheten er periodisk.
Forutsetningene diskutert ovenfor kan kalles objektive, det vil si uavhengig av vitenskapsmannens personlighet, siden de ble bestemt historisk utvikling kjemi som vitenskap.
Men uten de personlige egenskapene til en stor kjemiker, som utgjør den fjerde, subjektive forutsetningen for oppdagelsen av den periodiske lov, er det usannsynlig at den ville blitt oppdaget i 1869. Hvis noen annen kjemiker hadde oppdaget det, ville det sannsynligvis ha skjedd mye senere. Kunnskapens encyklopediske natur, vitenskapelig intuisjon, evnen til å generalisere, det konstante ønsket om å forstå det ukjente, gaven til vitenskapelig framsyn til D. I. Mendeleev spilte en betydelig rolle i oppdagelsen av den periodiske loven.
Oppdagelsen av den periodiske loven av D. I. Mendeleev
D.I. Mendeleev baserte sitt arbeid på klassifiseringen av kjemiske elementer på deres to hoved- og konstante egenskaper: verdien av atommasse og egenskaper. Han skrev ned på kort all kjent informasjon om de kjemiske elementene og deres forbindelser som ble oppdaget og studert på den tiden. Ved å sammenligne denne informasjonen, kompilerte forskeren naturlige grupper av elementer med lignende egenskaper, en sammenligning av dem viste at selv elementer av forskjellige grupper har egenskaper som forener dem. For eksempel er atommassene av fluor og natrium, klor og kalium nær i verdi (inerte gasser var ennå ikke kjent), derfor kan alkalimetaller og halogener plasseres side om side, og ordne de kjemiske elementene i rekkefølge med økende atommasser . Så D.I. Mendeleev forente naturlige grupper av kjemiske elementer til et enkelt system.
Dmitry Ivanovich Mendeleev (1834-1907)
Stor russisk vitenskapsmann, en av grunnleggerne av moderne kjemi. Skaperen av den naturlige klassifiseringen av kjemiske elementer - det periodiske systemet for grunnstoffer, som var et uttrykk for den periodiske loven om kjemiske elementer. Han skapte et grunnleggende verk - læreboken "Fundamentals of Chemistry", der for første gang all uorganisk kjemi presenteres på grunnlag av den periodiske loven. Han er forfatteren kjemisk teori løsninger. I sine arbeider ga han mye oppmerksomhet til utviklingen av innenlandsk industri og kjemikalisering av landbruket.
D.I. Mendeleev argumenterte for behovet for å lage kjemisk produksjon: brus, svovelsyre, mineralgjødsel. Begrunnet ideene om underjordisk gassifisering av kull og bruk av oksygen i metallurgisk industri. Han foreslo en metode for kontinuerlig oljeraffinering, samt en original teori om opprinnelsen.
Samtidig oppdaget han at egenskapene til elementer endres lineært innenfor visse sett av elementer (monotonisk øke eller redusere), og deretter gjenta periodisk, det vil si etter at et visst antall elementer lignende elementer er påtruffet. Forskeren identifiserte perioder der egenskapene til kjemiske elementer og stoffene som dannes av dem naturlig endres. La oss se på disse endringene ved å bruke moderne termer.
1. De metalliske egenskapene til enkle stoffer, mest uttalt i alkalimetaller, svekkes og erstattes av ikke-metalliske egenskaper, som er mest uttalt i halogener.
2. Verdien av oksidasjonstilstanden til grunnstoffatomer i høyere oksider øker fra +1 til +7 (+8 kun for Os og Ru).
3. Verdien av oksidasjonstilstanden til atomer av grunnstoffer i hydrider (forbindelser av metaller med hydrogen) og i flyktige hydrogenforbindelser øker først fra +1 til +3 og deretter fra -4 til -1.
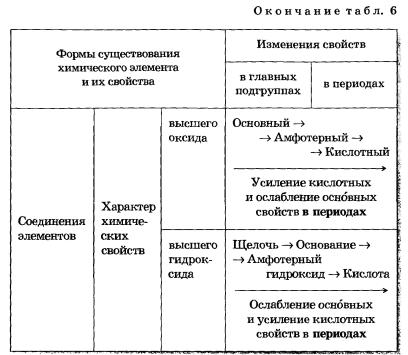
4. De grunnleggende oksidene av grunnstoffer i begynnelsen av perioden erstattes av et amfotert oksid og deretter med sure, hvis egenskaper blir sterkere.
5. Basehydroksider erstattes av stadig sterkere syrer gjennom amfotert hydroksid.
Basert på disse observasjonene formulerte D.I. Mendeleev den periodiske loven, som, i samsvar med nåværende akseptert terminologi, høres slik ut:
Egenskapene til kjemiske elementer og stoffene som dannes av dem er periodisk avhengig av deres relative atommasser.
For å illustrere denne loven brukte vi de betraktede periodisitetene (diskretitet, intermittens med visse intervaller) bare horisontalt. Imidlertid er den periodiske loven og det periodiske systemet mye rikere på periodiske mønstre: i tillegg til den betraktede horisontale (etter perioder) periodisiteten, er det også vertikal (etter grupper) og diagonal periodisitet.
Du er allerede godt kjent med vertikal periodisitet: i grupper (hovedundergrupper), når ordenstallene til elementer øker, øker de metalliske egenskapene til de enkle stoffene de danner og de ikke-metalliske egenskapene svekkes; den grunnleggende naturen til oksider og hydroksider er forbedret; styrken til flyktige hydrogenforbindelser reduseres og deres sure egenskaper øker tilsvarende.
Diagonal periodisitet refererer til repeterbarheten av likheter kjemiske egenskaper enkle stoffer og sammensetninger av grunnstoffer plassert diagonalt fra hverandre i det periodiske system.
Likheten i egenskaper mellom enkle stoffer og forbindelser dannet av kjemiske elementer anordnet diagonalt forklares av det faktum at økningen i ikke-metalliske egenskaper i perioder fra venstre til høyre tilnærmet balanseres av effekten av økende metalliske egenskaper i grupper fra topp til bunn .
For eksempel ligner metallet litium Li på magnesium på alle måter som gjør det forskjellig fra natrium Na. På samme måte ligner bor B mer på silisium enn aluminium Al. 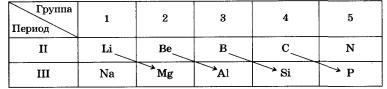
De vanlige kjemiske egenskapene til Li og Mg inkluderer deres evne til å antennes lett, ustabiliteten til deres nitrater og karbonater, og den lave løseligheten av fluorider, fosfater og silikater i vann.
Den diagonale likheten mellom Be og Al kommer til uttrykk i det faktum at begge metaller reagerer likt med syrer og alkalier, og deres oksider og hydroksyder er amfotere.
Bor og silisium danner lignende enkle stoffer som er inerte og ildfaste, mens oksider og hydroksyder er sure. Bor, som karbon og silisium, danner flyktige hydrogenforbindelser, lignende i produksjonsmetoder og egenskaper som hydrogensilika (silaner): B2H6, B4H10, etc.
Den diagonale periodisiteten til egenskapene til ikke-metaller karakteriseres best av den velkjente diagonalen B - Si- As - Te - At, som konvensjonelt deler grunnstoffer inn i metaller og ikke-metaller, eller diagonalen C - P - Se - I .
To diagonaler: Al - Ge - Sb og Zn - In - Pb - inkluderer elementer hvis oksider og hydroksyder har amfotere egenskaper.
Hvis du kombinerer horisontal, vertikal og diagonal periodisitet, kan du få "stjerneperiodisitet".
Det tok hensyn til alle typer periodisitet som gjorde det mulig for D.I. Mendeleev ikke bare å forutsi og beskrive egenskapene til stoffer dannet av ennå uoppdagede kjemiske elementer, men også å indikere måtene de ble oppdaget på, naturlige kilder (malm og forbindelser) som tilsvarende enkle stoffer kunne oppnås.
Periodisk lov og atomstruktur
Formuleringen av loven gitt av D.I. Mendeleev kunne ikke være nøyaktig og fullstendig fra et moderne synspunkt, siden den samsvarte med vitenskapens tilstand for den perioden da strukturen til atomet ikke var kjent. Derfor kom nye vitenskapelige funn i konflikt med den. Dermed ble isotoper oppdaget.
Isotoper - varianter av atomer av samme kjemiske element som har samme kjerneladning, men forskjellige massetall.
Summen av antall protoner og nøytroner i kjernen til et atom kalles massetallet og er betegnet med bokstaven A.
Det er åpenbart at isotopkjernene til ett kjemisk grunnstoff har samme antall protoner, men varierer i antall nøytroner de inneholder. Derfor,
kjemisk element- dette er en type atomer preget av samme kjerneladning, det vil si som inneholder samme antall protoner.
Isotoper er kjent for alle kjemiske grunnstoffer. I naturen eksisterer de fleste av dem i form av en blanding av isotoper. Den relative atommassen til et element er lik gjennomsnittet av de relative atommassene til alle dets naturlige isotoper, tatt i betraktning deres overflod.
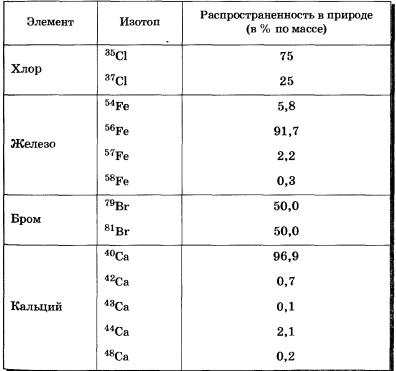
Data om isotoper til noen kjemiske grunnstoffer er gitt i tabell 5, deres masse og prosentandel i naturen (etter masse) er angitt.
I tabellen til det periodiske systemet, under symbolene for kjemiske elementer, er gjennomsnittsverdiene for deres relative atommasser gitt. De kan beregnes ved å kjenne massetallet til hver isotop og massefraksjon det i en naturlig blanding. Så,
A r (Cl) = 35 0,75 + 37 0,25 = 35,5
Tabell 5 Isotoper av noen kjemiske grunnstoffer
Tilstedeværelsen av isotoper beviser at egenskapene til kjemiske elementer bestemmes ikke så mye av deres atommasse, som D.I. Mendeleev antok, men av ladningen til atomkjerner. Dette forklarer posisjonen i det periodiske systemet til fire par elementer plassert i strid med prinsippet om økende relative atommasser:
18Ar (39.948) - 19K (39.102) 27Co (58.933) - 28N (58.71) 52Te (127.60) - 531 (126.904) 90Th (232.038) - 91)Pa (2)
Dette er geniet, manifestasjonen av den vitenskapelige intuisjonen til den store russiske kjemikeren, at han i de angitte tilfellene foretrakk å ordne elementene i henhold til likhet i egenskaper, spådde den sanne rekkefølgen av arrangement av kjemiske elementer i henhold til økende ladninger av deres atom. kjerner, selv om han ikke visste noe om strukturen til atomene deres.
For første gang ble den fysiske betydningen av atomnummeret avslørt av nederlenderen Van den Broek, som teoretisk beviste at atomnummeret til et kjemisk element er lik ladningen til kjernen til dets atom. Van den Broeks hypotese ble eksperimentelt bekreftet av engelskmannen G. Moseley.
Oppdagelsen av isotoper og Van den Broek-Moseley-loven gjorde det mulig å gi en annen moderne definisjon av den periodiske loven:
Egenskapene til kjemiske elementer og stoffene de danner periodisk avhenger av ladningene til deres atomkjerner.
Periodisk system for kjemiske elementer og atomstruktur
Det periodiske system for kjemiske elementer viser grafisk den periodiske loven. Hvert tall i det karakteriserer noen funksjoner i strukturen til atomer:
a) serienummeret (atom-) til et kjemisk element indikerer ladningen til atomkjernen, det vil si antall protoner som finnes i det, og siden atomet er elektrisk nøytralt, så antall elektroner som ligger rundt atomkjernen. Antall nøytroner bestemmes av formelen
N = A - Å
hvor A er massetallet, Z er atomnummeret til grunnstoffet;
b) periodetallet tilsvarer antall energinivåer (elektroniske lag) i atomene til elementer i en gitt periode;
c) gruppenummeret tilsvarer antall elektroner på ytre nivå for elementer i hovedundergruppene og maksimalt antall valenselektroner for elementer av sekundære undergrupper.
I lys av atomets struktur er det mulig å forklare årsakene til endringer i egenskapene til kjemiske elementer og stoffene som dannes av dem. I perioden med en økning i ladningene til atomkjernene til elementer (fra venstre til høyre), svekkes metalliske egenskaper, og ikke-metalliske egenskaper øker på grunn av det faktum at:
a) antall elektroner på det ytre nivået av atomet øker;
b) antall energinivåer i atomer innenfor en periode forblir konstant;
c) atomenes radius avtar.
I grupper ( hovedundergruppe) med økende ladninger av atomkjerner av elementer (fra topp til bunn), øker metalliske egenskaper, ikke-metalliske egenskaper svekkes. Dette er forklart av
Antall elektroner på det ytre nivået av atomene forblir det samme;
Antall energinivåer i et atom øker;
Radiusen til atomene øker.
I lange perioder skjer slike endringer langsommere, siden fra og med det tredje elementet, er ikke det ytre energinivået til atomer fullført, men det pre-eksterne energinivået fra 8 til 18 elektroner (for elementer i sideundergrupper), og bare deretter fylles det ytre nivået fra 2 til 8 elektroner (for elementer i hovedundergruppene).
I de "superstore" periodene (sjette og syvende, ufullstendig) skjer disse endringene enda langsommere, siden det i lantanider og aktinider ikke er det eksterne pre-eksterne nivået som fullføres, men det tredje nivået fra utsiden - fra 18 til 32 elektroner. Derfor vil egenskapene til disse elementene være så like egenskapene til elementene La og Ac, og også like hverandre. Dette forklares av det faktum at egenskapene til kjemiske elementer og stoffene de danner hovedsakelig avhenger av strukturen til det ytre energinivået til atomer, mindre av strukturen til det pre-eksterne, og nesten ikke avhenger av strukturen til atomene. interne nivåer.
Naturen til hvert kjemisk element, det vil si visse egenskaper til atomer, enkle stoffer og forbindelser som bare er iboende for det, avhenger først og fremst av ladningen til kjernen til dets atomer. Ladningen bestemmer også strukturen til atomets elektronskall. Men verdiene av ladningene til kjernene til atomer av kjemiske elementer i det periodiske systemet til D.I. Mendeleev endres monotont - de øker fra +1 for hydrogen til +110 for element nr. 110, derfor kan dette fenomenet ikke være en direkte årsak av den periodiske endringen i elementenes egenskaper.
Årsaken til periodisitet er en endring i strukturen til de ytre elektroniske lagene av atomer. I alle alkalimetaller er det ytre energinivået okkupert av ett elektron, og det er derfor egenskapene deres er så like. Men de er ikke de samme, graden av deres manifestasjon er forskjellig, fordi dette eneste ytre elektronet er lokalisert i forskjellige avstander fra kjernen i atomene til hvert alkalimetall:

Egenskapene til kjemiske elementer og stoffene dannet av dem er periodisk avhengig av strukturen til de ytre elektroniske lagene av atomer.
Mer fullstendig informasjon om de horisontale og vertikale avhengighetene til egenskapene til atomer, enkle stoffer og forbindelser dannet av kjemiske elementer er presentert i tabell 6.
Tabell 6 Endringer i egenskapene til atomer, enkle stoffer og forbindelser av kjemiske grunnstoffer

Betydningen av den periodiske loven og det periodiske systemet for kjemiske elementer av D. I. Mendeleev
D.I. Mendeleev skrev: «Før den periodiske lov representerte elementene bare fragmentariske tilfeldige naturfenomener; det var ingen grunn til å forvente noen nye, og de som ble funnet igjen var en fullstendig uventet nyhet. Det periodiske mønsteret var det første som gjorde det mulig å se ennå uoppdagede elementer på en avstand som synet uten hjelp av dette mønsteret ennå ikke hadde nådd."
Med oppdagelsen av den periodiske loven sluttet kjemi å være en beskrivende vitenskap - den fikk et verktøy for vitenskapelig framsyn. Denne loven og dens grafiske visning - tabellen i Periodic Table of Chemical Elements av D.I. Mendeleev - oppfylte alle de tre viktigste funksjonene til teoretisk kunnskap: generaliserende, forklarende og prediktiv. Basert på dem, forskere:
Systematisert og oppsummert all informasjon om kjemiske grunnstoffer og stoffene de danner;
Begrunnelse gitt forskjellige typer periodisk avhengighet som eksisterer i verden av kjemiske elementer, og forklarer dem på grunnlag av strukturen til atomene til elementene;
De spådde og beskrev egenskapene til ennå uoppdagede kjemiske elementer og stoffene som ble dannet av dem, og indikerte også måtene de ble oppdaget på.
D. I. Mendeleev måtte selv systematisere og generalisere informasjon om kjemiske grunnstoffer da han oppdaget den periodiske lov, bygget og forbedret tabellen hans. Dessuten skapte feil i verdiene til atommasser og tilstedeværelsen av elementer som ennå ikke var oppdaget ytterligere vanskeligheter. Men den store vitenskapsmannen var fast overbevist om sannheten i naturloven han oppdaget. Basert på likheten i egenskaper og troen på den riktige bestemmelsen av elementenes plass i tabellen til det periodiske systemet, endret han betydelig atommassene og valensen i forbindelser med oksygen av ti grunnstoffer akseptert på den tiden og "korrigerte" dem for ti andre. Han plasserte åtte elementer i tabellen, i motsetning til de allment aksepterte ideene på den tiden om deres likhet med andre. For eksempel ekskluderte han tallium fra den naturlige familien av alkalimetaller og plasserte det i den tredje gruppen i henhold til den høyeste valensen den viser; Han overførte beryllium med en feil bestemt atommasse (13) og valens III fra den tredje gruppen til den andre, og endret dens atommasse til 9 og den høyeste valensen til II.
De fleste forskere oppfattet D.I. Mendeleevs endringer som vitenskapelig lettsindighet og ubegrunnet frekkhet. Den periodiske loven og tabellen over kjemiske elementer ble betraktet som en hypotese, det vil si en antagelse som trenger verifisering. Forskeren forsto dette, og nettopp for å kontrollere riktigheten av loven og systemet av elementer han oppdaget, beskrev han i detalj egenskapene til elementer som ennå ikke var oppdaget og til og med metodene for oppdagelsen deres, basert på deres tiltenkte plass i systemet . Ved å bruke den første versjonen av tabellen kom han med fire spådommer (gallium, germanium, hafnium, scandium), og i henhold til den forbedrede, andre versjonen laget han syv til (technetium, rhenium, astatine, francium, radium, actinium, protactinium) .
For perioden 1869-1886. tre forutsagte grunnstoffer ble oppdaget: gallium (P.E. Lecoq de Boisbaudran, Frankrike, 1875), scandium (L.F. Nilsson, Sverige, 1879) og germanium (K. Winkler, Tyskland, 1886). Oppdagelsen av det første av disse elementene, som bekreftet riktigheten av den store russiske forskerens spådom, vakte bare interesse og overraskelse blant kollegene hans. Oppdagelsen av germanium var en sann triumf for den periodiske lov. K. Winkler skrev i artikkelen «Message on Germany»: «Det er ikke lenger noen tvil om at det nye elementet er ingen ringere enn eca-silisium forutsagt av Mendeleev femten år tidligere. For et mer overbevisende bevis på gyldigheten av læren om grunnstoffenes periodisitet kan neppe gis enn legemliggjørelsen av det hittil hypotetiske eca-silisium, og det representerer virkelig noe mer enn en enkel bekreftelse av en dristig fremsatt teori - det betyr en enestående utvidelse av det kjemiske synsfeltet, et mektig skritt i erkjennelsesfeltet."
Basert på loven og tabellen til D.I. Mendeleev ble edelgasser forutsagt og oppdaget. Og nå fungerer denne loven som en ledestjerne for oppdagelsen eller kunstig skapelse av nye kjemiske elementer. For eksempel kan man hevde at element #114 ville være blylignende (ekaslead) og #118 ville være en edelgass (ekaradon).
Oppdagelsen av den periodiske loven og opprettelsen av tabellen over det periodiske systemet av kjemiske elementer av D. I. Mendeleev stimulerte søket etter årsakene til sammenkoblingen av elementer, bidro til identifiseringen av den komplekse strukturen til atomet og utviklingen av atomet. læren om atomets struktur. Denne læren gjorde det på sin side mulig å avsløre den fysiske betydningen av den periodiske lov og forklare arrangementet av elementer i det periodiske system. Det førte til oppdagelsen av atomenergi og dens bruk for menneskelige behov.