Svekkelse av ikke-metalliske egenskaper. Metalliske egenskaper til kjemiske elementer
Det periodiske systemet til Dmitry Ivanovich Mendeleev er veldig praktisk og universelt i bruken. Fra det kan du bestemme noen egenskaper ved elementer, og det som er mest overraskende, forutsi noen egenskaper til fortsatt uoppdagede, ikke oppdaget av forskere, kjemiske elementer(for eksempel kjenner vi noen av egenskapene til det antatte unbihexiumet, selv om det ennå ikke er oppdaget eller syntetisert).
Disse egenskapene avhenger av elementets evne gi eller tiltrekke elektroner. Det er viktig å huske én regel: metaller gir fra seg elektroner, og ikke-metaller aksepterer dem. Følgelig er metalliske egenskaper evnen til et bestemt kjemisk element til å gi fra seg elektronene sine (fra utsiden elektronisk sky) til et annet kjemisk grunnstoff. For ikke-metaller er det motsatte tilfellet. Jo lettere et ikke-metall aksepterer elektroner, jo høyere er dets ikke-metalliske egenskaper.
Metaller vil aldri akseptere elektroner fra et annet kjemisk grunnstoff. Dette er typisk for følgende elementer;
- natrium;
- kalium;
- litium;
- Frankrike og så videre.
Situasjonen er lik med ikke-metaller. Fluor viser sine egenskaper mer enn alle andre ikke-metaller det kan bare tiltrekke seg partikler av et annet element til seg selv, men under ingen omstendigheter vil det gi opp sine egne. Den har de største ikke-metalliske egenskapene. Oksygen (i henhold til dets egenskaper) kommer umiddelbart etter fluor. Oksygen kan danne en forbindelse med fluor, som donerer elektronene, men det tar bort negative partikler fra andre grunnstoffer.
Liste over ikke-metaller med de mest uttalte egenskapene:
- fluor;
- oksygen;
- nitrogen;
- klor;
- brom.
Ikke-metalliske og metalliske egenskaper er forklart av det faktum at alle kjemikalier streber etter å fullføre energinivået. For å gjøre dette må det siste elektronnivået ha 8 elektroner. Fluoratomet har 7 elektroner i sitt siste elektronskall, og i et forsøk på å fullføre det tiltrekker det seg ett elektron til. Natriumatomet har ett elektron på det ytre skallet, for å få 8 er det lettere å gi det 1, og på siste nivå vil det være 8 negativt ladede partikler.
Edelgasser interagerer ikke med andre stoffer nettopp fordi deres energinivå er fullstendig, de trenger ikke å tiltrekke seg eller gi fra seg elektroner.

Hvordan metalliske egenskaper endres i det periodiske systemet
Mendeleevs periodiske system består av grupper og perioder. Periodene er ordnet horisontalt på en slik måte at den første perioden inkluderer: litium, beryllium, bor, karbon, nitrogen, oksygen og så videre. Kjemiske elementer er ordnet strengt i henhold til økende atomnummer.
Gruppene er arrangert vertikalt på en slik måte at den første gruppen inkluderer: litium, natrium, kalium, kobber, rubidium, sølv og så videre. Gruppenummeret indikerer antall negative partikler på det ytre nivået til et bestemt kjemisk element. Mens periodetallet angir antall elektronskyer.
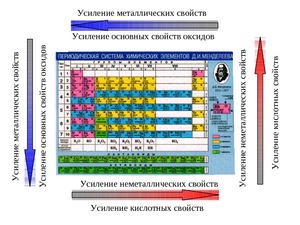
Metalliske egenskaper intensivere i serier fra høyre til venstre eller med andre ord svekke seg i perioden. Det vil si at magnesium har større metalliske egenskaper enn aluminium, men mindre enn natrium. Dette skjer fordi antallet elektroner i det ytre skallet øker i løpet av en periode, og derfor er det vanskeligere for det kjemiske elementet å gi fra seg elektronene sine.
I gruppen er alt omvendt, de metalliske egenskapene øker i rekken fra topp til bunn. For eksempel virker kalium sterkere enn kobber, men svakere enn natrium. Forklaringen på dette er veldig enkel: antall elektroniske skall, og jo lenger elektronet er fra kjernen, jo lettere er det for grunnstoffet å gi det fra seg. Tiltrekningskraften mellom kjernen til et atom og elektronet i det første skallet er større enn mellom kjernen og elektronet i det 4. skallet.
La oss sammenligne to grunnstoffer - kalsium og barium. Barium har en lavere verdi i det periodiske systemet enn kalsium. Dette betyr at elektroner med ytre skall kalsium er plassert nærmere kjernen, derfor tiltrekkes de bedre enn barium.
Det er vanskeligere å sammenligne elementer som er inne ulike grupper og perioder. Ta kalsium og rubidium, for eksempel. Rubidium vil avgi negative partikler bedre enn kalsium. Siden han står lavere og til venstre. Men ved å bare bruke det periodiske systemet, er det umulig å entydig svare på dette spørsmålet ved å sammenligne magnesium og scandium (siden ett element er lavere og til høyre, og det andre er høyere og til venstre). For å sammenligne disse elementene trenger du spesielle tabeller (for eksempel den elektrokjemiske serien av metallspenninger).
Hvordan endres ikke-metalliske egenskaper i det periodiske systemet?
Ikke-metalliske egenskaper i det periodiske systemet til Mendeleev endrer seg nøyaktig motsatt vei enn metalliske. I hovedsak er disse to egenskapene antagonister.
De intensiveres i perioden (på rad fra høyre til venstre). For eksempel kan svovel tiltrekke seg elektroner mindre enn klor, men mer enn fosfor. Forklaringen på dette fenomenet er den samme. Antallet negativt ladede partikler på det ytre laget øker, og derfor er det lettere for elementet å fullføre energinivået sitt.
Ikke-metalliske egenskaper reduseres fra topp til bunn (i en gruppe). For eksempel er fosfor i stand til å frigjøre negativt ladede partikler mer enn nitrogen, men samtidig er det i stand til å tiltrekke seg bedre enn arsen. Fosforpartikler tiltrekkes bedre til kjernen enn arsenikkpartikler, noe som gir den fordelen av et oksidasjonsmiddel i reaksjoner for å redusere og øke oksidasjonstilstanden (redoksreaksjoner).
Sammenlign for eksempel svovel og arsen. Svovel er høyere og til høyre, noe som betyr at det er lettere for det å fullføre energinivået. I likhet med metaller er ikke-metaller vanskelige å sammenligne hvis de er i forskjellige grupper og perioder. For eksempel klor og oksygen. Ett av disse elementene er høyere og til venstre, og det andre er lavere og til høyre. For å svare, må vi referere til tabellen over elektronegativitet til ikke-metaller, hvorfra vi ser at oksygen tiltrekker negative partikler lettere enn klor.

Mendeleevs periodiske system hjelper til med å finne ut ikke bare antall protoner i et atom, atommasse og atomnummer, men hjelper også med å bestemme egenskapene til grunnstoffer.
Video
Videoen vil hjelpe deg å forstå egenskapsmønstrene til kjemiske elementer og deres forbindelser etter perioder og grupper.
Fikk du ikke svar på spørsmålet ditt? Foreslå et emne til forfatterne.
Systematisert i form av et periodisk system. De aller fleste av dem er klassifisert som metaller, noe som innebærer at disse elementene har spesielle kvaliteter. Dette er de såkalte metalliske egenskapene. Slike egenskaper inkluderer først og fremst plastisitet, økt termisk og elektrisk ledningsevne, evnen til å danne legeringer og et lavt ioniseringspotensial.
De metalliske egenskapene til et element bestemmes av evnen til dets atomer, når de samhandler med atomstrukturene til andre elementer, til å forskyve elektronskyer i deres retning eller å "gi" sine frie elektroner til dem. De mest reaktive metallene er de som har lav elektronegativitet. Også uttalte metalliske egenskaper er karakteristiske for elementer som har den største atomradiusen og et ekstremt lite antall ytre

Når valensbanen er fylt, øker antallet elektroner i det ytre laget av atomstrukturen, og radiusen reduseres følgelig. I denne forbindelse begynner atomer å strebe etter å feste frie elektroner, og ikke gi dem bort. av slike elementer har en tendens til å avta, og deres ikke-metalliske egenskaper har en tendens til å øke. Og omvendt, med økende atomradius, observeres en økning i metalliske egenskaper. Derfor karakteristisk fellestrekk Alle metaller har såkalte reduserende egenskaper – selve evnen til et atom til å gi bort frie elektroner.
De metalliske egenskapene til elementer er tydeligst manifestert i stoffer i den første og andre gruppen av hovedundergruppene i det periodiske systemet, så vel som i alkaliske og alkaliske stoffer, men de sterkeste reduserende egenskapene observeres i francium og i et vandig miljø - i litium på grunn av sin høyere hydreringsenergi.

Antall grunnstoffer som viser metalliske egenskaper innenfor en periode øker med økende periodeantall. I det periodiske systemet skilles metaller fra ikke-metaller med en diagonal linje som går fra bor til astatin. Langs denne skillelinjen er elementer som viser begge kvalitetene likt. Slike stoffer inkluderer silisium, arsen, bor, germanium, astatin, antimon og tellur. Denne gruppen grunnstoffer kalles metalloider.
Hver periode er preget av tilstedeværelsen av en slags "grensesone" der elementer med doble kvaliteter befinner seg. Følgelig skjer overgangen fra et uttalt metall til et typisk ikke-metall gradvis, noe som gjenspeiles i det periodiske systemet.
De generelle egenskapene til metallelementer (høy formbarhet, karakteristisk glans, duktilitet, etc.) skyldes deres likhet indre struktur, eller rettere sagt, tilstedeværelsen av Imidlertid er det mange kvaliteter (tetthet, hardhet, smeltepunkt) som gir alle metaller deres rent individuelle fysiske- kjemiske egenskaper. Disse egenskapene avhenger av strukturen krystallgitter hvert spesifikt element.
Oppgaver A 2 (GIA 2012)
Ikke-metalliske egenskaper øker i serien: 1) N → P → As, 2) N → C → B, 3) N → O → F, 4) C → Si → Ge
Serienummeret til et kjemisk grunnstoff i det periodiske systemet til D.I. Mendeleev tilsvarer: 1) antall elektroner i atomet, 2) verdien av elementets høyeste valens for oksygen, 3) antall elektroner som mangler å fullføre. det ytre elektronlaget, 4) antall elektroniske lag i atomet.
De ikke-metalliske egenskapene til svovel er mer uttalt enn de ikke-metalliske egenskapene til: 1) selen, 2) fluor, 3) oksygen, 4) klor.
Gruppenummeret i D.I. Mendeleevs periodiske system for kjemiske grunnstoffer tilsvarer: 1) antall elektroner i et atom, 2) verdien av grunnstoffets høyeste valens for oksygen, 3) antall elektroner som mangler for å fullføre det ytre elektronlaget, 4) antall elektroniske lag i et atom.
I perioden med økende atomnummer av et kjemisk grunnstoff oppstår: 1) en reduksjon i ladning atomkjernen, 3) reduksjon i atomradius, 2) økning i metalliske egenskaper, 4) reduksjon i antall valenselektroner.
Periodenummeret i Periodic Table of Chemical Elements av D.I. Mendeleev er lik antallet: 1) antall elektroner i et atom, 2) antall elektroner i det ytre laget av atomer, 3) de manglende elektronene som skal fullføres. elektronlaget, 4) de fylte elektronlagene i et atom.
I undergrupper Periodesystemet med en økning i ladningen til atomkjernen, skjer følgende: 1) en økning i de ikke-metalliske egenskapene til grunnstoffer, 3) en økning i atomets radius, 2) en reduksjon i antall protoner i kjernen, 4) en økning i elektronegativitet.
De sure egenskapene til høyere oksider svekkes i serien: 1) P 2 O 5 → SiO 2 → Al 2 O 3, 2) P 2 O 5 → SO 3 → Cl 2 O 7, 3) Al 2 O 3 → P 2 O 5 → N 2 O 5, 4) SiO 2 → P 2 O 5 → SO 3.
I hovedundergruppene av det periodiske system, med økende ladning av kjernen av atomer av kjemiske elementer: 1) ikke-metalliske egenskaper øker, 2) metalliske egenskaper reduseres, 3) valens i hydrogenforbindelser endres, 4) den høyeste valensen forblir konstant .
Amfoterisk er det høyeste oksidet av hvert av de kjemiske elementene med serienumre i det periodiske systemet til D.I. Mendeleev: 1) 4, 13, 30, 2) 6, 11, 16, 3) 19, 12, 3, 4) 6, 14, 17.
I hvilken rekke kjemiske elementer er ikke-metalliske egenskaper forbedret?
deres tilsvarende enkle stoffer?
1) aluminium → fosfor → klor 3) klor → brom → jod
2) fluor → nitrogen → karbon 4) silisium → svovel → fosfor
I hvilke serier er de kjemiske grunnstoffene ordnet etter intensivering? ikke-metalliske egenskaper? 1) O → S → Se 2) Si → P → S 3) S → P → Si 4) O → N → C
I hvilke serier er de kjemiske elementene ordnet i rekkefølge etter økende metalliske egenskaper? 1) Li → Be → B 2) Li → Na → K 3) Mg → Al → Si 4) Ca → Mg → Be
I hvilke serier er de kjemiske elementene ordnet i rekkefølge etter avtagende atomradius? 1) P → S → Cl 2) A → O → N 3) Be → Mg → Ca 4) Li → Na → K
I rekken av oksider MgO → Al 2 O 3 → SiO 2 varierer egenskapene fra: 1) basisk til amfoter og sur, 3) sur til amfoter, 2) sur til basisk, 4) basisk til amfoter.
I rekken av hydroksyder H 2 SiO 3 → H 3 PO 4 → H 2 SO 4 1) syrer blir svakere, 3) amfotere egenskaper øker, 2) syrer blir sterkere, 4) sure og basiske egenskaper endres ikke.
I rekken av hydroksyder Mg(OH) 2 → Ca(OH) 2 → Sr(OH) 2: 1) blir basene svakere, 3) de amfotere egenskapene øker, 2) basene blir sterkere, 4) de grunnleggende egenskapene gjør det ikke endre seg.
I hvilken rad er elementene ordnet i rekkefølge etter avtagende ikke-metalliske egenskaper? 1) B → C → N, 2) Se → S → O, 3) F → Cl → Br, 4) Na → Mg → Al
I hvilken rad er elementene ordnet i rekkefølge etter økende antall valenselektroner? 1) P → S → Cl, 2) Na → K → Rb, 3) O → N → C, 4) C → Si → Ge
De mest uttalte metalliske egenskapene er: 1) Na, 2) Li, 3) Rb, 4) Mg.
Med en økning i ladningene til kjernene til Ca → Sr → Ba-atomene, svekkes metallegenskapene: 1) svekkes, 2) endres ikke, 3) endres periodisk, 4) øker.
Den minste radiusen til et atom er: 1) barium, 2) kalsium, 3) magnesium, 4) strontium.
Velg de generelle formlene som tilsvarer det høyere nitrogenoksidet og hydroksydet: 1) R 2 O 5, RH 3, 2) R 3 O 3, HRO 3, 3) R 2 O 5, HRO 2, 4) R 2 O 5, HRO 3.
Velg generelle formler som tilsvarer høyere oksid og flyktig hydrogenforbindelse silisium: 1) RO 2, H 2 RO 3, 2) RO, RH 4, 3) RO 2, RH 4, 4) RO 3, RH 3.
I serien av grunnstoffer Na → Mg → Al → Si, henholdsvis de metalliske egenskapene og atomradius: 1) svekke og redusere, 3) svekke og øke, 2) øke og øke, 4) øke og redusere.
I serien av elementer Na → Mg → Al → Si: 1) metalliske egenskaper øker, 3) egenskaper endres ikke, 2) ikke-metalliske egenskaper øker, 4) metalliske og ikke-metalliske egenskaper endres periodisk.
I hovedundergruppene av det periodiske systemet for kjemiske elementer, med økende kjerneladninger, er radiusen til atomer: 1) øker, 2) avtar, 3) endres ikke, 4) endres med jevne mellomrom.
Atomradiusreduksjon i rekken: 1) Li → Na → K, 2) F → O → N, 3) Li → Be → B, 4) F → Cl → Br.
De sure egenskapene til oksider øker i rekkefølgen: 1) P → S → Cl, 2) C → Si → Ge, 3) P → Si → Al, 4) C → N → P.
Ikke-metalliske egenskaper øker i serien: 1) C → N → P, 2) P → S → O, 3) Cl → S → P, 4) Cl → F → O.
Atomet med minste radius er: 1) F, 2) Cl, 3) O, 4) S.
Hovedegenskapene er mest uttalt i oksidet:
natrium 2) kalium 3) magnesium 4) beryllium
Den sterkeste grunnen er:
NaOH 2) RbOH 3) KOH 4) LiOH
Når atomnummeret til et grunnstoff øker, endres de kjemiske egenskapene til oksidene i følgende rekkefølge:
Basisk, amfoter, sur 3) sur, amfoter, basisk
Amfoter, sur, basisk 4) basisk, sur, amfoter
Elektronegativiteten til elementer øker i serien:
F, Cl, Br 2) Na, K, Rb 3) Be, Mg, Ca 4) P, S, Cl
Elektronegativiteten til elementer avtar i serien:
N, P, As 2) N, O, F 3) Li, Be, B 4) Se, S, O
I den tredje perioden, med en økning i atomnummeret av elementer, endres de kjemiske egenskapene til hydroksyder som tilsvarer den høyeste oksidasjonstilstanden tilsvarende:
Base, amfotert hydroksyd, syre 3) syre, amfotert hydroksyd, base
Amfotert hydroksid, base, syre 4) base, syre, amfotert hydroksid
I serien Mg – Ca – Sr – Ba
antall fylte energinivåer i atomer øker
elektronegativiteten øker 3) endringer fysisk tilstand enkle stoffer
svekke de metalliske egenskapene til elementer
I serien F – Cl – Br – I
atomets radius avtar 3) de ikke-metalliske egenskapene til grunnstoffene øker
elektronegativitet øker 4) antall fylte energinivåer i atomer øker
I serien Li – Na – K – Rb
aggregeringstilstanden til enkle stoffer endres 3) ladningen til ionet endres
elektronegativiteten øker 4) de metalliske egenskapene til elementene øker
I serien Si – P – S – Cl
radiusen til atomet øker
aggregeringstilstanden for enkle stoffer er den samme under normale forhold
elektronegativiteten øker 4) metalliske egenskaper øker
Metalliske egenskaper til elementer:
De øker i en periode fra venstre til høyre 3) de endrer seg ikke-monotont i en periode
De øker i gruppen fra topp til bunn 4) er bare karakteristiske for alkaliske elementer
Blant alle elementene i den tredje perioden har elementet klor:
de mest uttalte metalliske egenskapene 3) den høyeste elektronegativiteten
den største atommassen 4) den mest stor radius atom
Blant alle elementene i den tredje perioden har elementet natrium:
høyeste elektronegativitet 3) minste atomradius
de mest uttalte metalliske egenskapene 4) den høyeste tettheten
Blant alle elementene i hovedundergruppen til gruppe II har elementet beryllium:
de mest uttalte metalliske egenskapene 3) den største atommassen
minste atomradius 4) laveste elektronegativitet
Blant alle elementene i hovedundergruppen til gruppe IV har elementet bly:
den største atomradiusen 3) de minst uttalte metalliske egenskapene
høyeste valens 4) høyeste elektronegativitet
Syreegenskaper i serien med høyere oksider av karbon - silisium - fosfor:
Syreegenskaper i serien av høyere hydroksyder av svovel – klor – jod:
øke 2) redusere 3) først øke, deretter redusere 4) først redusere, så øke
Surhet av oksider dannet av gruppe IV-elementer, fra topp til bunn:
Endres ikke 2) endres med jevne mellomrom 3) øker 4) avtar
Syreegenskaper i serien med høyere oksider av bor - karbon - silisium:
øke 2) redusere 3) først øke, deretter redusere 4) først redusere, så øke
I hvilke serier er stoffer ordnet i rekkefølge etter økende metalliske egenskaper?
Na, Mg, Al 2) Mg, Ca, Sr 3) Rb, Ca, Na 4) Ca, Mg, Be
I hvilken rad? enkle stoffer ordnet i rekkefølge etter avtagende metalliske egenskaper?
Sr, Ba, Ca 2) Na, K, Rb 3) Mg, Ca, Sr 4) Al, Mg, Na
Med økende atomnummer av et element, ikke-metalliske egenskaper:
intensivere 2) svekke 3) ikke endre 4) endre periodisk
Reduserende egenskaper til metaller i hovedundergruppen med økende atomnummer av elementet:
redusere 2) ikke endre 3) øke 4) først øke, deretter redusere.
Elektronegativitet i serien Na – Mg – Al
endres ikke 2) minker 3) øker 4) minker først, så øker.
Ikke-metalliske (oksiderende) egenskaper anses å være metoden -
evnen til nøytrale atomer av elementer til å få flere elektroner. Drivkraften bak denne prosessen er også atomenes ønske om å tilegne seg den mest stabile åtte-elektronkonfigurasjonen av edelgasser. Den største tendensen til å få elektroner er for atomer av elementer som har relativt et stort antall egne valenselektroner.
Elektronaffinitetsenergi(angitt med bokstaven A fra "a ffinitet" - "affinitet") er energien som frigjøres i prosessen med å feste et elektron til et nøytralt atom. I dette tilfellet blir atomet til et negativt ladet ion. Elektronaffinitetsenergi måles i kJ/mol (verdiene er negative, noe som tilsvarer en eksoterm prosess) og karakteriserer i hvilken grad elementer viser ikke-metalliske egenskaper.
I perioden med D.I. Mendeleev-systemet øker antallet valenselektroner og den effektive ladningen til kjernen med økende atomnummer, som er ledsaget av en økende tendens til manifestasjon av ikke-metalliske egenskaper og følgelig en økning i energi av elektronaffinitet. Halogenene, elementer av undergruppe VIIA, er preget av den høyeste elektronaffiniteten.
I en undergruppe av et system av elementer, når atomnummeret øker, svekkes de ikke-metalliske egenskapene til elementene. Følgelig avtar elektronaffinitetsenergien.
Dette forklares med at i samme retning øker antallet energinivåer og radiusen til atomene øker. Men nå snakker vi om tilsetning av et elektron til et atom, som oppstår som et resultat av tiltrekningen av dette elektronet av en positivt ladet kjerne. Hvis en atomkjerne er skjermet av mange elektronlag av sitt eget atom, er kraften til dens tiltrekning mot et elektron som kommer utenfra liten sammenlignet med en kjerne omgitt av et lite antall av sine egne elektronlag.
For eksempel er halogenatomer karakterisert ved valenskonfigurasjonen s2 p5. Alle av dem er de mest reaktive ikke-metallene i tabellen over elementer. Avhengig av tilhørigheten til hver av dem til en bestemt periode, er de syv valenselektronene til disse atomene på følgende energinivåer:
2s2 p5 | periode), |
||||
3s2 p5 | periode), |
||||
4s2 p5 | periode), |
||||
5s2 p5 | periode), |
||||
6s2 p5 | periode). |
Atomkjernen til grunnstoffet astatin er skjermet av seks elektronlag, mens kjernen til fluoratomet, som har den minste atomradiusen blant halogenene, er skjermet av kun to elektronlag. Av denne grunn er evnen til kjernen til et fluoratom til å tiltrekke seg et ekstra elektron (halogenatomer mangler bare ett elektron for å nå skallet med åtte elektroner til en edelgass) betydelig høyere enn kjernen til et astatinatom.
Fluor er det mest aktive ikke-metallet blant elementene i D.I. Mendeleevs system. Den teoretiske forutsigelsen antyder at den har den høyeste elektronaffiniteten. Imidlertid gir den eksperimentelle bestemmelsen av elektronaffinitetsenergien en verdi som ligger mellom de tilsvarende verdiene for klor og brom: AF = –328 kJ/mol, ACl = –349 kJ/mol, ABr = –325 kJ/mol. Årsakene til dette fenomenet krever en mer detaljert vurdering, som ligger utenfor denne publikasjonens omfang.
2.5.3. Elektronegativitet
Hvis ioniseringsenergien karakteriserer prosessen med å donere et elektron av et atom, og elektronaffinitetsenergien karakteriserer prosessen med å legge til et elektron til et nøytralt atom, så spiller elektronegativitet rollen som en slags likeverdig
virker, bestemmer den mellomliggende tendensen - tendensen til å skifte elektrontettheten fra ett atom til et annet.
Elektronegativitet er betegnet med symbolet EN (fra e lectron egativity) eller EO (i den russiske versjonen) og måles i samme enheter som ioniseringsenergi og elektronaffinitetsenergi - i kJ/mol.
Elektronegativitet er ikke strengt definert fysisk mengde, men kan betraktes som en viss betinget egenskap som gjør det mulig å gjøre vellykkede spådommer, for eksempel innen naturfeltet kjemisk binding mellom atomer. Hvis ioniseringsenergi og elektronaffinitetsenergi er kjennetegn ved isolerte atomer, er elektronegativitet en egenskap ved atomer som bare manifesterer seg i prosessen med interaksjon mellom dem.
Begrepet elektronegativitet ble først introdusert av Linus Pauling. Det finnes flere elektronegativitetsskalaer for elementer, basert på forskjellige eksperimentelle eller beregnede data. For eksempel er Mulliken-skalaen basert på å bruke gjennomsnittet av ioniseringsenergi og elektronaffinitetsenergi:
EO = I + 2 A.
Vedlegg 3 inneholder en av de vanligste skalaene for elektronegativitet til grunnstoffer ifølge L. Pauling.
Ved å ta hensyn til analysen ovenfor av endringer i ioniseringsenergi og elektronaffinitetsenergi etter perioder og grupper av D.I. Mendeleevs tabell, kan vi konkludere med at elektronegativiteten til s- og p-elementer øker i en periode og avtar i en undergruppe med økende atomnummer. av elementer. Grunnstoffet francium (teoretisk) og cesium (0,9) er karakterisert ved den laveste elektronegativiteten grunnstoffet fluor (4,1) er karakterisert ved den høyeste.
Elektronegativiteten til overgangselementer endres ikke så betydelig, men økningen med økende atomnummer i perioden er ganske tydelig synlig.
2.5.4. Atomradius
Atomiske og ioniske radier bestemmer de geometriske dimensjonene til atomer og ioner, som har en betydelig innvirkning på mange egenskaper til både elementene selv og deres forbindelser. Disse parameterne endres med jevne mellomrom avhengig av elementets serienummer.
Atomradius er en relativ verdi, fordi Det er umulig å avgrense de eksakte grensene til elektronskyen. Et atom er strengt tatt ikke en kule med et klart definert overflateareal og radius. Elektrontettheten er null bare i en uendelig avstand fra kjernen. Dimensjonene til et atom identifiseres vanligvis med dimensjonene til en kule, innenfor hvilken 90–99% av elektrontettheten er konsentrert. Forsøksgrunnlag for beregning atomradier tjener til å bestemme interatomære avstander i krystaller eller gasser. Avhengig av krystallens natur (metallisk, ionisk), metallisk eller ioniske radier. Målinger i gasser gjør det mulig å estimere kovalent radius. Slike eksperimenter utføres ved bruk av røntgendiffraksjonsanalyse eller elektrondiffraksjon. Radiusen til et atom antas å være halvparten av den minste indre nukleære avstanden mellom identiske atomer.
I perioden med økende atomnummer reduseres atomradier som regel (det er unntak! I gruppen, tvert imot, øker de.
En reduksjon i atomradiusene til elementer i samme periode kan forklares med en økning i den effektive ladningen til kjernen mot bakgrunnen av et konstant antall elektroniske lag. Tiltrekningskreftene mellom kjernen og elektronene begynner å spille en dominerende rolle sammenlignet med frastøtende krefter mellom elektronene. Nedgangen i radiene til atomene til 4f-elementer (lantanider) og 5f-elementer (aktinider) med en økning i atomnummer kalles
deretter lantanid aktinid kompresjon.












