การกำหนดคุณภาพและปริมาณ วรรค 2 สูตรทางเคมี การวิเคราะห์เชิงคุณภาพของ antroglycosides
J. Berzelius เสนอให้ระบุองค์ประกอบทางเคมีด้วยอักษรตัวแรกของชื่อละตินของพวกเขา ดังนั้นอักษรตัวแรกของชื่อละตินจึงกลายเป็นสัญลักษณ์ของออกซิเจน: อ็อกซิเจน - โอ (อ่าน "o" เนื่องจากชื่อละตินของธาตุนี้คืออ็อกซิเจน) ดังนั้นไฮโดรเจนจึงได้รับสัญลักษณ์ - H (อ่าน "ขี้เถ้า" เนื่องจากชื่อละตินของธาตุนี้คือ hydrogenium), คาร์บอน - C (อ่าน "tse" เนื่องจากชื่อละตินของธาตุนี้คือ carboneum) แต่ชื่อละตินสำหรับโครเมียม (โครเมียม), คลอรีน (คลอรัม) และทองแดง (คิวรัม) เช่นเดียวกับคาร์บอนเริ่มต้นด้วยตัวอักษร "C" เป็นอย่างไร Y. Ya. Bertselius เสนอวิธีแก้ปัญหาที่ยอดเยี่ยม: เขียนตัวอักษรดังกล่าวไม่ได้อยู่ในตัวอักษรเดียว แต่เขียนด้วยตัวอักษรสองตัว - ตัวอักษรตัวแรกและตัวอักษรตัวต่อมามักเป็นตัวที่สอง ดังนั้นโครเมียมจึงกำหนดให้โครเมียม (อ่านว่า "โครเมียม"), คลอรีน - C1 (อ่านว่า "คลอรีน"), ทองแดง - Cu (อ่าน "คิวรัม")
ปฏิกิริยาของการบ่งชี้ฮาโลเจนก็คือปฏิกิริยากับซิลเวอร์ไนเตรต เพื่อบ่งบอกถึงการมีอยู่ของฮาโลเจนจะเกิดเฮไลด์เฮไลด์สีขาวหรือสีเหลือง เพื่อระบุแต่ละอะตอมของฮาโลเจนตะกอนที่เกิดขึ้นจะได้รับการบำบัดด้วยสารละลายแอมโมเนียมไฮดรอกไซด์และทำการสังเกตต่อไปนี้
หากการตกตะกอนเป็นสีขาวและละลายในแอมโมเนียมไฮดรอกไซเล็กน้อยสารจะมีคลอรีน หากการตกตะกอนเป็นสีขาวและสีเหลืองและละลายได้มากขึ้นในแอมโมเนียมไฮดรอกไซด์ก็จะมีโบรมีน หากการตกตะกอนเป็นสีเหลืองและไม่ละลายในแอมโมเนียมไฮดรอกไซด์จะมีไอโอดีน
ชื่อรัสเซียและละตินเครื่องหมายขององค์ประกอบทางเคมียี่สิบรายการที่ใช้มากที่สุดในโรงเรียนและการออกเสียงของพวกเขาได้รับในตารางที่ 2
ตารางที่ 2
ชื่อและสัญลักษณ์ขององค์ประกอบทางเคมีบางอย่าง
ในตารางของเรามีองค์ประกอบเพียง 20 อย่างเท่านั้น หากต้องการดูองค์ประกอบทั้งหมด 110 รายการที่รู้จักในวันนี้คุณต้องอ้างถึงตารางองค์ประกอบทางเคมีของ DI Mendeleev
การจำแนกฮาโลเจนในองค์ประกอบของสารอินทรีย์ของพืช สารสำคัญ: acidoazate เข้มข้น; ซิลเวอร์ไนเตรท, สารละลาย 2%; คื่นฉ่ายแห้งหรือใบเฟิร์น ประสบการณ์: กระจายคื่นฉ่ายแห้งหรือเฟิร์นในเบ้าหลอม ด้วยเถ้าที่เกิดขึ้นทำการสกัดน้ำแยกออกจากกระดาษกรอง หากจำเป็นให้ทำซ้ำการดำเนินการตัวกรองบนตัวกรองเดียวกันจนกว่าจะได้รับของเหลวใส ใช้หลอดสะอาด 1-2 มล. จากของเหลวที่กรองแล้วและทำให้เป็นกรดด้วยกรดไนตริกเข้มข้นเพียงไม่กี่หยด
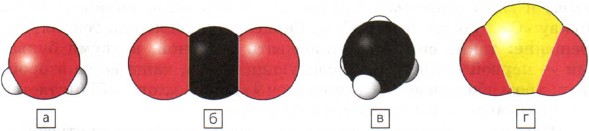
บ่อยครั้งที่องค์ประกอบของสารประกอบด้วยอะตอมขององค์ประกอบทางเคมีหลายอย่าง เป็นไปได้ที่จะอธิบายถึงอนุภาคที่เล็กที่สุดของสารตัวอย่างเช่นโมเลกุลด้วยความช่วยเหลือของแบบจำลองลูกบอลดังที่คุณทำในบทเรียนก่อนหน้านี้ รูปที่ 40 แสดงแบบจำลองปริมาตรของโมเลกุลน้ำ (a), คาร์บอนไดออกไซด์ (b), มีเธน (c) และซัลเฟอร์ไดออกไซด์ (g)
ลงในส่วนผสมนั้นเติมสารละลายซิลเวอร์ไนเตรต 2 - 3 หยด การปรากฏตัวของตะกอนสีขาวของซิลเวอร์คลอไรด์เป็นการระบุว่ามีคลอรีนตามปฏิกิริยา การวิเคราะห์สารเคมีอินทรีย์ให้วิธีการในการกำหนดระดับการปนเปื้อนดังนั้นจึงมีมาตรการป้องกัน สารกำจัดศัตรูพืชบางชนิดที่ย่อยสลายยากสามารถสะสมในดินได้จากที่พวกมันสามารถเข้าไปในพืชเช่นมันฝรั่งหรือแครอท
ในกระทะ analytes จะถูกสกัดจากมันฝรั่งหรือแครอทเมื่อประมวลผลด้วย hexane ปกติ แยกสารละลายด้วยการแยกออกจากกันเพิ่มโพแทสเซียมไฮดรอกไซด์เล็กน้อยสารละลายแอลกอฮอล์ธรรมดา ระเหยในอ่างน้ำจนแห้ง หลังจากไฮโดรไลซิสสารตกค้างแห้งจะถูกละลายในคาร์บอนเตตระคลอไรด์เพียงไม่กี่หยด ผสมและเขย่าด้วย 2 มล. ของส่วนผสมของกรดไนตริกและกรดซัลฟูริก
มะเดื่อ 40
แบบจำลองจำนวนมากของโมเลกุล:
- น้ำ b - คาร์บอนไดออกไซด์ มีเธน g - ซัลเฟอร์ไดออกไซด์
ด้วยความช่วยเหลือของสัญลักษณ์ขององค์ประกอบทางเคมีและดัชนีสูตรทางเคมีของสารที่เขียน ดัชนีแสดงจำนวนอะตอมขององค์ประกอบนี้ที่เป็นส่วนหนึ่งของโมเลกุลสาร มันเขียนไว้ที่มุมล่างขวาของเครื่องหมาย องค์ประกอบทางเคมี. ตัวอย่างเช่นสูตรของสารที่แสดงในรูปที่ 40 ถูกเขียนดังนี้: a - H 2 O; b - CO 2; c - CH 4; g - SO 2
การวิเคราะห์เชิงปริมาณเบื้องต้น
สีเขียวปรากฏเป็นคำใบ้ การวิเคราะห์เชิงปริมาณเบื้องต้นกำหนดเปอร์เซ็นต์ขององค์ประกอบต่าง ๆ ของอินทรียวัตถุ องค์ประกอบที่ได้จากการแยกสารสามารถเป็นปริมาตรหรือ gravimetric ปริมาณซึ่งเป็นเรื่องของวิธีการเบื้องต้นของการวิเคราะห์เชิงปริมาณ
ความมุ่งมั่นของฮาโลเจนจำเป็นต้องมีการสลายตัวของอินทรียวัตถุในการจัดหาอิออนฮาโลเจนและจากนั้นการใช้ยาด้วย gravimetric หรือไนเตรทสีเงินจำนวนมาก ในเรื่องนี้มีหลายวิธีในการกำหนด ในกรณีของสารประกอบอินทรีย์ระเหยได้จะพิจารณาฮาโลเจนด้วยวิธี Carius วิธีที่ง่ายที่สุดและง่ายที่สุดสำหรับการกำหนดฮาโลเจนคือวิธี Stepanov การบ่งชี้ฮาโลเจนโดยตรงจากสารอินทรีย์โดยวิธีสเตฟอฟมีดังต่อไปนี้
สูตรทางเคมีเป็นรูปแบบสัญญาณหลักในวิทยาศาสตร์ของเรา เธอมีข้อมูลที่สำคัญมาก สูตรทางเคมีแสดงให้เห็นว่า:
องค์ประกอบเชิงคุณภาพ สารคืออะตอมของธาตุที่เป็นส่วนหนึ่งของสาร
องค์ประกอบเชิงปริมาณนั่นคือจำนวนอะตอมของแต่ละองค์ประกอบเป็นส่วนหนึ่งของโมเลกุลสาร
ตามสูตรของสารก็เป็นไปได้ที่จะตรวจสอบว่ามันง่ายหรือซับซ้อน
ตัวอย่างเช่นไฮโดรเจน H 2, เหล็ก Fe, ออกซิเจน O 2 เป็นสารง่าย ๆ และน้ำ H 2 O, คาร์บอนไดออกไซด์ CO 2 และกรดซัลฟูริก H 2 SO 4 นั้นซับซ้อน
คำถามและภารกิจ
- องค์ประกอบทางเคมีใดบ้างที่ประกอบด้วยตัวอักษร C เขียนลงแล้วพูด
- จากตารางที่ 2 เขียนแยกสัญญาณขององค์ประกอบโลหะและสัญญาณขององค์ประกอบที่ไม่ใช่โลหะ พูดชื่อของพวกเขา
- สูตรเคมีคืออะไร เขียนสูตรของสารต่อไปนี้:
- ก) กรดซัลฟิวริกหากเป็นที่ทราบกันว่าองค์ประกอบของโมเลกุลประกอบด้วยอะตอมไฮโดรเจนสองอะตอมอะตอมกำมะถันหนึ่งอะตอมและออกซิเจนสี่อะตอม
- b) ไฮโดรเจนซัลไฟด์โมเลกุลประกอบด้วยอะตอมไฮโดรเจนสองอะตอมและอะตอมกำมะถันหนึ่งอะตอม
- c) ซัลเฟอร์ไดออกไซด์ซึ่งโมเลกุลประกอบด้วยหนึ่งอะตอมกำมะถันและอะตอมออกซิเจนสองอะตอม
สารเหล่านี้รวมตัวกันคืออะไร?
- สร้างแบบจำลองปริมาณของโมเลกุลต่อไปนี้จากดินน้ำมัน:
- ก) แอมโมเนียโมเลกุลที่บรรจุอะตอมไนโตรเจนหนึ่งอะตอมและไฮโดรเจนสามอะตอมจัดเรียงอะตอมไฮโดรเจนเมื่อเทียบกับอะตอมไนโตรเจนที่มุม 110 °;
- b) ไฮโดรเจนคลอไรด์โมเลกุลที่ประกอบด้วยอะตอมไฮโดรเจนหนึ่งและอะตอมคลอรีนหนึ่ง
- c) คลอรีนโมเลกุลที่ประกอบด้วยอะตอมของคลอรีนสองตัว
เขียนสูตรของสารเหล่านี้และอ่าน
- รูปที่ 40 แสดงแบบจำลองโมเลกุลสี่แบบ สารเคมี. สารเหล่านี้มีองค์ประกอบทางเคมีกี่รูปแบบ? ตั้งชื่อพวกเขาเขียนอักขระขององค์ประกอบเหล่านี้แล้วพูดออกมา
- ใช้ดินน้ำมันสี่สี ม้วนลูกบอลที่เล็กที่สุด สีขาว - เหล่านี้คือแบบจำลองของอะตอมไฮโดรเจนลูกบอลสีแดงที่ใหญ่กว่า - แบบจำลองของอะตอมออกซิเจนลูกบอลสีดำ - แบบจำลองของอะตอมคาร์บอนและในที่สุดลูกบอลสีเหลืองที่ใหญ่ที่สุด - เป็นแบบจำลองของอะตอมกำมะถัน สร้างแบบจำลองปริมาตรของโมเลกุลที่แสดงในรูปที่ 40
สถาบันการศึกษาของรัฐ ROSZHELDOR
การศึกษาระดับมืออาชีพที่สูงขึ้น "Rostov State University of Communications"
เคมีทั่วไป
คู่มือการศึกษาด้วยตนเอง
งานนักเรียน
ได้รับการอนุมัติจากสภาวิธีการของมหาวิทยาลัย
Rostov-on-Don
UDC 541 (07) + 06
เคมีทั่วไป: คู่มือสำหรับงานอิสระของนักเรียน / Yu.F. Migal, S.B. Bulgarievich, V.N Doronkin [et al.]; การเจริญเติบโต รัฐ วิธีการสื่อสารที่ไม่ได้ใช้ - Rostov n / a, 2010 - 191 p บรรณานุกรม : 11 ชื่อเรื่อง
มีข้อมูลเกี่ยวกับส่วนหลักของหลักสูตรเคมีทั่วไป: คลาสของสารประกอบอนินทรีย์, อุณหพลศาสตร์เคมี, อัตราการเกิดปฏิกิริยาเคมี, สมดุลเคมี, โครงสร้างของสาร, สารละลาย, ปฏิกิริยารีดอกซ์, ไฟฟ้า, พอลิเมอร์ ตัวอย่างได้รับการแก้ไขปัญหาทั่วไปปัญหาของธรรมชาติที่นำไปใช้ในหัวข้อทางรถไฟไดอะแกรมแสดงการเชื่อมต่อทางตรรกะของแนวคิดทางเคมีและวรรณคดีที่แนะนำ
คู่มือได้รับการอนุมัติให้ตีพิมพ์โดยกรมเคมีของ RSTU และมีไว้สำหรับนักเรียนหลักสูตรที่ 1 ของความเชี่ยวชาญพิเศษทั้งหมด
ผู้ตรวจสอบ: ดร. เคม วิทยาศาสตร์ศ. เอจี เบเรจนายา (SFU); CAND tehn คณะวิทยาศาสตร์ GN โซโกลวา (RSTU)
© มหาวิทยาลัยการขนส่งแห่งรัฐ Rostov, 2010
บทนำ: ข้อกำหนดและคำจำกัดความพื้นฐาน
พื้นฐานทางทฤษฎีของเคมีสมัยใหม่คือทฤษฎีโมเลกุลระดับอะตอม
อะตอมเป็นอนุภาคที่เล็กที่สุดและแยกไม่ได้ทางเคมีขององค์ประกอบทางเคมี อะตอมที่เป็นกลางประกอบด้วยนิวเคลียสที่มีประจุบวกและจำนวนอิเล็กตรอนที่สอดคล้องกัน ในอะตอมที่เป็นกลางจำนวนของโปรตอนในนิวเคลียสจะเท่ากับจำนวนของอิเล็กตรอนที่เคลื่อนที่ไปรอบ ๆ นิวเคลียส
องค์ประกอบทางเคมี- ประเภทของอะตอมที่มีประจุนิวเคลียร์เหมือนกัน
อะตอมขององค์ประกอบทางเคมีสามารถรวมเข้าด้วยกันก่อตัวง่ายประกอบด้วยอะตอมที่เหมือนกัน (O 2, H 2, P 4, C และอื่น ๆ ) หรือซับซ้อนซึ่งประกอบด้วยอะตอมขององค์ประกอบทางเคมีที่แตกต่างกันสาร (H2 SO4, C12 H22 O11, NaOH ) สารที่ซับซ้อนที่เรียกว่า สารประกอบทางเคมี. สำหรับสารเคมีหลายอย่างยุติธรรม
กฎหมายความมั่นคง (J.L. Proust, 1808) - ใด ๆ
โครงสร้างโมเลกุลมีองค์ประกอบเชิงปริมาณและคุณภาพคงที่โดยไม่คำนึงถึงวิธีการเตรียม
โมเลกุลเป็นอนุภาคที่เล็กที่สุดของสารที่รักษาองค์ประกอบและคุณสมบัติทางเคมีพื้นฐาน
ไอออนเป็นอนุภาคที่มีประจุไฟฟ้าที่เกิดขึ้นจากอะตอม (หรือกลุ่มของอะตอม) ซึ่งเป็นผลมาจากการเพิ่มหรือการสูญเสียอิเล็กตรอนจำนวนหนึ่งไอออนบวกคือประจุบวกและประจุลบเป็นประจุลบ
สมการกระบวนการ |
||
นา + - ไอออนบวก | Na0 - 1ē = Na + |
|
S2– - ประจุลบ | S0 + 2ē = S2– |
|
สูตรทางเคมี- บันทึกสัญลักษณ์ขององค์ประกอบและอัตราส่วนที่ง่ายที่สุดของอะตอมขององค์ประกอบต่าง ๆ ที่ก่อตัวเป็นสารประกอบทางเคมี องค์ประกอบเชิงคุณภาพของสารถูกระบุด้วยสัญลักษณ์ขององค์ประกอบทางเคมีองค์ประกอบเชิงปริมาณโดยตัวห้อยของสัญลักษณ์ขององค์ประกอบทางเคมีซึ่งระบุจำนวนอะตอมขององค์ประกอบที่กำหนดในสารประกอบ ถ้าสารประกอบประกอบด้วยอะตอมหนึ่งขององค์ประกอบดังนั้นดัชนี“ หนึ่ง” จะไม่ถูกบันทึก ตัวอย่างเช่นใน
โมเลกุลของกรดซัลฟูริก H2 SO4 มีไฮโดรเจน 2 อะตอม (ดัชนี H2 2), 1 อะตอมกำมะถัน (ไม่สะกด S1) และออกซิเจน 4 อะตอม (O4)
ปรากฏการณ์ทางเคมีหรือปฏิกิริยาทางเคมีเป็นปรากฏการณ์เมื่อ
ซึ่งสารบางชนิดผ่านเข้าไปสู่สารอื่นซึ่งแตกต่างจากสารดั้งเดิมในคุณสมบัติ องค์ประกอบองค์ประกอบของสารไม่เปลี่ยนแปลง
กฎหมายการอนุรักษ์(MV Lomonosov, 1748) - มวลของ
สารที่เข้าสู่ปฏิกิริยาเท่ากับมวลของสารที่เกิดขึ้นจากปฏิกิริยา
มวลที่แน่นอนของอะตอมหรือโมเลกุล แสดงเป็นกรัม
กิโลกรัมหรือหน่วยมวลอะตอม ตัวอย่างเช่น
m (H) = 1.674 10–24 g = 1.674 10–27 kg = 1 amu
หน่วยมวลอะตอม (1 amu) เท่ากับ 1/12 ส่วนของมวลของไอโซโทปคาร์บอน12 C.
1 อามู = 1/12 m (12 C) ≈ 1.66 10–24 g ≈ 1.66 · 10–27 kg
มวลอะตอมสัมพัทธ์ขององค์ประกอบ (ar) เท่ากับอัตราส่วนของมวลเฉลี่ยต่ออะตอมในส่วนผสมทางธรรมชาติของไอโซโทปต่อ 1/12 ส่วนหนึ่งของมวลของไอโซโทปคาร์บอน12 C. มวลอะตอมสัมพัทธ์ไม่มีอยู่
ค่ามิติ, Ar (Cl) = 35.453; Ar (O) = 15.9994; Ar (S) = 32.0660
น้ำหนักโมเลกุลสัมพัทธ์ (M r) เท่ากับค่าเฉลี่ย
มวลของมันสอดคล้องกับสูตรทางเคมีของสารโดยคำนึงถึงองค์ประกอบของส่วนผสมทางธรรมชาติของไอโซโทปขององค์ประกอบทางเคมีจนถึง 1/12 ถึงมวลของอะตอมของไอโซโทป 12 C นั่นคือ 1 amu ดังนั้นน้ำหนักโมเลกุลสัมพัทธ์จะเท่ากับผลรวมของมวลอะตอมสัมพัทธ์ขององค์ประกอบทั้งหมดที่ประกอบขึ้นเป็นสารประกอบทางเคมี สำหรับการคำนวณทางเคมีค่าของ r และ m r มักจะถูกปัดเศษเป็นจำนวนเต็มยกเว้นบางกรณีเช่นคลอรีน (35.5) ตัวอย่างเช่น M r (H2 SO4) = 1 ∙ 2 + 32 ∙ 1 + 16 ∙ 4 = 98
โมลคือปริมาณของสาร (n,) ที่บรรจุอนุภาคของสาร (อะตอม, โมเลกุล, ไอออน, อิเล็กตรอน ... ) เนื่องจากมีไอโซโทปคาร์บอน 0.012 กิโลกรัมในไอโซโทป 12 C
ค่าคงที่ Avogadro (NA ≈ 6.02 1023 mol-1) - จำนวนหน่วยโครงสร้างในหนึ่งโมลของสารใด ๆ
มวลโมลาร์คือมวลของสารหนึ่งโมล หน่วยวัด
- g / mol; กก. / kmol; mg / mmol
ปริมาณของสารn ("จำนวนโมล") สามารถกำหนดได้โดยมวลหรือตามจำนวนหน่วยโครงสร้าง:
โดยที่ m คือมวลของสาร, M คือมวลโมลาร์ของสาร, N คือจำนวนหน่วยโครงสร้าง, N A คือจำนวน Avogadro
กฎของ Avogadro - ปริมาณก๊าซที่แตกต่างกันภายใต้เงื่อนไขเดียวกันมีจำนวนโมเลกุลเท่ากัน
ผลแรกของกฎหมาย Avogadro - หนึ่งโมลของก๊าซใด ๆ ภายใต้สภาวะเดียวกันนั้นมีปริมาตรเท่ากัน
ภายใต้สภาวะปกติ (NU): T = 273.15 K (t = 0 ˚C) และ P = 101 325 Pa (1 atm = 760 mm Hg) 1 mol ของก๊าซในอุดมคติมีปริมาตร 22.4 l ปริมาณก๊าซของโมลจริงในสภาพปกตินั้นอยู่ใกล้กับค่านี้มาก
ปริมาณของก๊าซที่เป็นแก็สและก๊าซเป็นไปตามสูตร
n gasV V แก๊ส
โดยที่ V gas คือปริมาตรของก๊าซ V M คือปริมาตรของโมลาร์ของก๊าซ (V M = 22.4 l / mol ที่ NU)
Clapeyron - Mendeleev สมการ:
PV M m RT
โดยที่ P คือแรงดันแก๊ส V คือปริมาตรแก๊ส m คือมวลของก๊าซ M คือมวลโมลาร์ของก๊าซ R คือค่าคงที่ของก๊าซสากล R = 8.314 J / (mol K)
Valency - ความสามารถของอะตอมขององค์ประกอบทางเคมีในรูปแบบจำนวนหนึ่ง พันธะเคมี ด้วยอะตอมขององค์ประกอบทางเคมีอื่น ๆ
อิเล็กโทรไลต์เป็นสารที่มีสารละลายหรือละลายเป็นตัวนำไฟฟ้า อิเล็กโทรไลรวมถึงกรดเบสเกลือ
อิเล็กโทรไลต์ที่ไม่ใช่อิเล็กโตรไลต์เป็นสารที่สารละลายหรือละลายไม่นำไฟฟ้า
การแยกตัวด้วยไฟฟ้า - การแตกตัวของอิเล็กโทรไลต์เป็นไอออนในระหว่างการละลายหรือการละลาย การแยกตัวออกเป็นกระบวนการที่ย้อนกลับได้ กระบวนการย้อนกลับเรียกว่าการเชื่อมโยง
กรดคืออิเล็กโตรไลต์การแยกตัวออกมาซึ่งผลิตไฮโดรเจนไอออนบวก H + และประจุลบของกรด
HCl H + + Cl–
กรดโพลีเบสเป็นกรดที่มีไฮโดรเจนหลายอะตอม กรด polybasic แยกตัวออกเป็นขั้นตอน:
H2 SO4 | H + + HSO4 - | (ขั้นตอนที่ 1); |
HSO4 - H + + SO4 2– | (ขั้นตอนที่ 2); |
|
H2 SO4 | 2H + + SO4 2– | |
การแยกตัวของกรดโพลีเบสส่วนใหญ่เกิดขึ้นในระยะแรก
ฐานเป็นอิเล็กโทรไลต์ในระหว่างการแยกตัวของประจุไฟฟ้า OH - ไฮดรอกไซด์แอนไอออนและไอออนบวกของโลหะหรือแอมโมเนียมเท่านั้น
NaOH Na + + OH–
Multi-acid bases - ฐานที่ประกอบด้วยแอนไอออนไฮดรอกไซด์หลาย OH - จะแยกตัวออกเป็นขั้นตอน:
อัล (OH) 3 | อัล (OH) 2 + + OH– | (ขั้นตอนที่ 1); |
Al (OH) 2 + AlOH2 + + OH– | (ขั้นตอนที่ 2); |
|
AlOH2 + Al3 + + OH– | (ขั้นตอนที่ 3); |
|
อัล (OH) 3 | Al3 + + 3OH– | (สมการความร้าวฉานทั้งหมด) |
ความร้าวฉานของกรดหลายฐานรายได้ส่วนใหญ่ผ่านขั้นตอนแรก
เกลือกลางเป็นอิเล็กโทรไลต์การแยกตัวออกจากโลหะหรือแอมโมเนียมไอออนบวกและไอออนของกรดที่เหลือ:
NH4 Cl NH4 + + Cl–
K2 SO4 2K + + SO4 2–
เกลือของกรด - อิเล็กโทรไลต์การแยกตัวออกซึ่งเป็นไอออนบวกของโลหะและประจุลบของกรดที่มีอะตอมไฮโดรเจน ประจุลบของสารตกค้างของกรดมีส่วนร่วมในกระบวนการแยกตัวออกจากส่วนที่สอง:
NaHSO3 Na + + HSO3 - HSO3 - H + + SO3 2–
เกลือพื้นฐานคืออิเล็กโทรไลต์ในระหว่างการแยกตัวไอออนบวกประกอบด้วยไอออนของโลหะและกลุ่มไฮดรอกโซ่และประจุลบของกรดจะเกิดขึ้น การไฮดรอกตำแหน่งของโลหะก็สามารถแยกออกจากกัน:
СaOHСl CaOH + + Cl– CaOH + Ca2 + + OH–
ออกไซด์เป็นสารที่ซับซ้อนประกอบด้วยสององค์ประกอบซึ่งหนึ่งในนั้นคืออะตอมออกซิเจนในสถานะออกซิเดชัน –2 ออกไซด์เป็นอิเล็กโทรไลต์และไม่แยกตัวในสารละลาย
สมการไอออนิก
ในการแก้ปัญหาปฏิกิริยาหลายอย่างเกิดขึ้นระหว่างไอออน ปฏิกิริยาสามารถย้อนกลับและย้อนกลับได้
ปฏิกิริยาย้อนกลับ
– ในรูปแบบโมเลกุล:
NaCl + KNO3 NaNO3 + KCl;
- ในรูปแบบไอออนิก:
Na + + Cl– + K + + NO3 - Na + + NO3 - + K + + Cl–
เซตของไอออนในด้านซ้ายและด้านขวาของสมการที่ลดลงคือ
ปฏิกิริยากลับไม่ได้ดำเนินการหากไม่ละลายน้ำ (1), การแยกตัวต่ำ (2) หรือผลิตภัณฑ์ก๊าซ (3) เกิดขึ้นนั่นคือผลิตภัณฑ์ปฏิกิริยาบางชนิดถูกลบออกจากทรงกลมปฏิกิริยา
2 ในรูปแบบโมเลกุล 2NaOH + H2 SO4 = Na2SO4 + 2H2 O
ในรูปแบบไอออนิกเต็มรูปแบบ 2Na + + 2OH– + 2H + + SO4 2– =
2Na + + SO4 2– + 2H2 O |
||
ในระยะสั้น | H + + OH– = H2 O |
|
3 ในรูปโมเลกุล | Na2S + H2 SO4 = Na2SO4 + H2 S |
|
ในรูปแบบไอออนิกเต็มรูปแบบ | 2Na + + S2– + 2H + + SO4 2– = |
|
2Na + + SO4 2– + H2 S |
||
ในระยะสั้น | 2H + + S2– = H2 S |
|
พื้นฐานของระบบการตั้งชื่อของสารประกอบอนินทรีย์สามารถสรุปได้ดังนี้:
1 อะตอมที่ไม่ใช่โลหะในสารประกอบไบนารี (ยกเว้นสารประกอบที่มีไฮโดรเจน) ถูกเรียกโดยการเพิ่มส่วนต่อท้าย - ID ไปยังชื่อละติน
องค์ประกอบตัวอย่างเช่น: O - 2 - ออกไซด์, Cl– - คลอไรด์, I– - ไอโอไดด์, N - 3 - nitride, P - 3
- ฟอสฟอรัส S - 2 - ซัลไฟด์ ฯลฯ
2 สูตรของสารอนินทรีย์ที่ซับซ้อนส่วนใหญ่เขียนด้วยลำดับ“ จากไอออนบวกถึงไอออน” ในเกลือเบสและกรดตัวอย่างเช่น Na + Cl–, H + 2 S - 2, (NH4) + 2 SO4 –2 สารประกอบไฮโดรเจน องค์ประกอบของกลุ่มย่อยหลักของกลุ่ม IV และ V วางองค์ประกอบนี้ในสถานที่แรกแล้วไฮโดรเจน: CH4 - มีเทน SiH4 - ไซเลน, NH3 - แอมโมเนีย, PH3 - ฟอสฟีน, AsH3 - arsine และอื่น ๆ

ในรัสเซียชื่อของออกไซด์ฐานและเกลือมักประกอบด้วย“ จากไอออนถึงไอออนบวก” เรียกอะตอมหรือกลุ่มในสารประกอบนี้จากขวาไปซ้ายและระบุระดับการออกซิเดชั่นขององค์ประกอบหลัก (กลาง) หากสามารถมีค่าแตกต่างกันในสารต่าง ๆ 1 ตัวอย่างเช่น: MgO - แมกนีเซียมออกไซด์, SO2 - ซัลเฟอร์ออกไซด์ (IV), SO3 - ซัลเฟอร์ออกไซด์
(VI), FeCl2 - เหล็ก (II) คลอไรด์, FeCl3 - เหล็ก (III) คลอไรด์, Cu (OH) 2 - ไฮโดร -
คอปเปอร์ออกไซด์ (II), (ZnOH) 2 SO4 - ไฮดรอกซีซินซัลเฟต (หรือสังกะสีไฮดรอกซีซัลเฟต), (NH4) 2 HPO4 - แอมโมเนียมไฮโดรเจนฟอสเฟต
ตารางที่ 1
ชื่อของสารอนินทรีย์และประจุลบหรือประจุบวกในองค์ประกอบ
ชื่อ | สูตรกรด |
|
สัมพันธ์ | สัมพันธ์ | สารตกค้างประจุลบหรือ |
ไอออนบวกและชื่อของพวกเขา |
||
HNO2 | กรดไนตรัส | NO2 - - ไนไตรต์ |
HNO3 | NO3 - - ไนเตรต |
|
NH4 + - แอมโมเนียม |
||
H2 SiO3 | ซิลิคอน (meta-silicon) | SiO3 2– - ซิลิเกต |
หวาย) กรด | ||
HMnO4 | กรดแมงกานีส | MnO4 - - เปอร์แมงกาเนต |
H2 SO3 | กรดกำมะถัน | SO3 2– - ซัลไฟต์ |
H2 SO4 | กรดกำมะถัน | SO4 2– - ซัลเฟต |
กรดไฮโดรเจนซัลไฟด์ | S2– - ซัลไฟด์ |
|
H2 CO3 | กรดคาร์บอนิก | CO3 2– - คาร์บอเนต |
HClO4 | กรดเปอร์คลอริก | ClO4 - - เพอร์คลอเรต |
HClO3 | กรดคลอรีน | ClO3 - - คลอเรต |
กรดไฮโปคลอรัส | ClO– - ไฮโปคลอไรต์ |
|
ไฮโดรคลอริก (ไฮโดรคลอริก) | Cl– - คลอไรด์ |
|
ไฮโดรเจนฟลูออไรด์ (hydrofluoric) | F– - ฟลูออไรด์ |
|
หวาย) กรด | ||
HPO3 | กรดเมตาฟอสฟอริก | PO3 - - เมธาฟอสเฟต |
H3 PO4 | กรดฟอสฟอริก | PO4 3– - orthophosphate (phos- |
H4 P2 O7 | กรดไพโรฟอสฟอริก | P2 O7 4– - ไพโรฟอสเฟต |
โซเดียมไฮดรอกไซด์ | OH– - ไฮดรอกไซด์ |
1 ระบบการตั้งชื่อ IUPAC แนะนำชื่ออาคารที่เริ่มต้นด้วยไอออนบวกเช่น NaCl - โซเดียมคลอไรด์ MgCl (OH) - แมกนีเซียมไฮดรอกไซด์

1 ชั้นเรียนของคำสาบาน
ELEMENTS | ||
ตามแบบฉบับ | amphoteric | ตามแบบฉบับ |
อโลหะ |
||
คนหลัก | amphoteric | ที่เป็นกรด |
K2 O, CaO | ZnO, Al2 O3 | CO2, SO3 |
(+ H2 O) | ||
ไฮดรอกไซ | ||
บริเวณ | amphoteric | |
บริเวณ | ||
KOH, Ca (OH) 2 | Zn (OH) 2, Al (OH) 3 | H2 CO2, H2 SO4 |
มะเดื่อ 1.1 คลาสหลักของสารประกอบอนินทรีย์และความสัมพันธ์
3 กรดที่ประกอบด้วยออกซิเจนซึ่งประกอบด้วยอะตอมของโลหะที่ไม่ใช่โลหะหรือโลหะในสถานะออกซิเดชันที่สูงที่สุดจะมีคำต่อท้าย - NAYA (กรด) ในตัวอย่างก่อนหน้า - - PERSON (กรด) ตัวอย่างเช่น: HNO3 - กรดไนตริกและ HNO2 - กรดไนตรัส กรดและ H2 SO3 - กรดกำมะถัน
ออกไซด์เป็นสารที่ซับซ้อนประกอบด้วยสององค์ประกอบซึ่งหนึ่งในนั้นคือออกซิเจนในสถานะออกซิเดชัน –2
ออกไซด์แบ่งออกเป็นการขึ้นรูปเกลือ (ส่วนใหญ่) และการขึ้นรูปที่ไม่ใช่เกลือ (CO, N2 O, NO)
ออกไซด์ของเกลือขึ้นรูปจะแบ่งออกเป็นกรด
วิธีการทั่วไปในการผลิตออกไซด์
1 ออกซิเดชันของสารง่าย ๆ (โลหะและอโลหะ) ด้วยออกซิเจน:
2Zn + O2 = 2ZnO S + O2 = SO2
2 ออกซิเดชัน (การเผาไหม้) ของสารที่ซับซ้อน (อินทรีย์และอนินทรีย์):
СH4 + O2 = СO2 + 2H2 O 2H2 S + 3O2 = 2SO2 + 2H2 O 2CO + O2 = 2CO2
3 การเปลี่ยนแปลงของสารที่ซับซ้อน:
a) การสลายตัว (โดยไม่เปลี่ยนระดับการเกิดออกซิเดชัน) ของกรดที่มีออกซิเจนฐานและเกลือบางส่วน:
H2 SO3 = SO2 + H2 O Cu (OH) 2 = CuO + H2 O CaCO3 = CaO + CO2
b) ปฏิกิริยารีดอกซ์: 2Al + Fe2 O3 = 2Fe + Al2 O3
Cu + 4HNO3 (conc.) = Cu (NO3) 2 +2NO2 + 2H2 O 4CuO = 2Cu2 O + O2
กรดออกไซด์- ออกไซด์ของอโลหะ (CO2, SO3, SiO2, P2 O5) และออกไซด์ของโลหะทรานซิชันโดยปกติจะอยู่ในสถานะออกซิเดชัน +5, +6, +7 (V2 O5, CrO3, Mn2 O7)
คุณสมบัติทางเคมีของกรดออกไซด์:
1 การมีปฏิสัมพันธ์กับน้ำ (ยกเว้น SiO2): SO3 + H2 O = H2 SO4
CrO3 + H2 O = H2 CrO4












