קביעה איכותית וכמותית. §2. נוסחה כימית ניתוח איכותי של antroglycosides
ג 'יי ברזליוס הציע לייעד את היסודות הכימיים עם האות הראשונה של שמות הלטינית שלהם. לפיכך, האות הראשונה של השם הלטיני שלה הפכה לסמל של חמצן: חמצן - O (קורא "o", שכן השם הלטיני של אלמנט זה הוא חמצן). לפיכך, מימן קיבל את הסמל - H (קרא "אפר", כמו השם הלטיני של אלמנט זה הוא hydrogenium), פחמן - C (קרא "tse", כמו השם הלטיני של אלמנט זה הוא carboneum). אבל את שמות הלטינית עבור כרום (כרום), כלור (chlorum) ונחושת (cuprum), כמו גם פחמן, להתחיל באות "C". איך להיות? י 'ברסליוס הציע פתרון מבריק: לכתוב תווים כאלה לא באחד, אבל בשני מכתבים - הראשון ואחד המכתבים הבאים, לרוב השני. אז, כרום מיועד CR (קורא "כרום"), כלור - C1 (קורא "כלור"), נחושת - Cu (קורא "cuprum").
תגובה נוספת של זיהוי הלוגן היא התגובה עם חנקתי כסף. כדי להצביע על נוכחות של הלוגן, לבן או צהוב כסף הליד halide נוצר. כדי לזהות כל אטום הלוגן, המשקע המתקבל מטופל עם תמיסה של אמוניום הידרוקסיד ולעשות את התצפיות הבאות.
אם המשקע הוא לבן מעט מומס אמוניום הידרוקסיד, החומר מכיל כלור. אם המשקע הוא לבן וצהוב מסיס יותר אמוניום הידרוקסיד, הוא מכיל ברום. אם המשקע הוא צהוב בלתי מסיס אמוניום הידרוקסיד, הוא מכיל יוד.
שמות רוסיים ולטיניים, סימנים של עשרים היסודות הכימיים המשמשים את בית הספר ואת ההגייה שלהם ניתנים בטבלה 2.
טבלה 2
שמות וסמלים של כמה יסודות כימיים
בטבלה שלנו מתאים רק 20 אלמנטים. כדי לראות את כל 110 מרכיבים ידוע עד כה, אתה צריך להתייחס אל השולחן של אלמנטים כימיים די Mendeleev.
זיהוי הלוגנים בהרכב של חומרים אורגניים של צמחים. חומרים חיוניים: חומצה מרוכזת; חנקתי כסף, פתרון של 2%; סלרי מיובש או עלים של שרך. ניסיון: מורחים עלים סלרי מיובשים או שרכים בכור. עם האפר שנוצר לבצע מיצוי מים, מופרדים על נייר הסינון. במידת הצורך, חזור על פעולת המסנן על אותו מסנן עד לקבלת נוזל צלול. מ נוזל מסונן, לקחת צינור נקי 1-2 מ"ל לחומצן עם כמה טיפות של חומצה חנקתית מרוכזת.
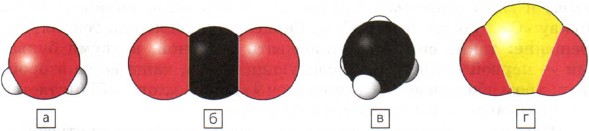
לרוב, הרכב החומרים כולל אטומים של כמה יסודות כימיים. ניתן לתאר את החלקיק הקטן ביותר של החומר, למשל, מולקולה, בעזרת מודלים של כדור, כפי שעשית בשיעור הקודם. איור 40 מציג מודלים נפחיים של מולקולות מים (א), פחמן דו-חמצני (b), מתאן (ג) וגופרית דו-חמצנית (g).
לתערובת להוסיף 3-4 טיפות של פתרון חנקתי 2% כסף. המראה של משקע לבן של כלוריד כסף מציין נוכחות של כלור בהתאם לתגובה. ניתוח כימי אורגני מספק לנו שיטות לקביעת מידת הזיהום, ולכן, נקיטת אמצעי הגנה. כמה חומרי הדברה כי קשה biodegrade יכול להצטבר באדמה, שממנו הם יכולים להזין צמחים, כגון תפוחי אדמה או גזר.
במחבת, האנליטים מופקים תפוחי אדמה או גזר כאשר מעובדים עם הקסאן רגיל. הפרד את הפתרון על ידי decanting, להוסיף כמה טיפות של הידרוקסיד אשלגן, פתרון אלכוהול רגיל. להתאדות באמבט מים עד יבש. לאחר הידרוליזה, שאריות מיובשים הוא redissolved בכמה טיפות של פחמן tetrachloride. מערבבים ולנער עם 2 מ"ל של תערובת של חומצה חנקתית וחומצה גופרתית.
איור. 40
מודלים גורפת של מולקולות:
א - מים; ב - דו תחמוצת הפחמן; ב - מתאן; g - דו תחמוצת הגופרית
בעזרת סמלים של יסודות כימיים ומדדים נוסחאות כימיות של חומרים נכתבים. המדד מראה כמה אטומים של אלמנט זה הם חלק ממולקולת החומר. הוא נרשם בחלק הימני התחתון של סימן היסוד הכימי. לדוגמה, נוסחאות החומרים המתוארים באיור 40 נכתבות כך: א - ה 2; b - CO 2; in - CH 4; g - SO 2.
ניתוח כמותי יסודי
גרין מופיע כרמז. ניתוח כמותי יסודי קובע את אחוז המרכיבים השונים של החומר האורגני. האלמנטים המתקבלים על ידי הפרדת החומר יכולים להיות נפחיים או gravimetric, מינון אשר הוא הנושא של שיטות אלמנטריות של ניתוח כמותי.
קביעת הלוגנים דורשת פירוק של חומר אורגני כדי לספק הלוגן יונית, ולאחר מכן מינון זה עם חנקתי כסף gravimetric או בתפזורת. בהקשר זה, קיימות מספר שיטות לקביעה. במקרה של תרכובות אורגניות נדיפות, הלוגנים נקבעים בשיטת קריוס. השיטה הפשוטה והפשוטה ביותר לקביעת הלוגנים היא שיטת Stepanov. זיהוי ישיר של הלוגנים מחומרים אורגניים בשיטת Stepanov הוא כדלקמן.
הנוסחה הכימית היא מודל הסימנים העיקרי במדע שלנו. היא נושאת מידע חשוב מאוד. נוסחה כימית מראה:
הרכב איכותי חומרים, כלומר, אטומים שבהם אלמנטים הם חלק מהחומר;
הרכב כמותי, כלומר, כמה אטומים של כל רכיב הוא חלק של החומר המולקולה.
על פי הנוסחה של חומר, ניתן גם לקבוע האם הוא פשוט או מורכב.
לדוגמה, מימן H 2, ברזל Fe, חמצן O 2 הם חומרים פשוטים, מים H 2 O, פחמן דו חמצני CO 2 וחומצה גופרתית H 2 SO 4 הם מורכבים.
שאלות ומשימות
- אילו אלמנטים כימיים מכילים אותיות C? כתוב אותם ואמור.
- מטבלה 2 רשום בנפרד את סימני אלמנטים המתכת ואת הסימנים של אלמנטים שאינם מתכת. תגיד את שמם.
- מהי נוסחה כימית? כתוב את הנוסחאות של החומרים הבאים:
- א) חומצה גופרתית, אם ידוע כי הרכב המולקולות שלה כולל שני אטומי מימן, אטום גופרית אחד וארבעה אטומי חמצן;
- ב) מימן גופרתי, המולקולה של אשר מורכב משני אטומי מימן ואטום גופרית אחד;
- ג) דו תחמוצת הגופרית אשר מולקולה מכילה אטום גופרית אחד ושני אטומי חמצן.
מה מאחד את כל החומרים האלה?
- יצירת מודל נפח של תרכובות הבאות מן plasticine:
- א) אמוניה, מולקולה אשר מכיל אטום חנקן אחד שלושה אטומי מימן, מסדיר את אטומי המימן ביחס אטום חנקן בזווית של 110 מעלות;
- ב) מימן כלורי, המולקולה של אשר מורכב מאטום מימן אחד ואטום כלור אחד;
- ג) כלור, מולקולה אשר מורכב משני אטומי כלור.
כתוב את הנוסחאות של חומרים אלה וקרא אותם.
- תרשים 40 מציג את המודלים המולקולריים של ארבעה כימיקלים. כמה אלמנטים כימיים חומרים אלה יוצרים? שם אותם, לרשום את התווים של אלמנטים אלה ולומר להם.
- קחו פלסטלינה של ארבעה צבעים. מגלגלים את הכדורים הלבנים הקטנים - אלה הם מודלים של אטומי מימן, הכדורים האדומים הגדולים הם מודלים של אטומי חמצן, הכדורים השחורים הם מודלים של אטומי פחמן, ולבסוף, הכדורים הגדולים ביותר של צבע צהוב משמשים מודלים של אטומי גופרית. הפוך מודלים volumetric של המולקולות שמוצג בתרשים 40.
המכון החינוכי הממלכתי של רושלדור
השכלה מקצועית גבוהה יותר "מדינת רוסטוב אוניברסיטת תקשורת"
כימיה כללית
מדריך לימוד עצמי
עבודה סטודנטית
אושרה על ידי המועצה המתודולוגית של האוניברסיטה
רוסטוב און דון
UDC 541 (07) + 06
כימיה כללית: מדריך לעבודה עצמאית של תלמידים / י. Migal, S.B. Bulgarievich, V.N. דורונקין [ואח ']; צמיחה מדינה un-t של תקשורת. - Rostov n / a, 2010. - 191 עמ '. ביבליוגרפיה : 11 כותרים
מכיל מידע על החלקים העיקריים של הכימיה הכללית: סוגי תרכובות אנאורגניות, תרמודינמיקה כימית, שיעור תגובות כימיות, שיווי משקל כימי, מבנה החומר, פתרונות, תגובות לחזרה, אלקטרוכימיה, פולימרים. דוגמאות לפתרון בעיות אופייניות, בעיות בעלות אופי יישומי בנושאי רכבת, דיאגרמות המציגות את הקשר הלוגי של מושגים כימיים, ואת הספרות המומלצת.
המדריך אושר לפרסום על ידי המחלקה לכימיה של RGUPS ומיועד לתלמידי הקורס הראשון של כל התמחויות.
סוקרים: ד"ר כימית. מדעים, פרופ. A.G. Berezhnaya (SFU); קנדי. טק. מדעי החברה, G.N. סוקולובה (RSTU)
© אוניברסיטת רוסטוב, 2010
מבוא: תנאים והגדרות בסיסיים
הבסיס התיאורטי של הכימיה המודרנית הוא תיאוריה מולקולרית אטומית.
האטום הוא החלקיק הקטן ביותר, שאינו ניתן לחלוקה כימית של יסוד כימי. האטום הנייטרלי מורכב מגרעין טעון חיובי ומספר המקביל של אלקטרונים. באטום נייטרלי, מספר הפרוטונים בגרעין שווה למספר האלקטרונים הנעים סביב הגרעין.
יסוד כימי- סוג של אטומים עם תשלום גרעיני אותו.
אטומים של יסודות כימיים יכולים לשלב זה עם זה, יוצרים פשוטים, המורכבים מאטומים זהים (O 2, H 2, P 4, C ואחרים), או מורכבים, המורכבים מאטומים של אלמנטים כימיים שונים, חומרים (H2 SO4, C12 H22 O11, NaOH ). חומרים מורכבים הנקראים תרכובות כימיות. עבור חומרים כימיים רבים הוגן
חוק הקביעות (י 'פרוסט, 1808) - כל
המבנה המולקולרי בעל הרכב איכותי וכמותי קבוע, ללא תלות בשיטת ההכנה שלו.
מולקולה היא החלקיק הקטן ביותר של חומר המשמר את הרכבו ואת התכונות הכימיות הבסיסיות שלו.
יונים הם חלקיקים טעונים חשמלית הנוצרים מאטומים (או קבוצות של אטומים) כתוצאה מהוספה או הפסד של מספר מסוים של אלקטרונים, הקטיונים הם יונים טעונים בחיוב, ואניונים טעונים יונים טעונים שלילי.
משוואת התהליך |
||
- קטיון | Na0 - 1ē = Na + |
|
S2- - אניון | S0 + 2ē = S2- |
|
נוסחה כימית- שיא סימבולי של הרכב ואת היחס המספרי הפשוט ביותר של אטומים של אלמנטים שונים המהווים תרכובת כימית. ההרכב האיכותי של החומר מסומן על ידי סמלים של אלמנטים כימיים, ההרכב הכמותי על ידי תת-הסימנים של האלמנטים הכימיים, המציינים את מספר האטומים של אלמנט נתון במתחם; אם המתחם מכיל אטום אחד של האלמנט, אזי המדד "אחד" לא נרשם. לדוגמה, ב
מולקולות חומצה גופרית H2 SO4 מכיל 2 אטומי מימן (H2 מדד 2), 1 אטום גופרית (S1 אינו מאוית) ו 4 אטומי חמצן (O4).
תופעות כימיותאו תגובות כימיות הן תופעות כאשר
אשר חומרים מסוימים לעבור לאחרים, שונים מן החומרים המקוריים שלהם נכסים; ההרכב היסודי של החומר אינו משתנה.
חוק שימור המונים(MV Lomonosov, 1748) - המוני של
החומרים שנכנסו לתגובה, שווה למסה של חומרים שנוצרו כתוצאה מהתגובה.
מסה מוחלטת של אטום או מולקולה לידי ביטוי בגרמים
ק"ג או יחידות מסה אטומיות. לדוגמה
מ '(H) = 1.674 10-24 גרם = 1.674 10-27 ק"ג = 1 אמו
יחידת מסה אטומית (1 אמו) שווה ל 1/12 חלקים של המסה של איזוטופ פחמן12 12
1 אמו = 1/12 m (12 C) ≈ 1.66 10-24 גרם ≈ 1.66 · 10-27 ק"ג.
מסה אטומית יחסית של אלמנט (ar) השווה ליחס של המסה הממוצעת לאטום בתערובת טבעית של איזוטופים לחלק אחד של המסה של איזוטופ הפחמן12 ג. המסה האטומית היחסית היא ללא
ערך ארעי, אר (Cl) = 35.453, Ar (O) = 15.9994, Ar (S) = 32.0660.
משקל מולקולרי יחסי (M r) שווים לממוצע
המסה שלו, המקביל לנוסחה הכימית של חומר, נמצא לקחת בחשבון את הרכב התערובת הטבעית של איזוטופים של יסודות כימיים, כדי 1/12 את מסה של האטום של איזוטופ 12 C, כלומר, 1 אמו. כתוצאה מכך, המסה המולקולרית היחסית שווה לסכום של המסה האטומית היחסית של כל האלמנטים המרכיבים את התרכובת הכימית. עבור חישובים כימיים, הערכים של r ו- m r מעוגלים לעתים קרובות למספרים שלמים, למעט במקרים מסוימים, לדוגמה, כלור (35.5). לדוגמה, M r (H2 SO4) = 1 ∙ 2 + 32 ∙ 1 + 16 4 = 98.
השומה היא כמות של חומר (n,) המכיל חלקיקים רבים של חומר (אטומים, מולקולות, יונים, אלקטרונים ...) שכן ישנם 0.012 ק"ג אטומי איזוטופ פחמן 12 ג.
אבוגדרו קבוע (NA ≈ 6.02 1023 mol-1) - מספר יחידות מבניות בחפרפרת אחת של כל חומר.
המסה הטוחנת היא המסה של שומה אחת של חומר. יחידת מידה
- g / mol; kg / kmol; מ"ג / ממול.
כמות החומרn ("מספר שומות") ניתן לקבוע על ידי מסה או על ידי מספר יחידות מבניות:
כאשר m הוא המסה של החומר, M הוא המסה הטוחנת של החומר, N הוא מספר היחידות המבניות, N A הוא מספר אבוגדרו.
חוק אבוגדרו - כמויות שוות של גזים שונים באותם תנאים, מכילים את אותו מספר של מולקולות.
התוצאה הראשונה של החוק אבוגדרו - שומה אחת של כל גז באותם תנאים תופסת את אותו נפח.
בתנאים רגילים (NU): T = 273.15 K (t = 0 ˚C) ו- P = 101 325 אבא (1 atm = 760 mm Hg) 1 שומה של גז אידיאלי תופסת נפח של 22.4 l. כמויות טוחנות של גזים אמיתיים בתנאים רגילים קרובים מאוד לערך זה.
כמות החומר הגזי n גז הוא על פי הנוסחה
גז גז,
שבו V נפח הוא נפח של גז, V M הוא נפח טוחנת של גז (V M = 22.4 l / mol ב NU).
משוואת קלפיירון - מנדלייב:
PV M m RT,
כאשר P הוא לחץ הגז, V הוא נפח הגז, m הוא מסת הגז, M הוא המסה הטוחנת של גז, R הוא קבוע הגז האוניברסלי, R = 8.314 J / (m K).
Valency הוא היכולת של אטום של אלמנט כימי כדי ליצור כמות מסוימת של קשרים כימיים עם האטומים של אלמנטים כימיים אחרים.
אלקטרוליטים הם חומרים אשר תמיסות מימיות שלהם או נמס חשמל; אלקטרוליטים כוללים חומצות, בסיסים, מלחים.
Non-electrolytes הם חומרים אשר פתרונות או melts אינם מבצעים זרם חשמלי.
ניתוק אלקטרוליטי - פירוק אלקטרוליטים לתוך יונים במהלך המסה או ההיתוך. דיסוציאציה היא תהליך הפיך; התהליך ההפוך נקרא שיוך.
חומצה היא אלקטרוליט, במהלך דיסוציאציה אשר רק קטיני מימן H + ואנינים של שאריות חומצה נוצרים.
HCl H + + Cl-
חומצות Polybasic הן חומצות המכילות מספר אטומי מימן; חומצות polybasic לנתק בשלבים:
H2 SO4 | H + + HSO4 - | (צעד ראשון); |
HSO4 - H + + SO4 2- | (שלב 2); |
|
H2 SO4 | 2H + SO4 2- | |
ההפרדה של חומצות polybasic מתרחשת בעיקר בשלב הראשון.
הבסיס הוא אלקטרוליט, במהלך דיסוציאציה אשר רק אניונים OH- הידרוקסיד מתכת או קטיוני אמוניום נוצרים.
NaOH Na + + OH-
בסיסי חומצה בסיסים הם בסיסים המכילים כמה הידרוקסיד אניונים OH-, הם לנתק בשלבים:
אל (אה) 3 | אל (OH) 2 + + OH- | (צעד ראשון); |
אל (OH) 2 + AlOH2 + + OH- | (שלב 2); |
|
AlOH2 + Al3 + + OH- | (שלב שלישי); |
|
אל (אה) 3 | Al3 + + 3OH- | (משוואת הדיסוציאציה הכוללת). |
הדיסוציאציה של בסיסים רב חומצי מתרחשת בעיקר בשלב הראשון.
מלח בינוני הוא אלקטרוליט, ניתוק אשר יוצר מתכת או קטיון אמוניום ו anion של שאריות חומצה:
NH4 Cl NH4 + + Cl-
K2 SO4 2K + + SO4 2-.
מלח חומצה הוא אלקטרוליט, דיסוציאציה של אשר מהווה קטיון מתכת anion של שאריות חומצה המכיל אטום מימן. אניון שאריות החומצה מעורב בתהליך של ניתוק משני:
NaHSO3 Na + + HSO3 - HSO3 - H + + SO3 2-
מלח בסיסי הוא אלקטרוליט, במהלך דיסוציאציה, קטיון המורכב של קבוצות מתכת hydroxo ו anion של שאריות חומצה נוצרים. Hydroxocation של המתכת הוא גם מסוגל disociation:
CaOHl CaOH + + Cl-CaOH + Ca2 + + OH-
תחמוצות הן חומרים מורכבים המורכבים משני אלמנטים, אחד מהם הוא אטום חמצן במצב חמצון -2. תחמוצות הן לא אלקטרוליטים ולא לנתק פתרונות.
משוואות יוניות
בפתרונות, תגובות רבות מתרחשות בין יונים; התגובות יכולות להיות הפיכות ובלתי הפיכות.
תגובה הפיך
– בצורת מולקולארית:
NaCl + KNO3 NaNO3 + KCl;
- בצורת יונית:
Na + + Cl + + K + + NO3 - Na + + NO3 - + K + + Cl.
קבוצת היונים בצד שמאל וימין של משוואה מופחתת הוא
תגובות בלתי הפיך להתרחש אם מסיסים (1), דיסוציאציה נמוכה (2) או גזי (3) מוצרים נוצרים, כלומר, כמה מוצרים התגובה מוסרים מתחום התגובה.
2 בצורת מולקולרית 2NaOH + H2 SO4 = Na2SO4 + 2H2 O
בצורתו היונית המלאה, 2Na + + 2OH- + 2H + + SO4 2- =
2Na + + SO4 2 + 2H2 O |
||
בקיצור | H + + OH- = H2 O |
|
3 בצורת מולקולרית | Na2S + H2 SO4 = Na2SO4 + H2 S |
|
בצורה יונית מלאה | 2Na + + S2 + 2H + + SO4 2- = |
|
2Na + + SO4 2- + H2 S |
||
בקיצור | 2H + + S2- = H2 S |
|
את היסודות של המינוח של תרכובות אנאורגניות ניתן לסכם כדלקמן:
1 אטומים של מתכות שאינן תרכובות בינאריות (למעט תרכובות עם מימן) נקראות על ידי הוספת הסיומת - מזהה לשמה הלטיני
אלמנט, למשל: O - 2 - תחמוצת, Cl - כלוריד, I - i iide, N - 3 - nitride, P - 3
- זרחן, S - 2 - גופרית, וכו '
2 הנוסחאות של רוב החומרים האורגניים המורכבים נכתבות ברצפים מ"קטיון לאניון "במלח, בסיסים וחומצות, לדוגמה, Na + Cl, H + 2 S-2, (NH4) + SO4 -2. בתרכובות המימן של אלמנטים של תת קבוצות עיקריות של IV ו V קבוצות, אלמנט זה הוא הראשון, ולאחר מכן מימן: CH4 - מתאן, SiH4 - silane, NH3 - אמוניה, PH3 - פוספין, ASH3 - arsine ואחרים.

ברוסיה, השמות של תחמוצות, בסיסים ומלחים מהווים לעתים קרובות "מאניון לקטיון", וקוראים אטומים או קבוצות במתחם זה מימין לשמאל ומציינים את מידת החמצון של האלמנט המרכזי (המרכזי), אם יש לו ערכים שונים בחומרים שונים. לדוגמה: MgO - תחמוצת מגנזיום, SO2 - תחמוצת גופרית (IV), תחמוצת גופרית מסוג SO3
(II), FeCl2 - ברזל (II) כלוריד, FeCl3 - ברזל (III) כלוריד, Cu (OH) 2 -
תחמוצת נחושת (II), (ZnOH) 2 SO4 - הידרוקססינק סולפט (או אבץ הידרוקסולפט), (NH4) 2 HPO4 - אמוניום פוספט אמוניום.
טבלה 1
שמות של כמה חומרים אנאורגניים ואניונים או קטיונים בהרכב שלהם
שם | נוסחת חומצה |
|
קשרים | קשרים | שאריות, אניון או |
קטיון ושמם |
||
HNO2 | חומצה חנקתית | NO2 - - ניטריט |
HNO3 | חומצה חנקתית | NO3 - ניטראט |
NH4 + - אמוניום |
||
H2 SiO | סיליקון (מטא-סיליקון) | SiO3 - סיליקט |
חומצה) | ||
HMnO4 | חומצה מנגנית | MnO4 |
H2 SO3 | חומצה גופרתית | SO3 - סולפט |
H2 SO4 | חומצה גופרתית | SO4 2- סולפט |
חומצה מימן גופרתי | גופרית |
|
H2 CO3 | חומצה פחמנית | פחמן דו חמצני |
HClO4 | חומצה פרכלורית | - פרכלורט |
HClO3 | חומצה כלורית | קלוראט - - |
חומצה היפוכלורית | ClO- - hypochlorite |
|
הידרוכלורית, | Cl- כלור |
|
מימן פלואוריד (הידרופלואורי) | F- פלואוריד |
|
חומצה) | ||
HPO3 | חומצה metaphosphoric | - metaphosphate |
H3 PO4 | חומצה זרחתית | PO4 - 3 - אורתופוספט (phos- |
H4 P2 O7 | חומצה pyrophosphoric | P2 O7 4 - pyrophosphate |
סודיום הידרוקסיד | OH- הידרוקסיד |
1 ועדת המינוחים של IUPAC ממליצה על בניית שמות המתחילים בקטיון, לדוגמה: NaCl-sodium chloride, MgCl (OH) - מגנזיום הידרוקסיד כלורי.

1 תרכובות של תרכובות אנאורגניות
אלמנטים | ||
אופייני | אמפוטרי | אופייני |
לא מתכות |
||
אלה העיקריים | אמפוטרי | חומצה |
K2 O, CaO | ZnO, Al2 O3 | CO2, SO3 |
(+ H2 O) | ||
הידרוקסידים | ||
קרקע | אמפוטרי | |
השטח | ||
KOH, Ca (OH) 2 | Zn (OH) 2, Al (OH) 3 | H2 CO2, H2 SO4 |
איור. 1.1. המעמדות העיקריים של תרכובות אנאורגניות והקשר ביניהם
3 חומצות המכילות חמצן, שיש בהרכב שלהן אטום שאינו מתכתי או מתכת במצב החמצון הגבוה ביותר, יש את הסיומת - NAYA (חומצה), הקודמת - PERSON (חומצה), לדוגמה: HNO3 - חומצה חנקתית ו- HNO2 - חומצה חנקתית, H2 SO4 - גופרית חומצה ו- H2 SO3 - חומצה גופרית.
תחמוצות הן חומרים מורכבים המורכבים משני אלמנטים, שאחד מהם הוא חמצן במצב חמצון -2.
תחמוצות מסווגות ליצירת מלח (רוב) ולא מלח להרכיב (CO, N2 O, NO).
מלח מתחבר תחמוצות מחולקים חומצה, אמפוטרי בסיסי.
שיטות כלליות לייצור תחמוצות
1 חמצון חומרים פשוטים (מתכות וחומרים מתכתיים) בחמצן:
2Zn + O2 = 2ZnO S + O2 = SO2
2 חמצון (שריפה) של חומרים מורכבים (אורגניים ואי-אורגניים):
CH4 + O2 = CO2 + 2H2 O 2H2 S + 3O2 = 2SO2 + 2H2 O 2CO + O2 = 2CO2
3 טרנספורמציות של חומרים מורכבים:
א) פירוק (מבלי לשנות את מידת החמצון) של חומצות המכילות חמצן, בסיסים, וכמה מלחים:
H2 SO3 = SO2 + H2 O Cu (OH) 2 = CuO + H2 O CaCO3 = CaO + CO2
ב) תגובות לחמצון: 2Al + Fe2 O3 = 2Fe + Al2 O3
Cu + 4HNO3 (קונקציה) = Cu (NO3) 2 + 2NO2 + 2H2 O 4CuO = 2Cu2 O + O2
חומצות חומצה- תחמוצות לא מתכת (CO2, SO3, SiO2, P2 O5) וחומצות של מתכות המעבר, בדרך כלל במצב חמצון +5, +6, +7 (V2 O5, CrO3, Mn2 O7).
תכונות כימיות של תחמוצות חומצה:
1 אינטראקציה עם מים (למעט SiO2): SO3 + H2 O = H2 SO4
CRO3 + H2 O = H2 CrO4












