En kort historie om kjemi. Utvikling av ideer og konsepter innen kjemi. Flott oppslagsverk om olje og gass
I forrige kapittel har du kanskje allerede lagt merke til at atomer, når de grupperes med hverandre, ikke nødvendigvis danner diatomiske molekyler, dvs. er koblet i ett til ett forhold. I et vannmolekyl er for eksempel to hydrogenatomer festet til ett oksygenatom. Antall bindinger som et atom kjemisk element dannes med andre atomer, kalles det valens.
Valens er indikert med romertall - I, II, III, etc. i henhold til dens betydning. La oss ta som et eksempel slike forbindelser som hydrogenklorid HCl, vann H 2 O, ammoniakk NH 3 og metan CH 4. Se figur 7.
Figur 7. Tredimensjonale modeller av molekylene HCl (a), H 2 O (b), NH 3 (c) og CH 4 (d)
Hvis vi skjematisk viser strukturen til disse molekylene, som betegner atomene til kjemiske elementer med deres tilsvarende symboler, og forbindelsen mellom dem med et segment,
vi får formler av følgende form, kalt strukturelle:
 Figur 8. Strukturformler for henholdsvis hydrogenklorid, vann, ammoniakk og metanmolekyler
Figur 8. Strukturformler for henholdsvis hydrogenklorid, vann, ammoniakk og metanmolekyler
Fra strukturformlene presentert i figur XX kan vi konkludere med at valensen til hydrogen og klor er I, oksygen er II, nitrogen er III og karbon er IV.
Valensen til kjemiske elementer i forbindelser er vanligvis indikert med et hevet skrift til høyre for symbolet til det kjemiske elementet, eller over det, som det for eksempel gjøres nedenfor:
Noen elementer er preget av konstant valens, det vil si at i forbindelser er deres valens alltid lik samme tall.
Så for eksempel observeres en konstant valens lik en for en rekke metaller kalt alkali - litium, natrium, kalium, rubidium og cesium. En konstant valens lik to er observert for oksygen, magnesium, kalsium, strontium, barium. sink. En konstant valens på tre observeres for aluminium Al.
Elementer med variabel valens er elementer som i forskjellige forbindelser kan ha forskjellige betydninger valens. Følgelig kan atomene til disse elementene i forskjellige forbindelser danne forskjellige tall kjemiske bindinger(Tabell 2).
Tabell 2. De mest typiske valensverdiene for noen elementer
| Kjemiske elementer | Deres viktigste valenser |
| Cl, Br, I | I, III, V, VII |
| S, Se | II, IV, VI |
| C, Si, Sn, Pb | II, IV |
| III, V |
|
| I, II |
|
| II, III |
|
| II, III, VI |
Ofte, for å bestemme valensen til slike elementer i hvert enkelt tilfelle, kan den såkalte valensregelen hjelpe, ifølge hvilken, i forbindelser dannet av bare to kjemiske elementer, produktet av valensen til ett kjemisk element med antallet av dets atomer i molekylet er nesten alltid lik produktet av valensen med antall atomer i molekylet til det andre elementet. Med andre ord, for et stoff hvis formel er generelt syn kan skrives som AxBy med valensene til elementene A og B lik henholdsvis n og m, uttrykket er gyldig:
X*n = y*m
La oss bruke et eksempel for å fastslå valensen til svovel i forbindelsene SO 2 (svoveldioksid) og Al 2 S 3 (aluminiumsulfid). Som nevnt ovenfor er oksygen og aluminium elementer med konstante valenser. For oksygen er valensen i alle forbindelsene to, og for aluminium er den tre.
La oss beregne valensen til svovel i svoveldioksid, og betegne det som "x":
La oss på samme måte beregne valensen til svovel i aluminiumsulfid:

Det skal bemerkes at valensregelen ikke gjelder for noen forbindelser der det er bindinger mellom atomer av samme kjemiske element. Spesielt kan valensregelen ikke brukes når det gjelder en forbindelse som hydrogenperoksid siden dens strukturelle formel kan skrives som H-O-O-H, det vil si at i hvert molekyl av denne forbindelsen er det en oksygen-oksygenbinding.
Åpenbart kan valensregelen brukes ikke bare for å finne valensen til et element, men også for å kompilere en formel for en forbindelse hvis valensene til dets bestanddeler er kjent.
Tenk på følgende problem som et eksempel:
Bestem formelen til en forbindelse dannet av klor- og oksygenatomer, hvis valensen til klor i denne forbindelsen er VII.
Løsning:
Oksygen har bare én valensverdi, lik to, så vi kan skrive:
Minste felles multiplum (LCM) av 7 og 2 er 14.
Indeksen relatert til klor vil være x = 14:7 = 2,
Indeksen relatert til oksygen vil være y = 14:2 = 7.
De. den ønskede formelen er Cl 2 O 7.
Det skal bemerkes at i de fleste komplekse stoffer atomer av samme kjemikalie er ikke koblet til hverandre, for eksempel:
Figur 9. Strukturformler for molekyler av fosforsyre, fosfin, svovelsyre og kloroksid (VII)
Strukturelle formler
Valens teori spilt viktig rolle i utviklingen av teorien om kjemi generelt og organisk kjemi spesielt. Basert på teorien om valens antok Kekule at karbonatomet er fireverdig, og i 1858 forsøkte han, basert på denne antakelsen, å forestille seg strukturen til de enkleste organiske molekylene og radikalene. I samme 1858 foreslo den skotske kjemikeren Archibald Scott Cooper (1831-1892) å skildre kreftene som forbinder atomer (eller kommunikasjon, som de vanligvis kalles), i form av bindestreker. Etter at det første organiske molekylet ble "bygget", ble det helt klart hvorfor organiske molekyler har en tendens til å være mye større og mer komplekse enn uorganiske molekyler.
I følge Kekules ideer kan karbonatomer koble seg til hverandre ved hjelp av en eller flere av deres fire valensbindinger, og danner lange kjeder - rette eller forgrenede. Tilsynelatende har ingen andre atomer denne bemerkelsesverdige evnen i den grad karbon har den.
Så, forestill deg at hvert karbonatom har fire valensbindinger, og hvert hydrogenatom har en slik binding, kan vi skildre tre enkleste hydrokarbon(forbindelser hvis molekyler kun dannes av karbon- og hydrogenatomer), metan CH 4, etan C 2 H 6 og propan C 3 H 8, som følger:
Ved å øke antallet karbonatomer kan denne sekvensen fortsettes, nesten på ubestemt tid. Ved å tilsette oksygen (to valensbindinger) eller nitrogen (tre valensbindinger) til hydrokarbonkjeden, kan man forestille seg strukturformlene til molekylene etylalkohol (C 2 H 6 O) og metylamin (CH 5 N):
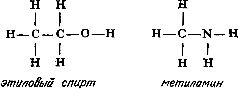
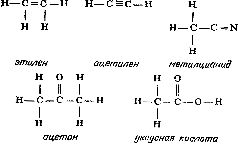
Anta muligheten for to bindinger mellom naboatomer ( dobbeltbinding) eller tre bindinger ( trippelbinding ), kan du skildre strukturformlene til forbindelser som etylen (C 2 H 4), acetylen (C 2 H 2), metylcyanid (C 2 H 3 N), aceton (C 3 H 6 O) og eddiksyre ( C 2 H 4 O 2):
Nytten av strukturformlene var så åpenbar at mange organiske kjemikere tok dem i bruk umiddelbart. De erklærte fullstendig foreldet alle forsøk på å fremstille organiske molekyler som strukturer bygget av radikaler. Som et resultat ble det funnet nødvendig, når man skrev formelen til en forbindelse, å vise dens atom struktur.
Den russiske kjemikeren Alexander Mikhailovich Butlerov (1823-1886) brukte dette nye systemet med strukturformler i sin teori om strukturen til organiske forbindelser. På 60-tallet av forrige århundre viste han hvordan man ved hjelp av strukturformler tydelig kan forklare årsakene til eksistensen av isomerer (se kapittel 5). For eksempel har etylalkohol og dimetyleter den samme empiriske formelen C 2 H 6 O, men strukturformlene til disse forbindelsene varierer betydelig:
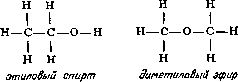
så det er ikke overraskende at en endring i arrangementet av atomer resulterer i to sett med svært forskjellige egenskaper. I etylalkohol er ett av de seks hydrogenatomene festet til et oksygenatom, mens i dimetyleter er alle seks hydrogenatomene festet til karbonatomer. Oksygenatomet holder hydrogenatomet svakere enn karbonatomet, slik at natriummetall tilsatt etylalkohol erstatter hydrogenet (en sjettedel av totalen). Natrium tilsatt dimetyleter fortrenger ikke hydrogen i det hele tatt. Når man skal komponere strukturformler kan man altså la seg lede av kjemiske reaksjoner, og strukturformler kan på sin side bidra til å forstå essensen av reaksjonene.
Butlerov ga spesielt mye oppmerksomhet til en av typene isomeri, kalt tautomerisme(dynamisk isomerisme), der noen stoffer alltid fungerer som blandinger av to forbindelser. Hvis en av disse forbindelsene isoleres i sin rene form, vil den umiddelbart delvis transformeres til en annen forbindelse. Butlerov viste at tautomerisme er forårsaket av den spontane overgangen til et hydrogenatom fra et oksygenatom til et nabokarbonatom (og omvendt).
For å fullt ut bevise gyldigheten av systemet med strukturformler, var det nødvendig å bestemme strukturformelen benzen- et hydrokarbon som inneholder seks karbonatomer og seks hydrogenatomer. Det var ikke mulig å gjøre dette med en gang. Det så ut til at det ikke fantes en slik strukturell formel som, selv om den oppfyller kravene til valens, samtidig ville forklare den større stabiliteten til forbindelsen. De første versjonene av strukturformlene til benzen var veldig like formlene til noen hydrokarboner - svært ustabile forbindelser og ikke lik benzen i kjemiske egenskaper.
Kekule var igjen i stand til å løse dette problemet. En dag i 1865 (som han selv sier), var Kekule halvsov i en omnibus, og han drømte at han så atomer snurre seg i en dans. Plutselig var enden av en kjede forbundet med begynnelsen, og en roterende ring ble dannet. Og Kekule bestemte at dette skulle være strukturformelen til benzen. Inntil da ble strukturformler kun konstruert i form av lineære kjeder karbonatomer, men nå introduserte Kekule konseptet med en "ring" (eller "kjerne") av karbonatomer og foreslo følgende strukturformel for benzen:

Denne forklaringen ble akseptert, og ideen om strukturformler utvidet.
Side 1
Strukturformelen viser at det ikke er noen dobbeltbindinger i cyklopafinmolekyler som kan føre til addisjon. Det siste er imidlertid mulig for noen cykloparaffiner, nemlig de som inneholder tre eller fire karbonatomer i ringen.
Strukturformel - en formel som brukes til å representere et molekyl, som indikerer bindingene mellom atomer. Den snakker ikke bare om sammensetningen, men også om strukturen til molekylet, men gir ikke en ide om det romlige arrangementet av atomer.
Strukturformler avledet fra kjemiske egenskaper dets reaksjoner av organiske forbindelser kan bekreftes ved syntese.
Strukturformelen viser bare hvilke atomer som er knyttet til hverandre, men sier ingenting om deres relative plassering i rommet. Formlene I og II indikerer bare at det representerte molekylet består av et karbonatom bundet til to hydrogenatomer og to kloratomer.
Strukturformler, vurdert i lys av elektronisk teori, kan ha et fritt elektronpar, og dermed kan forbindelser som tilsvarer disse formlene bli angrepet av elektrofile reagenser; et elektronpar som binder forskjellige atomer forskyves mot det mer elektrontiltrekkende (elektronegative) atomet. Bindingen har dermed en viss grad av polaritet og er i denne forstand mottakelig for angrep av både elektrofile og nukleofile reagenser. I metylklorid, for eksempel, har karbonatomet en delvis positiv ladning, og kloratomet har en delvis negativ ladning. Tilsvarende viser karbon-hydrogenbindingen en lav grad av polaritet.
Strukturformelen til CnH2nXY er et tre med n fire-kanter og 2n 2 endepunkter. De siste er delt inn i 3 klasser: 2n forholder seg til H-atomer, en til X og en til Y. Betrakt i dette treet en bane som forbinder X og Y, la oss betegne med m antall C-atomer som ligger på denne banen.
Strukturformelen for en slik forbindelse er en C - R-graf med et forbindelsesnummer μ (se avsnitt.
Strukturformler hjalp kjemikere med å analysere strukturen til visse nødvendig for en person naturlige forbindelser, og syntetisere dem eller lignende forbindelser i deres laboratorier. Naturlige stoffer som var sjeldne, dyre eller vanskelige å få tak i, kunne enkelt produseres i laboratoriet.
Strukturformler kan beskrive ikke bare variantdesign, men også design med en skiftende struktur i løpet av arbeidsprosessen.
Strukturelle formler avslører de viktigste, direkte forbindelsene og sterke kjemiske interaksjoner i et molekyl, som karakteriserer dets hovedtrekk kjemisk struktur og reaktivitet.
Strukturformelen representerer den øyeblikkelige tilstanden til en krets eller node i det øyeblikket utgangen eller mellomelementet utløses når kretsen påvirkes av påføring eller fjerning av et signal, for eksempel eksitering av et gulvrelé når en knapp trykkes inn .
Strukturformler gjenspeiler ikke den fulle kompleksiteten til strukturen til molekylet; de representerer bare skjematisk kombinasjonen av atomer eller ioner ved valens.
Strukturformelen og selv navnet karboksyl indikerer at denne gruppen består av en karbonylgruppe CO og en hydroksygruppe - OH. Imidlertid manifesteres ikke keton- eller aldehydkarakteristikken for CO-gruppen i karboksyl. Oksygenatomene i karboksyl er nøyaktig de samme. Dette bekreftes ved å studere de fysiske egenskapene til karboksylsyrer og deres røntgenspektra.
Strukturformler, konstruert fra klassiske atommodeller, inneholder informasjon om rekkefølgen av atomer i det tilsvarende molekylet koblet til kovalente bindinger, om mangfoldet av disse forbindelsene i heltallstilnærmingen og om de romlige konfigurasjonene som bestemmer geometrisk isomeri. Presentert i form av romlige projeksjonsformler, gjør de det mulig å formidle informasjon om stereoisomerisme av enhver type. Følgelig har hver enkelt organisk forbindelse en helt spesifikk strukturformel.
Strukturformler er basert på eksperimenter i transformasjonen av noen organisk materiale til andre. Det er ofte nødvendig å utføre ikke ett eksperiment, men flere, noen ganger ganske komplekse. I tillegg, som vi skal se senere, viser ikke alle eksperimenter seg å være egnet for å utlede en strukturformel.













