Переваривание белка. Особенности процесса усвоения пищевых продуктов
Все пищевые продукты, главным образом, состоят из белков, углеводов и липидов. В процессе пищеварения в желудочно-кишечном тракте млекопитающих три основных компонента пищи: углеводы, жиры и белки подвергаются ферментативному гидролизу, распадаясь при этом на составляющие строительные блоки, из которых они образованы. Этот процесс необходим для утилизации пищевых продуктов, поскольку клетки, выстилающие кишечник, способны всасывать в кровоток только относительно небольшие молекулы. Усвоение полисахаридов и даже дисахаридов становится возможным только после их полного гидролиза пищеварительными ферментами до моносахаридов. Аналогичным образом белки и липиды также должны быть гидролизованы до блоков, из которых они построены.
Процесс пищеварения начинается с ротовой полости и желудка, тогда как конечные этапы переваривания всех основных компонентов пищи и всасывание в кровь составляющих их структурных блоков происходят в тонком кишечнике. Анатомически тонкий кишечник хорошо приспособлен для выполнения этой функции, поскольку он обладает очень большой площадью поверхности, через которую происходит всасывание. Тонкий кишечник характеризуется не только большой длиной ≈ 4,5 м), но также наличием на его внутренней поверхности множества складок с большим количеством пальцевидных выступов, называемых ворсинками. Каждая ворсинка покрыта эпителиальными клетками, несущими многочисленные микроворсинки. Ворсинки создают огромную поверхность, через которую продукты переваривания быстро транспортируются в эпителиальные клетки, а из них – в капилляры кровеносной системы и в лимфатические сосуды, расположенные в стенке кишечника. Площадь поверхности тонкого кишечника человека составляет ≈ 180 м 2 , т.е. лишь немногим меньше игровой площадки теннисного корта.
В микроворсинках содержатся пучки актиновых микрофиламентов, соединенных в основаниях микроворсинок с сетью миозиновьк нитей. Эта система нитей обеспечивает волнообразные колебания микроворсинок, благодаря которым происходит местное перемешивание и лучшее всасывание переваренных питательных веществ.
Усвоение белков
Белки пищи расщепляются ферментами в желудочно-кишечном тракте до составляющих их аминокислот (рис. 1.1). Белки, поступающие в желудок, стимулируют выделение гормона гастрина, который в свою очередь вызывает секрецию соляной кислоты обкладочными клетками желез слизистой желудка, а также пепсиногена главными клетками. Желудочный сок имеет рН от 1,5 до 2,5. Благодаря такой кислотности он действует как антисептик, убивая большинство бактерий и других клеток. Кроме того, в условиях низкого рН желудочного сока глобулярные белки подвергаются денатурации, их молекулы разворачиваются и вследствие этого внутренние пептидные связи полипептидных цепей становятся более доступными для ферментативного гидролиза. Пепсиноген, являющийся неактивным предшественником фермента, или зимогеном, превращается в желудочном соке в активный пепсин в результате ферментативного действия самого пепсина, т.е. путем автокатализа. В ходе этого процесса с N-конца полипептидной цепи пепсиногена отщепляются 42
|
Активность |
|
|
(К. Ф. 3.4.4.1) |
Tyr , Phe , Tгр , Leu , Glu , Gln |
|
(К. Ф. 3.4.4.4) |
Атакует пептидные связи образованные: Lys , Arg |
|
Химотрипсин (К. Ф. 3.4.4.5) |
Атакует пептидные связи образованные: Tyr , Phe , Tr p |
|
Карбоксипептидаза (К. Ф. 3.4.2.1) |
Последовательное отщепление С-концевых остатков |
|
Аминопептидаза (К. Ф. 3.4.1.1) |
Последовательное отщепление N-концевых остатков |
Рис. 1.1. – Переваривание белков: 1 – протеолитические ферменты
аминокислотных остатка в виде смеси коротких пептидов. Остающаяся интактной остальная часть молекулы пепсиногена представляет собой ферментативно активный пепсин (К. Ф. 3.4.4.1). В желудке пепсин гидролизует те пептидные связи в белках, которые образованы ароматическими аминокислотами: тирозином, фенилаланином и триптофаном, а также рядом других; в итоге из длинных полипептидных цепей образуется смесь более коротких пептидов.
Как только кислое содержимое желудка попадает в тонкий кишечник, в нем под влиянием низкого рН начинается секреция гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник бикарбоната, что приводит к нейтрализации НС1 желудочного сока. В результате рН резко возрастает от 1,5–2,5, до ≈ 7. В тонком кишечнике переваривание белков продолжается. Поступление аминокислот в двенадцатиперстную кишку вызывает освобождение гормона холецистокинина, который стимулирует секрецию нескольких ферментов поджелудочной железы с оптимумом рН около 7. Три из них: трипсин (К. Ф. 3.4.4.4), химотрпсин (К. Ф. 3.4.4.5) и карбоксипептидаза (К. Ф. 3.4.2.1) – вырабатываются экзокринными клетками поджелудочной железы в виде ферментативно неактивных зимогенов: трипсиногена, химотрипсиногена и прокарбоксипептидазы, соответственно. Благодаря синтезу протеолитических ферментов в виде неактивных предшественников экзокринные клетки не подвергаются разрушению этими ферментами. Попав в тонкий кишечник, трипсиноген, под действием энтерокиназы, специализированного протеолитического фермента, секретируемого клетками кишечного эпителия, превращается в активную форму – трипсин. Свободный трипсин по мере своего образования также участвует в каталитическом превращении трипсиногена в трипсин. Образование свободного трипсина обусловлено отщеплением гексапептида от N-конца полипептидной цепи трипсиногена.
Активный центр трипсина состоит из трех аминокислотных остатков: серин-195 (принято, что нумерация аминокислотных остатков в трипсине соответствует их положениям в проферменте), гистидин-57 и аспарагиновая кислота-102. Сорбционный участок содержит карбоксильную группу аспарагиновой кислоты-189, которая определяет специфичность трипсина к положительно заряженным субстратам. Механизм каталитического гидролиза включает стадию сорбции субстрата, расщепления пептидной связи с образованием ацилфермента и переноса ацильной группы на нуклеофильный акцептор. Трипсин гидролизует пептидные связи, образованные с участием карбонильных групп лизина и аргинина.
Молекула химотрипсиногена представляет собой одну полипептидную цепь с несколькими внутрицепочечными дисульфидными связями. Попав в тонкий кишечник, химотрипсиноген превращается в химотрипсин под действием трипсина, который разрывает длинную полипептидную цепь химотрипсиногена в двух местах, выстригая дипептиды. Три фрагмента, образовавшиеся из исходной цепи химотрипсиногена, удерживаются, однако, вместе посредством перекрестных дисульфидных связей. Химотрипсин гидролизует пептидные связи, образованные остатками фенилаланина, тирозина и триптофана. Следовательно, трипсин и химотрипсин расщепляют полипептиды, образовавшиеся в желудке под действием пепсина, на пептиды меньшей величины. Этот этап переваривания белков протекает с очень высокой эффективностью, поскольку пепсин, трипсин и химотрипсин проявляют при гидролизе полипептидных цепей разную специфичность в отношении пептидных связей, образованных разными аминокислотами.
Деградация коротких пептидов в тонком кишечнике осуществляется другими пептидазами. К ним относится в первую очередь карбоксипептидаза – цинксодержащий фермент, синтезируемый в поджелудочной железе в виде неактивного зимогена прокарбоксипептидазы. Активный центр карбоксипептидазы имеет форму кармана, в полости которого находится атом Zn. В активный центр входят также остатки глутаминовой кислоты, тирозина и аргинина. Функция последнего в механизме катализа – связывание С-концевой карбоксильной группы. Карбоксипептидаза последовательно отщепляет от пептидов С-концевые остатки.
Тонкий кишечник секретирует также аминопептидазу (К. Ф. 3.4.1.1), отщепляющую от коротких пептидов один за другим N-концевые остатки.
В результате последовательного действия этих протеолитических ферментов и пептидаз перевариваемые белки в конечном итоге превращаются в смесь свободных аминокислот, которые далее транспортируются через эпителиальные клетки, выстилающие тонкие кишки. Свободные аминокислоты проникают в капилляры ворсинок и переносятся кровью в печень.
В желудочно-кишечном тракте человека не все белки перевариваются целиком. Большинство животных белков почти полностью гидролизуются до аминокислот, однако ряд фибриллярных белков, например кератин, переваривается только частично. Многие белки растительной пищи, в частности белки зерен злаков, неполностью расщепляются в силу того, что белковая часть семян и зерен покрыта неперевариваемой целлюлозной оболочкой (шелухой).
Известно редкое заболевание стеаторрея (упорный понос), при котором ферменты кишечника не способны переваривать определенные водорастворимые белки зерна, в частности глиадин, повреждающий эпителиальные клетки кишечника. Из пищи таких больных исключают зерновые продукты. Другим заболеванием, связанным с отклонением от нормы активности протеолитических ферментов пищеварительного тракта, является острый панкреатит. При этом заболевании, обусловленном нарушением процесса выделения сока поджелудочной железы в кишечник, предшественники протеолитических ферментов (зимогены) превращаются в соответствующие каталитически активные формы слишком рано, будучи еще внутри клеток поджелудочной железы.
В результате эти мощные ферменты воздействуют на ткань самой железы, вызывая глубокое и очень болезненное разрушение органа, что может привести к смертельному исходу. В норме зимогены, выделяемые поджелудочной железой, не активируются до тех пор, пока не попадут в тонкий кишечник. Поджелудочная железа защищается от самопереваривания и другим путем: в ней синтезируется особый белок – специфический ингибитор трипсина. Поскольку свободный трипсин активирует не только трипсиноген и химотрипсиноген, но также и зимогены двух других пищеварительных ферментов: прокарбоксипептидазу и проэластазу, ингибитор трипсина успешно предотвращает преждевременное образование свободных протеолитических ферментов в клетках поджелудочной железы.
Усвоение углеводов
У человека из углеводов перевариваются в основном полисахариды: крахмал и целлюлоза, содержащиеся в растительной пище. Крахмал полностью расщепляются ферментами желудочно-кишечного тракта до составляющих их структурных блоков, а именно свободной D -глюкозы (рис. 1.2). Этот процесс начинается во рту во время пережевывания пищи благодаря действию фермента амилазы, выделяемого слюнными железами. Амилаза слюны гидролизует многие из α-(1→4)-гликозидных связей в крахмале и в гликогене. При этом образуется смесь, состоящая из мальтозы, глюкозы и олигосахаридов.
Переваривание крахмала и других усвояемых полисахаридов с образованием D -глюкозы продолжается и завершается в тонком кишечнике, главным образом, под действием амилазы поджелудочной железы, которая синтезируется в поджелудочной железе и поступает через проток поджелудочной железы в верхний отдел тонкого кишечника. Этот отдел тонкого кишечника с наиболее высокой пищеварительной активностью называется двенадцатиперстной кишкой.
Целлюлоза у большинства млекопитающих не подвергается ферментативному гидролизу и не используется из-за отсутствия ферментов, способных расщеплять β-(1→4)-связи между последовательными остатками D -глюкозы в целлюлозе. Вместе с тем непереваренная целлюлоза из растительной пищи создает ту массу (называемую иногда «клетчаткой» или «грубым кормом»), которая способствует нормальной перистальтике кишечника. У жвачных животных целлюлоза подвергается перевариванию, но не прямым путем, а под действием бактерий, находящихся в их рубце (желудке). Эти бактерии гидролизуют целлюлозу до D -глюкозы и далее сбраживают D -глюкозу до лактата, ацетата и пропионата, которые всасываются и поступают в кровь. Далее лактат и пропионат в печени жвачных превращаются в сахар крови.
Гидролиз дисахаридов катализируют ферменты, находящиеся в наружном крае эпителиальных клеток, выстилающих тонкий кишечник. Сахароза, или тростниковый сахар, гидролизуется с образованием D -глюкозы и D -фруктозы под действием сахаразы, называемой также инвертазой (К. Ф. 3.2.1.26); лактоза гидролизуется до D -глюкозы и D -галактозы под действием лактазы, называемой также β-галактозидазой (К. Ф. 3.2.1.23); в результате гидролиза мальтозы под действием мальтазы образуются две молекулы D -глюкозы. Многим представителям азиатских и африканских рас во взрослом состоянии свойственна непереносимость лактозы, обусловленная исчезновением в их тонком кишечнике лактазной активности, имевшейся в грудном и детском возрасте. У людей с непереносимостью лактозы этот сахар остается в кишечнике в нерасщепленном виде и часть его подвергается сбраживанию под действием микроорганизмов. Это вызывает диаррею и образование газов в кишечнике.
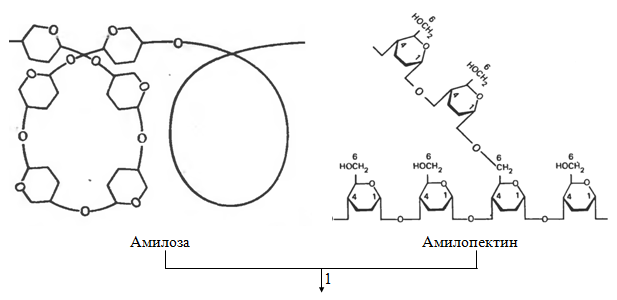
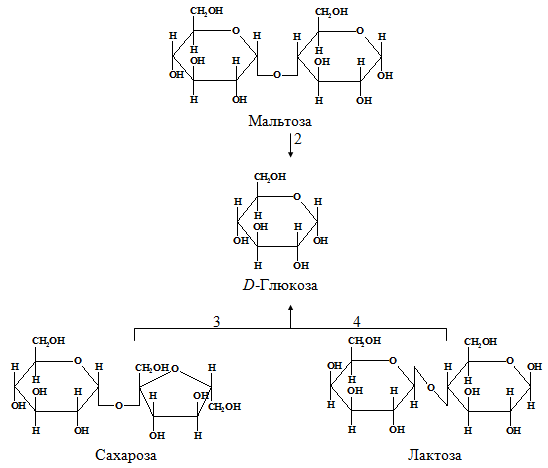
Рис. 1.2. – Переваривание углеводов: 1 и 2 – амилолитические ферменты; 3 – сахараза (К. Ф. 3.2.1.26); 4 – лактаза (К. Ф. 3.2.1.23)
В эпителиальных клетках, выстилающих тонкий кишечник, D -фруктоза, D -raлактоза и D -манноза частично превращаются в D -глюкозу. Смесь всех этих простых гексоз поглощается эпителиальными клетками, выстилающими тонкий кишечник, и доставляется кровью в печень.
Усвоение жиров
Переваривание триацилглицеролов (нейтральных жиров) начинается в тонком кишечнике, куда из поджелудочной железы поступает зимоген пролипаза. Здесь пролипаза превращается в активную липазу (К. Ф. 3.1.1.3), которая в присутствии желчных кислот и специального белка, называемого колипазой, присоединяется к капелькам триацилглицеролов и катализирует гидролитическое отщепление одного или обоих крайних жирнокислотных остатков с образованием смеси свободных жирных кислот в виде их Na + - или К + -солей (мыл) и 2-моноацилглицеролов. Небольшое количество триацилглицеролов остается при этом негидролизованным (рис. 1.3).

Жирные кислоты
Рис. – 1.3. Переваривание липидов: 1 – липаза (К. Ф. 3.1.1.3), желчные кислоты, Na +
Образовавшиеся мыла и нерасщепленные ацилглицеролы эмульгируются в виде мелких капелек под действием перистальтики (перемешивающие движения кишечника), а также под влиянием солей желчных кислот и моноацилглицеролов, которые являются амфипатическими соединениями и потому функционируют как детергенты. Жирные кислоты и моноацилглицеролы из этих капелек поглощаются кишечными клетками, где из них в основном вновь синтезируются триацилглицеролы. Далее триацилглицеролы проникают не в капилляры крови, а в небольшие лимфатические сосуды кишечных ворсинок – лактеали (иначе – млечные, или хилёзные, сосуды). Оттекающая от тонких кишок лимфа, называемая хилус (млечный сок), после переваривания жирной пищи напоминает по виду молоко из-за обилия взвешенных в ней хиломикронов – мельчайших капелек эмульгированных триацилглицеролов диаметром около 1 мкм. Хиломикроны имеют гидрофильную оболочку, состоящую из фолипидов и специального белка, который удерживает хиломикроны во взвешенном состоянии. Хиломикроны проходят через грудной проток в подключичную вену. После потребления жирной пищи даже плазма крови становится опалесцирующей из-за высокой концентрации в ней хиломикронов, но эта опалесценция исчезает через 1–2 ч, т.к. триацилглицеролы выводятся из крови, поступая главным образом в жировую ткань.
Эмульгированию и перевариванию липидов в тонком кишечнике способствуют соли желчных кислот. Соли желчных кислот человека – это в основном гликохолат натрия и таурохолат натрия, обе они являются производными холевой кислоты, которая количественно преобладает среди четырех основных желчных кислот, присутствующих в организме человека. Соли желчных кислот являются мощными эмульгаторами; они поступают из печени в желчь, которая изливается в верхний отдел тонкого кишечника. После завершения всасывания жирных кислот и моноацилглицеролов из эмульгированных капелек жира в нижнем отделе тонкого кишечника происходит обратное всасывание также и солей желчных кислот, способствовавших этому процессу. Они возвращаются в печень и используются повторно. Таким образом, желчные кислоты постоянно циркулируют между печенью и тонким кишечником.
Желчные кислоты играют исключительно важную роль в усвоении не только триацилглицеролов, но и вообще всех жирорастворимых компонентов пищи. Если желчные кислоты образуются или секретируются в недостаточном количестве, как это имеет место при ряде заболеваний, то непереваренные и непоглощенные жиры появляются в кале. При этом ухудшается всасывание жирорастворимых витаминов A, D, Е и К и может возникнуть пищевая недостаточность витамина А.
Расщепленные питательные вещества попавшие в кровь транспортируются в печень. В клетках печени – гепатоцитах глюкоза, аминокислоты и свободные жирные кислоты включаются в обменные процеесы организма.
Таким образом, процесс усвоение пищевых продуктов у млекопитающих осуществляется в желудочно-кишечном тракте и основан на ферментативно-кислотном гидролизе:
· полисахаридов (крахмала и целлюлозы) до ди- и моносахаридов,
· белков до аминокислот,
· липидов до жирных кислот, с последующим всасыванием клетками тонкого кишечника в кровь, поступлением с кровотоком в печень и включением в обменные процессы организма.
в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
А. Переваривание белков в желудке
Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В 12 , предотвращает его разрушение и способствует всасыванию.
1. Образование и роль соляной кислоты
Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гастринов (см. раздел 11), которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. НСI образуется в обкладочных клетках желудочных желёз в ходе реакций, представленных на рис. 9-2.
Источником Н + является Н 2 СО 3 , которая образуется в обкладочных клетках желудка из СО 2 , диффундирующего из крови, и Н 2 О под действием фермента карбоангидразы (карбонатдегидра-тазы):
Н 2 О + СО 2 → Н 2 СО 3 → НСО 3 - + H +
Диссоциация Н 2 СО 3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1 - , и ионов Н + , которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н + /К + -АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 10 6 раз. Ионы С1 - поступают в просвет желудка через хлоридный канал.
Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Приём белковой пищи часто сопровождается выделением щелочной мочи за счёт секреции большого количества бикарбоната в процессе образования НСl.
Рис. 9-2. Секреция соляной кислоты в желудке. 1 - карбоангидраза; 2 - Н + /К + - АТФ-аза; 3 - белки-переносчики анионов; 4 - хлоридный канал.
Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
2. Механизм активации пепсина
Под действием гастринов в главных клетках желудочных желёз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (молекулярная масса 32,7 кД) с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты.
3. Возрастные особенности переваривания белков в желудке
У детей грудного возраста в желудке находится фермент реннин (химозин) , вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са 2+ , образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина.
В слизистой оболочке желудка человека найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника.
4. Нарушения переваривания белков в желудке
При различных заболеваниях ЖКТ в желудке нарушается выделение НСl и пепсиногена, при этом переваривание белков заметно снижается. Наиболее часто встречаются патологические изменения кислотности желудочного сока. Нарушение образования пепсина отмечают реже и выявляют при более значительных поражениях желудка.
Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка (табл. 9-2). Повышенная кислотность желудочного сока обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность бывает при некоторых видах гастритов. Полное отсутствие НСl и пепсина (желудочная ахилия) наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания-витамина В 12 (см. раздел 3). Анацидность (рН желудочного сока >6,0) свидетельствует о значительной потере слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка.
Кислотность желудочного сока выражается в титрационных единицах (ТЕ) - количество 0,1 М NaOH в 1 мл, затраченное на титрование 100 мл желудочного сока по определённому индикатору. При определении кислотности желудочного сока различают: общую кислотность, связанную НСl и свободную НСl.
- Общая кислотность желудочного сока - совокупность всех кислотореагирующих веществ желудочного сока, представляет собой секрет желудка, собираемый в течение 1 ч.
Таблица 9-2. Компоненты желудочного сока в норме и при патологических состояниях
| Состояние | рН | Кислотность (ТЕ) | Пепсин | Фактор Касла | Молочная кислота | Кровь | ||
| общая | связанная НСl | свободная НСl | ||||||
| Норма | 1,5-2,0 | 40-60 | 20-30 | 20-40 | + | + | - | - |
| Гиперацидный гастрит | 1,0 | 80 | 40 | + | ± | - | - | |
| Гипоацидный гастрит | 2,5 | 40 | 20 | ± | ± | ± | - | |
| Ахилия | 7,0 | 20 | - | - | - | + | - | |
| Язва желудка | 1,5 | 60 | 40 | + | + | - | + | |
| Рак желудка | 6,0 и> |
40-60 | 20 | + | + | + | + | |
Значения общей кислотности в норме составляют 40-60 ТЕ.
- Связанная соляная кислота - НСl, связанная с белками и продуктами их переваривания. Значения связанной НСl у здоровых людей - 20-30 ТЕ.
- Свободная НСl - соляная кислота, не связанная с компонентами желудочного сока. Значения свободной НСl в норме - 20-40 ТЕ. рН желудочного сока в норме - 1,5-2,0.
Молочная кислота в норме в желудочном соке отсутствует. Она образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате размножения молочнокислых бактерий или при злокачественных опухолях желудка, в клетках которых глюкоза окисляется анаэробным путём.
При диагностике заболеваний желудка, кроме биохимических анализов, обязательно проводят рентгенологические и эндоскопические исследования, а также биопсию.
Б. Переваривание белков в кишечнике
Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО 3 - , что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0.
Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина (см. раздел 11), который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
1. Активация панкреатических ферментов
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В.
Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы.
Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп) 4 -Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп) 4 -Лиз присуща большинству известных трипсиноге-нов разных организмов - от рыб до человека.
Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов (рис. 9-3). Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между 15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Затем под действием π-химотрипсина отщепляется дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. Отщепление дипептида тре(147)-арг(148) завершает образование стабильной формы активного фермента - α-химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками.
Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три).
Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А

Рис. 9-3. Активация химотрипсиногена. Молекула химотрипсиногена состоит из 245 аминокислотных остатков и имеет пять дисульфидных мостиков. На схеме показаны участки фермента, подвергающиеся протеолизу. а-Химотрипсин - активная стабильная форма фермента - состоит из трёх полипептидных цепей, ковалентно связанных между собой двумя дисульфидными мостиками и нековалентно - за счёт водородных связей и гидрофобных взаимодействий.
отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина.
Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
- Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn 2+ - или Мn 2+ -содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам.
- Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
В. Защита клеток от действия протеаз
Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что:
- эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены.
- в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс.
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия.
Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены.
Г. Транспорт аминокислот в клетки
Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4). Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Nа + -зависимых механизмов симпорта, подобно переносу глюкозы (см. раздел 7).
Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует
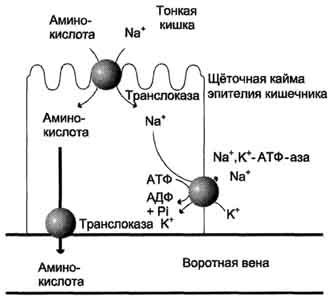
Рис. 9-4. Механизм всасывания аминокислот в кишечнике. L-аминокислота поступает в энтероцит путём симпорта с ионом Na + . Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Nа + ,К + -АТФ-азы.
для переноса определённой группы близких по строению аминокислот:
- нейтральных, с короткой боковой цепью (аланин, серии, треонин);
- нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин);
- с катионными радикалами (лизин, аргинин);
- с анионными радикалами (глутаминовая и аспарагиновая кислоты);
- иминокислот (пролин, оксипролин).
Причём к числу Nа + -зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na + переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин).
Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина.
Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла (рис. 9-5).
В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связан-ный фермент γ-глутамилтрансфераза. Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион представляет собой трипептид - γ-глутамилцистеинилглицин, который находится во всех тканях животных. Реакция протекает следующим образом (см. схему А на с. 468).
Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глутамильного

Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е 1 - γ-глутамилтрансфераза; Е 2 - у-глутамилциклотрансфераза; Е 3 - пептидаза; Е 4 - оксопролиназа; Е 5 - γ-глутамилцистеинсинтетаза; Е 6 - глутатионсинтетаза.
остатка под действием фермента γ-глутамилциклотрансферазы (см. схему Б).
Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ.
Д. Нарушение переваривания белков и транспорта аминокислот
Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию
таких пептидов. Продукты полностью переваренного белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают.
У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции. Очевидно, подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей.
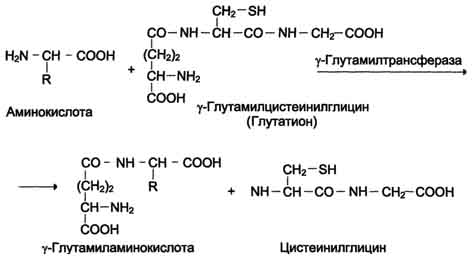
Схема А
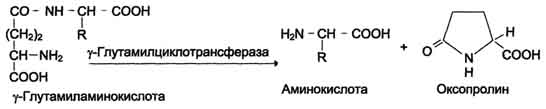
Схема Б
Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии (нетропической спру) происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен.
Такие заболевания, как цистинурия, болезнь Хартнапа и некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы (рис. 9-5, реакция 4). При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках.
Белки пищи в ротовой полости не расщепляются, так как слюна не содержит гидролитических ферментов.
Химическое расщепление белков начинается в желудке под воздействием протеолитических ферментов (пептидгидролаз), которые расщепляют пептидные связи между аминокислотами.
Эти ферменты образуются клетками слизистой оболочки желудка, тонкого кишечника и поджелудочной железы в неактивной форме. Такая форма ферментов предотвращает самопереваривание белков в клетках, где они синтезируются, и стенок желудочно-кишечного тракта (специально для тех, кто все еще бредит мыслями о том, что во время голодания желудок переваривает сам себя).
В желудке переваривание белков происходит при участии фермента желудочного сока пепсина, который образуется из неактивного пепсиногена под воздействием соляной кислоты. Пепсин проявляет максимальную ферментативную активность в сильно кислой среде при рН 1-2. Кроме того, под воздействием соляной кислоты происходит набухание и частичная денатурация белков, что приводит к увеличению поверхности соприкосновения фермента с белками. Все это облегчает процесс расщепления белков в желудке. Пепсин расщепляет пептидные связи белковых молекул, в результате чего образуются высокомолекулярные пептиды и простетические группы.
Белки, не расщепившиеся в тонком отделе кишечника, подвергаются расщеплению в толстом кишечнике под воздействием пептидаз, которые синтезируются находящейся здесь микрофлорой. Ферменты микрофлоры толстого кишечника способны расщеплять многие аминокислоты пищи с образованием различных токсичных веществ: фенола, крезола, индола, сероводорода, меркаптанов и др. Такое превращение аминокислот в толстом кишечнике называется гниением белков. Токсические вещества всасываются в кровь и доставляются в печень, где подвергаются обезвреживанию. Весь процесс переваривания белков в желудочно-кишечном тракте занимает в среднем 8-12 ч после принятия пищи.
Выводы
Источник
Из всего вышесказанного, следует очевидный вывод: употреблять углеводы вместе с белком нежелательно.
В желудке есть особый сфинктер, называется привратник желудка, и у него очень любопытная функция: отделять пилорическую часть желудка от ампулы двенадцатиперстной кишки и выполнять функцию регулятора поступления кислого желудочного содержимого в двенадцатиперстную кишку по мере её готовности к приёму следующих порций химуса (пищевой кашицы).
Так уж сложилось, что кислая среда желудка не меняется, как и щелочная среда кишечного сока. Поэтому, делая винегрет, вы обрекаете себя на один из следующих исходов:
1) Когда привратник желудка не пускает пищу в кишечник до тех пор, пока белок не перевариться, этим вы оттягиваете поступление глюкозы в кровь, и, что намного хуже, даете возможность углеводам забродить. Это грозит расщеплением углеводов на двуокись углерода, уксусную кислоту, спирт - вещества, не пригодные к усвоению.
2) Когда бОльшую часть съеденной пищи составляют углеводы, и тщательно перемешав их с белком, протаскиваете всё это дело в кишечник раньше времени, что обернется в дальнейшем гниением белка в толстом кишечнике. Желудок не знает механизма, чтобы разделять эти тщательно перемешанные вещества и разместить по разным частям своей полости.
То, что белковое гниение постоянно наблюдается в толстом кишечнике "цивилизованного" человека, еще не значит, что такое явление можно считать нормальным. А гниение - это вонючие испражнения, затрудненный стул, вздутый живот и газы.
Подводя итог, делать следует следующим образом:
· В первую очередь, съедать все углеводы, очень тщательно пережевывая, т.к. переваривание начнется еще в ротовой полости. Из-за кислой среды в желудке, углеводы надолго там не задержатся, к тому времени, когда вы приступе к белковой части, основная часть углеводов уже провалится в кишечник (для большей надежности, лучше сделать паузу 15-20 минут).
· Жиры, касается орехов, сдобных изделий и т.п., лучше употреблять с углеводами, потому что нужна щелочная среда и потому что липиды замедляют желудочную секрецию, тем самым тормозят пищеварение. В случае, когда жир нельзя отделить от белка, например масло используемое при приготовлении, купировать данный недуг можно сырыми зелеными овощами.
· Белки, соответственно, идут последним номером.
Разделив и употребив пищу в такой последовательности, вы убиваете трёх зайцев сразу:
1. занимаете кишечник органическими веществами, которые выполняют энергетическую функцию;
2. занимаете желудок главными носителями жизни;
3. и что немаловажно, таким способом можно тупо больше съесть (актуально на периодическом голодании).
Верить на слово учебнику физиологии, учебнику биохимии и уж тем более мне лично никого не призываю, просто попробуйте и составьте собственное мнение.













