Компоненты молекулы белка. Полярные положительно заряженные. Окисление высших жирных кислот
Минеральные вещества
К группе макроэлементов относятся такие, содержание которых в сухой субстанции варьирует от nּ10 -2 до nּ10 %. Это С, О, Н, N, S и Р, входящие в молекулярный состав основных веществ и Ca, Na, Cl, К, Mg, входящие в состав опорных тканей, крови, лимфы и др. тканей.
К группе ультрамикроэлементов относятся элементы, содержание которых ниже nּ10 -5 % (Sb, Нg, Вi, Рb и др.).
Установлено, что большинство элементов являются биогенными, имеющими огромное значение для обеспечения нормального развития биохимических жизненных процессов, причем наиболее важные биогенные элементы входят в IV (С); V (W, P) и VI (O, S) группы таблицы Менделеева. Элементы VII (Сl, J, Мn) и VIII (Fe, Со) группы участвуют в образовании веществ с высокой биологической ценностью.
Микроэлементный состав сырья зависит от среды обитания или произрастания. В зависимости от концентрации отдельных элементов в окружающей среде и в пище, доступности их, а также от избирательной способности отдельных видов организмов изменяется и степень использования отдельных элементов при процессах ассимиляции.
Белки
Из органических веществ, входящих в состав живых организмов, наиболее важным в биологическом отношении и наиболее сложными по структуре являются белки. Почти все проявления жизни (пищеварение, раздражительность, сократимость, рост и размножение, движение, обмен веществ и др.) связаны с белковыми веществами. Белки играют важную роль как в построении живой материи, так и в осуществлении процессов ее жизнедеятельности.
Специфические катализаторы белковой природы - ферменты - ускоряют химические реакции, протекающие в организме. Различные соединения белковой природы осуществляют транспортную функцию, снабжая организм кислородом и питательными веществами. Распад 1 г белка до конечных продуктов обеспечивает организм энергией 4,27 ккал.
Выделенные из органов и тканей белки при нагревании дают осадок белого цвета и обладают теми же физическими свойствами, как белок куриного яйца. Поэтому их стали называть белками. Синонимом слова "белок" является слово «протеин» (от греческого "протеус" - первый, главный).
Белки - это высокомолекулярные полимеры различных аминокислот. На рис. 1 представлены формулы различных аминокислот.
Рис.1. Формулы некоторых аминокислот.
Аминокислоты подразделяются на 2 большие группы: заменимые и незаменимые. Большинство аминокислот образуется в организме животных и человека в результате гидролиза белков пищи и биосинтеза. Но как минимум, восемь аминокислот не синтезируются в организме. Это валин, лейцин, изолейцин, треонин, лизин, фенилаланин, триптофан и метионин, называемые незаменимыми. Белки, в которых отсутствует одна или несколько этих аминокислот, называют биологически неполноценными. Животные белки, в том числе белки гидробионтов, содержат все незаменимые аминокислоты.
Аминокислоты, входящие в состав белка, соединяются между собой пептидными связями, образующимися между аминной группой одной аминокислоты и карбоксильной группой другой. Механизм этого процесса показан на рис. 2.
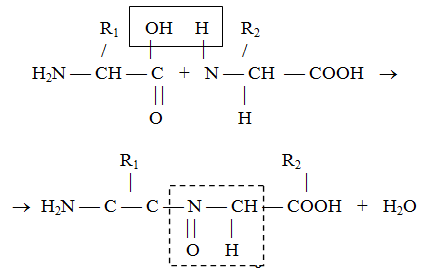
Рис. 2. Образование первичной структуры белка.
Образующиеся полипептиды являются основой всех белков, а заложенная в них определенная последовательность аминокислот характеризует первичную структуру белка.
Таким образом, поскольку макромолекулы белка построены из многих сотен аминокислот, в природе существует безграничное количество их изомеров, и каждый вид живых существ может иметь свой только ему присущий белок.
Полипептидные цепи в свою очередь могут соединяться, образуя вторичные структуры белка, главным образом за счет связей, возникающих между различными группами полипептидов. Это схематично показано на рис. 3.
![]()
а) образование водородных связей
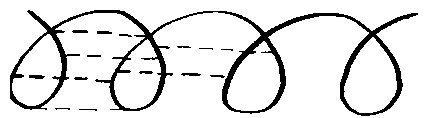
б) образование a-спирали из полипептидной цепочки
Рис. 3. Схема образования вторичной структуры белка.
Пространственное расположение полипептидных цепей молекулы белка определяет третичную структуру белковой молекулы.
Собственно белки - высокомолекулярные соединения сложной структуры, различаются как по физиологическим функциям, так и по химическим свойствам. Белки пищевого сырья находятся преимущественно в коллоидном состоянии – в виде гелей и золей, что предопределяет неустойчивость и изменчивость свойств (денатурацию) белковых веществ при изменении условий среды.
При подкислении белковых растворов до рН 4,5-5,0 (например, при мариновании) белки утрачивают растворимость и осаждаются (коагулируют). Многие белки утрачивают растворимость при насыщении растворов хлористым натрием (при посоле). В частности, основные мышечные белки, хорошо растворимые в растворах хлористого натрия концентрацией 7,5-10 %, при повышении его концентрации до 15 % осаждаются (высаливаются). При нагревании (во время варки, обжаривания, пропекания) белки свертываются (коагулируют). Термическая денатурация белков начинается с 28-35 о С. Денатурация белков имеет место и при обезвоживании (дегидратации) их систем (при сушке и замораживании).
При осаждении (высаливании, коагуляции) белков нарушается их связь с водой.
В результате пространственного трехмерного строения "на поверхности" белковой молекулы оказываются химически активные группы – NН 2 ; -COOH; - ОН. В водном растворе эти группы находятся в ионизированном состоянии с зарядами различного знака. Белковая молекула приобретает соответствующий знак и величину заряда в зависимости от соотношения положительно и отрицательно заряженных групп. Заряд белковой молекулы зависит от ее состояния. Всякое изменение структуры белковой молекулы приводит к изменению ее заряда, в частности, потеря заряда приводит к денатурации белка. Наличием этих зарядов обуславливаются также гидратные свойства белков. Например, к положительно заряженной белковой молекуле присоединяются молекулы воды своими отрицательно заряженными концами, и образуется структура, центром которой является белковая молекула, а вокруг нее находится мономолекулярная оболочка воды. Так как все отрицательно заряженные концы молекул воды обращены к белковой молекуле, то на поверхности структуры белок - вода сохраняется тот же заряд. К этой поверхности в свою очередь присоединяются новые группы молекул воды и т.д. При этом вокруг каждой молекулы белка образуется электростатически связанный гидратный слой. Сила связи с белком уменьшается пропорционально квадрату расстояния от центра, т.е. от белковой молекулы, и на достаточно большом в масштабах размеров молекулы расстоянии эта связь настолько мала, что собственное тепловое движение молекул препятствует действию электростатических сил. Это и ограничивает количество воды, удерживаемой поверхностью белка.
По существующим воззрениям белковую ткань можно рассматривать как коллоидное и капиллярно-пористое коллоидное тело очень сложного строения, основу которого составляет структурная сетка из находящихся в набухшем состоянии белков, заключающая вязкие растворы, содержащие растворимые белки и другие азотистые и минеральные вещества, которые обладают гидрофильными свойствами. При этом часть воды, входящей в состав мышечной ткани, прочно удерживается белками структурной сетки, а также молекулами растворенных белков и других гидрофильных веществ.
Наряду с водой, удерживаемой силовым полем на внешней и внутренней поверхности белковых частиц, в мышечной ткани присутствует вода, удерживаемая осмотически и силами механической связи (капиллярноудерживаемая вода). Эта вода находится в жидкостях (растворах), содержащих различные азотистые и органические вещества и минеральные соли, заключенные в замкнутых ячейках (микропорах) внутри белковых структур и пронизывающих последние микро- и макрокапиллярах. По имеющимся в литературе данным, 1 г белка при гидратации связывает в среднем 0,3 г воды.
Все методы обработки, технологические режимы направлены на изменение воды в тканях сырья (насыщение ее солью, превращение в лед, нагрев до температуры, близкой к температуре кипения, испарение). Изменение внутренней энергии воды приводит к нарушению равновесного состояния между белком и водой, образующей гидратную оболочку. Белковая молекула реагирует на это перестройкой собственной структуры и соответственно изменением величины заряда. Когда эти изменения завершаются резким снижением или полным исчезновением заряда наступает денатурация белка.
В зависимости от интенсивности и продолжительности внешнего воздействия денатурация белка может быть или обратимой, иди частично обратимой, или необратимой.
Глубину денатурации можно определить по способности мышечной ткани восстанавливать полностью или частично связь с водой.
Применяемые в настоящее время методы обработки пищевого сырья с высоким содержанием белка приводят в основном к изменениям, которые можно охарактеризовать как частичную денатурацию. Схема денатурации белковой молекулы представлена на рис. 4.
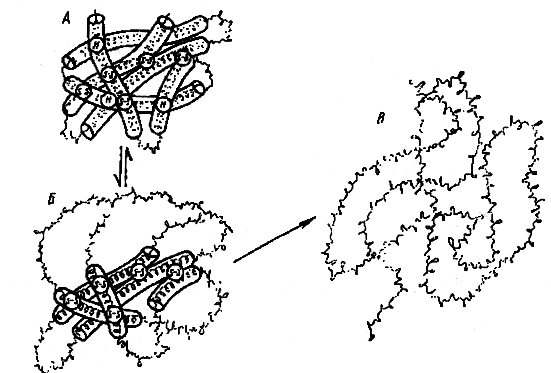
Рис. 4. Схема денатурации белковой молекулы:
А - исходное состояние, Б - начинающееся обратимое развертывание, В - далеко зашедшее необратимое развертывание.
Наиболее характерными изменениями белка при тепловой денатурации (температура 70-100°С) являются потеря им нативных свойств (способности растворяться в воде, растворах солей и спиртов), а также снижение способности к набуханию.
Изменения белка, связанные с тепловой денатурацией, тем значительнее, чем выше температура и продолжительность нагревания, действие давления, причем в водном растворе белок денатурирует быстрее, чем находясь в высушенном состоянии.
Денатурация белков играет важную роль в ряде технологических процессов: при выпечке хлеба, кондитерских изделий, при сушке мяса, рыбы, овощей, молока и яичного порошка, при изготовлении консервов и т.д.
В условиях доведения продукта до полной готовности обычно при продолжительном воздействии температур близких к 100°С, белки подвергаются дальнейшим изменениям, связанным с разрушением их макромолекул, - гидролизу.
В начале процесса от белковых молекул могут отщепляться летучие продукту: углекислый газ, сероводород, аммиак, фосфористый водород и другие вещества, участвующие в образовании вкуса и аромата готовых изделий. При длительном воздействии воды и тепла происходит образование водорастворимых азотистых веществ вследствие деполимеризации белковой молекулы, что имеет место, например, при переходе коллагена в глютин.
Гидролиз белков можно вызвать с помощью протеолитических ферментов, используемых для интенсификации некоторых технологических процессов (размягчение жесткого мяса, приготовление дрожжевого теста и др.).
1.1. БЕЛКИ. АМИНОКИСЛОТЫ -- СТРУКТУРНЫЕ КОМПОНЕНТЫ БЕЛКОВ
1.2. Строение и классификация аминокислот
1.3. Уровни структурной организации белковых молекул
1.4. Физико-химические свойства белков
1.5. КЛАССИФИКАЦИЯ БЕЛКОВ
1.6. Углеводы. Классификация углеводов
1.7. Липиды
1.8. Витамины
1.8.1. Жирорастворимые витамины
1.8.2. Водорастворимые витамины
1.8.3. ВИТАМИНОПОДОБНЫЕ ВЕЩЕСТВА.
2.1. Ферменты и неорганические катализаторы
2.2. Строение ферментов
2.3. Коферменты
2.4. Свойства ферментов
2.5. Номенклатура ферментов
2.6. Классификация ферментов
2.7. Механизм действия ферментов
2.8. Ингибирование ферментативной активности
3.1. Биологическая роль углеводов
3.2. Превращение углеводов в пищеварительном тракте
3.3. Биосинтез и распад гликогена
3.4. Основные пути катаболизма глюкозы
3.4.1. Анаэробный гликолиз
3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
3.4.3. Гексозомонофосфатный путь
3.4.4. Глюконеогенез
4.1. Основные липиды организма человека их биологическая роль.
4.2. Переваривание липидов, ресинтез жира
4.3. Липопротеины крови
4.4. Окисление высших жирных кислот
4.5. Окисление глицерина
4.6. Биосинтез ВЖК в тканях
4.7. Обмен холестерина
5.1. Переваривание белков
5.2. Гниение аминокислот, обезвреживание продуктов гниения
5.3. Метаболизм аминокислот
5.4. Пути обезвреживания аммиака
6.1. Сигнальные молекулы
6.2. Гормоны гипоталамуса
6.3. ГОРМОНЫ ГИПОФИЗА
6.4. ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
6.5. ГОРМОНЫ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
6.6. Гормоны половых желез
6.7. Гормоны надпочечников
6.8. Гормоны поджелудочной железы
1. Введение в биохимию
2. Ферменты
3. Обмен углеводов
4. Обмен липидов
5. Обмен белков
6. Регуляция обмена веществ
7. Экзаменационные вопросы
1.1. Белки. Аминокислоты -- структурные компоненты белков
БЕЛКИ
Белки – это азотсодержащие, высокомолекулярные органические соединения, состоящие из аминокислот, соединенных в цепи с помощью пептидных связей и имеющие сложную структурную организацию.
Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке.
Характерные признаки белков, отличающие их от других органических соединений клетки:
1 .Белки являются азотсодержащими соединениями, как многие другие компоненты клетки (нуклеиновые кислоты, некоторые липиды, углеводы), но в отличии от других органических вещества, содержание азота значительно больше – в среднем16 грамм на 100 грамм белка.
2.Структурной единицей белков являются альфа аминокислоты L-ряда.
3.Аминокислоты связаны в белках с помощью пептидных связей, образуя полипептидную цепь.
4.Белки имеют большую молекулярную массу (от 20000 до нескольких миллионов дальтон).
5.Отличаются белки сложной структурной организацией (имеют первичную, вторичную, третичную и четвертичную структуру).
МНОГООБРАЗНЫЕ ФУНКЦИИ БЕЛКОВ:
1.Каталитическая. Многие белки являются ферментами
2.Регуляторная. Некоторые гормоны являются белками
3.Структурная. Во все структуры живой клетки входят белки.
4.Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
5.Транпортная. Они транспортируют жиры, пигменты, гормоны, лекарственные вещества, различные гидрофобные соединения и др.
6.Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 г белка сопровождается выделением 17,6 кДЖ энергии. В сутки 15% энергии образуется за счёт распада белков.
8.Сократительная. Эту функцию выполняют белки мышечной ткани - актин, миозин.
9.Генно-регуляторная функция гистонов.
10.Иммунологическая. Антитела являются белками.
11 .Гемостатическая. Фибриноген и другие белки плазмы крови участвуют в процессах свертывания крови.
1.1.Аминокислоты -- Структурные компоненты белков
Аминокислоты - гетерофункциональные соединения. Они представляют собой производные карбоновых кислот, у которых атом водорода в альфа-положении замещен на аминогруппу.
Все аминокислоты, входящие в состав белков, характеризуются следующими особенностями:
а) по положению аминогруппы они являются a-аминокислотами (аминогруппа стоит рядом с карбоксильной группой).
б) все они относятся к L-ряду, так как аминогруппа у асимметричного (хирального) атома углерода записывается слева. Исключение составляет глицин, который не имеет асимметричного атома углерода, его боковая цепь представлена атомом водорода.
в) имеют одинаковый общий фрагмент и отличаются только строением боковой цепи (R), свойства которой во многом определяют свойства самих аминокислот и белков, в состав которых они входят. Именно различия в форме, размерах и полярности позволяют аминокислотам быть теми строительными блоками, которые использует эволюция, чтобы удовлетворить жесткие требования к структуре белков.
г) в растворах при нейтральных значениях рН альфа-аминокислоты существуют преимущественно в виде внутренних солей. В сильно кислой среде преобладает катионная форма, в сильно щелочной – анионная. (
В разных организмах было обнаружено множество аминокислот, не входящих в состав белков (т.н. небелковые аминокислоты). Однако все известные организмы для строительства своих белков используют одни и те же 20 аминокислот, Ф.Крик назвал их “магической двадцаткой”. Только они шифруются генетическим кодом.
БИОХИМИЯ ИНЕТ
Биохимия
Следующий разделБЕЛКИ. АМИНОКИСЛОТЫ -- СТРУКТУРНЫЕ КОМПОНЕНТЫ БЕЛКОВ
Белки – это азотсодержащие, высокомолекулярные органические соединения, состоящие из аминокислот, соединенных в цепи с помощью пептидных связей и имеющие сложную структурную организацию.
Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке.
Характерные признаки белков, отличающие их от других органических соединений клетки:
1 .Белки являются азотсодержащими соединениями, как многие другие компоненты клетки (нуклеиновые кислоты, некоторые липиды, углеводы), но в отличии от других органических вещества, содержание азота значительно больше – в среднем16 грамм на 100 грамм белка.
2.Структурной единицей белков являются альфа аминокислоты L-ряда.
3.Аминокислоты связаны в белках с помощью пептидных связей, образуя полипептидную цепь.
4.Белки имеют большую молекулярную массу (от 20000 до нескольких миллионов дальтон).
5.Отличаются белки сложной структурной организацией (имеют первичную, вторичную, третичную и четвертичную структуру).
МНОГООБРАЗНЫЕ ФУНКЦИИ БЕЛКОВ:
1.Каталитическая. Многие белки являются ферментами
2.Регуляторная. Некоторые гормоны являются белками
3.Структурная. Во все структуры живой клетки входят белки.
4.Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
5.Транпортная. Они транспортируют жиры, пигменты, гормоны, лекарственные вещества, различные гидрофобные соединения и др.
6.Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 г белка сопровождается выделением 17,6 кДЖ энергии. В сутки 15% энергии образуется за счёт распада белков.
8.Сократительная. Эту функцию выполняют белки мышечной ткани - актин, миозин.
9.Генно-регуляторная функция гистонов.
10.Иммунологическая. Антитела являются белками.
11 .Гемостатическая. Фибриноген и другие белки плазмы крови участвуют в процессах свертывания крови.
1.1.Аминокислоты -- Структурные компоненты белков
Аминокислоты - гетерофункциональные соединения. Они представляют собой производные карбоновых кислот, у которых атом водорода в альфа-положении замещен на аминогруппу.
Все аминокислоты, входящие в состав белков, характеризуются следующими особенностями:
а) по положению аминогруппы они являются a-аминокислотами (аминогруппа стоит рядом с карбоксильной группой).
б) все они относятся к L-ряду, так как аминогруппа у асимметричного (хирального) атома углерода записывается слева. Исключение составляет глицин, который не имеет асимметричного атома углерода, его боковая цепь представлена атомом водорода.
в) имеют одинаковый общий фрагмент и отличаются только строением боковой цепи (R), свойства которой во многом определяют свойства самих аминокислот и белков, в состав которых они входят. Именно различия в форме, размерах и полярности позволяют аминокислотам быть теми строительными блоками, которые использует эволюция, чтобы удовлетворить жесткие требования к структуре белков.
г) в растворах при нейтральных значениях рН альфа-аминокислоты существуют преимущественно в виде внутренних солей. В сильно кислой среде преобладает катионная форма, в сильно щелочной – анионная. (
В разных организмах было обнаружено множество аминокислот, не входящих в состав белков (т.н. небелковые аминокислоты). Однако все известные организмы для строительства своих белков используют одни и те же 20 аминокислот, Ф.Крик назвал их “магической двадцаткой”. Только они шифруются генетическим кодом.
Строение и классификация аминокислот
Существуют различные классификации аминокислот, входящих в состав белков в зависимости от признака, положенного в основу их деления на группы. Так по химической природе боковой цепи a-аминокислоты делятся на алифатические (ациклические), ароматические, гетероциклические.
I. Алифатическиеa - аминокислоты
1. Моноаминомонокарбоновые (нейтральные)
Алифатические аминокислоты, содержащие в боковой цепи дополнительную функциональную группу.
А) гидроксильную группу (оксиаминокислоты)
Б) карбоксильную группу (моноаминодикарбоновые)
В) амидную группу
Г) аминогруппу (диаминомонокарбоновые)
II. Ароматические аминокислотыIII. Гетероциклические аминокислоты
IV. Иминокислота
Гидрофильными (полярными) группами являются группы: -ОН, -SН, -СООН, - NН2, ядро имидазола. Гидрофильность - это свойство молекул или групп, имеющих… В связи с этим все 20 аминокислот по свойствам боковой цепи можно разделить на…Неполярные гидрофобные,
Полярные неионные,
Полярные отрицательно заряженные,
Полярные положительно заряженные.
В боковой цепи этих аминокислот содержатся неполярные, неионные группы. К данному классу относятся алифатические аминокислоты. Глицин это самая… Аминокислоты, содержащие полярные, неионные R-группы.Аминокислоты этой группы содержат в боковой цепи неионогенные группы, не способные отдавать или присоединять протон. Боковые группы этих аминокислот растворяются в воде т.к. в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относятся серин, треонин, содержащие в боковой цепи спиртовой гидроксил, а также глутамин, аспарагин, содержащие амидные группы. К этой же группе относятся цистеин и тирозин. Эти аминокислоты содержат соответственно тиольную группу и фенольный гидроксил, способные к диссоциации, но при нейтральных значениях рН, поддерживаемых в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными
R- группами.
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в боковой цепи дополнительную карбоксильную группу, способную к диссоциации.
Аминокислоты с полярными положительно заряженными R-группами. Дополнительную положительно заряженную группу в боковой цепи имеют лизин,… Предыдущий раздел Раздел верхнего уровня Следующий разделУровни структурной организации белковых молекул
Структура белковых молекул отличается значительной сложностью и своеобразной организацией. Различают 4 уровня структурной организации белка:… Первичная структура – это последовательность аминокислот в полипептидной цепи,… Последовательность аминокислот в полипептидной цепи определяет последующие уровни структурной организации белка, его…Белковые модули (домены)
Синтаза жирных кислот, представляющая одну полипептидную цепь, имеет 7 доменов, для катализа 7 реакций. Предполагается, что домены синтазы некогда…Активный центр белка и взаимодействие его с лигандом.
В основе функционирования белков лежит их специфическое взаимодействие с лигандами. 50000 индивидуальных белков, содержащих уникальные активные… Четвертичная структура - это высший уровень структурной организации, возможный… Четвертичную структуру стабилизируют нековалентные связи, которые возникают между контактными площадками протомеров,…Физико-химические свойства белков
Первичная структура белков в значительной степени определяет вторичную, третичную структуры и особенности четвертичной структуры. В свою очередь,… Молекулярная масса белков достаточно большая, поэтому они относятся к… Молекулярная масса некоторых белков составляет: инсулин - 5700Д,КЛАССИФИКАЦИЯ БЕЛКОВ
В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Однако до настоящего времени нет единой и стройной классификации, учитывающей различные особенности белков. В основе имеющихся классификаций лежат разные признаки. Так белки можно классифицировать:
· по форме белковых молекул (глобулярные – округлые или фибриллярные – нитевидные)
· по молекулярной массе (низкомолекулярные, высокомолекулярные)
· по выполняемым функциям (транспортные, структурные, защитные, регуляторные и др.)
· по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.)
· по структурным признакам и химическому составу белки делятся на две группы: простые и сложные. Простые белки представлены только полипептидной цепью, состоящей из аминокислот. Сложные белки имеют в своем составе белковую часть и небелковый компонент (простетическую группу). Однако и эта классификация не является идеальной, поскольку в чистом виде простые белки встречаются в организме редко.
Характеристика простых белков.
Гистоны - тканевые белки многочисленных организмов, связаны с ДНК хроматина. Это белки небольшой молекулярной массы (11-24 тыс.Да). По… Выделяют 5 типов гистонов. Деление основано на ряде признаков, главным из… Основная функция гистонов - структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в…Альбумины и глобулины.
А и Г белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л,… Альбумины-белки относительно небольшой молекулярной массы (15-70 тыс. Да); они… Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в…Проламины и глютелины.
Глютелины – тоже растительные белки, не растворимые в воде, в растворах солей, этаноле. Они растворимы в слабых щелочах.Протеиноиды.
Все эти белки относятся к фибриллярным, не гидролизуются в желудочно - кишечном тракте. Коллаген составляет 25-33 % от общего количества белка… Эластин –это основной структурный компонент эластических волокон, которые…СЛОЖНЫЕ БЕЛКИ
Сложные белки кроме полипептидных цепей содержат в своем составе небелковую (простетическую) часть, представленную различными веществами. В зависимости от химической природы небелковой части выделяют следующие группы сложных белков:
· хромопротеины
· углевод – белковые комплексы
· липид – белковые комплексы
· нуклеопротеины
· фосфопротеины
ХРОМОПРОТЕИНЫ
Хромопротеины – это сложные белки, простетическая часть которых представлена окрашенным компонентом (от греч. Chromos – краска). К ним относятся биологически важные белки гемоглобин, миоглобин, а также некоторые ферменты: каталаза, пероксидаза, цитохромы, все они являются гемпротеинами, так как простетическая часть их содержит гем.
Гемоглобин (Нв).
Субъединицы Нв «узнают» друг друга благодаря присутствию на их поверхности комплементарных по форме участков. Каждая из субъединиц или полипептидных… Каждый из протомеров гемоглобина представляет собой природный координационный…Типы гемоглобинов.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах развития… а) примитивный НвР, появляется на самых ранних стадиях развития эмбриона (1 –… б) фетальный гемоглобин НвF (от лат. Fetus – плод). НвF является главным типом гемоглобина плода и составляет к…ГЛИКОПРОТЕИНЫ (ГП)
ПРОТЕОГЛИКАНЫ
Короткие углеводные цепи ГП построены из глюкозамина, галактозамина, глюкозы, галактозы. Наиболее значимые моносахариды в составе ГП – N –… Число коротких углеводных цепей в ГП может доходить до 300-800. Длина и…Функция избирательного взаимодействия высокоспецифического узнавания.
Клеточные ГП, находящиеся на поверхности мембран, участвуют в очень тонких процессах биологического узнавания и межклеточного взаимодействия, выполняя роль рецепторных систем для определенных соединений и клеток.
Транспортная роль.
ГП осуществляют транспорт гидрофобных веществ и ионов металлов. Так
функцию переносчика железа выполняет ГП – трансферрин; меди – церуллоплазмин; стероидных гормонов – транскортин.
Каталитическая.
Углеводный компонент обнаружен в составе некоторых ферментов: энтерокиназа, пероксидаза, глюкозооксидаза, холинэстераза.
Функция защитной смазки.
Гликопротеины являются составными веществами муцинов слюны, желудочного и кишечного муцинов.
Участвуют в процессе свертывания крови.
ПРОТЕОГЛИКАНЫ. Это углевод-белковые комплексы, углеводный компонент которых представлен гетерополисахаридами, построенными из…Свободные липопротеины.
Липопротеины плазмы крови, молока, растворимы в воде.
Структурные протеолипиды.
Входят в состав биомембран, растворимы в жирах.
Липид – белковые комплексы в качестве небелковой части содержат липидные компоненты.
Высшие жирные кислоты
Свободные липопротеины.
ФРАКЦИИ ЛП: А) Хиломикроны (ХМ). Это самая низкая по плотности фракция, т.к. в составе… Б) Липопротеины очень низкой плотности (ЛПОНП).или пре-b-липопротеины, их плотность 0,94 – 1,006 кг/л;Структурные липопротеины (протеолипиды).
НУКЛЕОПРОТЕИНЫ
Нуклеиновые кислоты – это высокомолекулярные соединения, состоящие из мононуклеотидов, т.е. их структурной единицей является мононуклеотид… Соединение основания и пентозы называют нуклеозидом, связь между пентозой и азотистым основанием (b - гликозидная)…Номенклатура наиболее распространенных нуклеотидов.
1. Аденозинмонофосфат (АМФ), адениловая кислота. 2. Гуанозинмонофосфат (ГМФ), гуаниловая кислота. 3. Цитидинмонофосфат (ЦМФ), цитидиловая кислота.Структура нуклеиновых кислот.
При этом сложноэфирная связь образована фосфатным остатком одного мононуклеотида и 3" – гидроксильной группой пентозного остатка другого… Концы полинуклеотидов различаются по структуре: на одном конце имеется…Вторичная структура ДНК.
Согласно этой модели молекула ДНК представляет собой двойную спираль, образованную двумя полинуклеотидными цепями, закрученными относительно друг… Все основания цепей ДНК (гидрофобные по свойствам) расположены внутри двойной… Кроме водородных связей в стабилизации вторичной структуры ДНК участвуют гидрофобные взаимодействия возникающие за…Особенности структуры РНК.
Первичная структура РНК аналогична первичной структуре ДНК и представляет полинуклеотидную цепь, состоящую из мононуклеотидов, соединенных 3" a 5" – фосфодиэфирными связями.
Вторичная структура РНК.
Основные типы РНК.
1. Транспортные РНК (тРНК) Пространственную структуру тРНК, независимо от различий в последовательности…Третичная структура нуклеиновых кислот.
Исследование некоторых ДНК вирусов митохондрий, хлоропластов при помощи физических, физико-химических методов показало, что двойная спираль ДНК на… Суперспиральная структура (суперскрученная) обеспечивает экономную упаковку… Имеющиеся данные о структуре тРНК свидетельствуют о том, что нативные молекулы тРНК имеют примерно одинаковую…ФОСФОПРОТЕИНЫ.
Установлено, что фосфопротеины в клетках синтезируются в результате фосфорилирования при участии протеинкиназ. К фосфопротеинам относится казеиноген молока, который представляет собой белок…Углеводы. Классификация углеводов
Термин “углеводы”, предложенный в XIX столетии, был основан на предположении, что все углеводы содержат три элемента – углерод, водород и кислород, соотношение последних как в воде, и элементарный состав можно выразить формулой Сn (Н 2 О)m. Однако по мере открытия новых углеводов обнаружили, что не все они удовлетворяют этой формуле.
Термин “углеводы” устарел и не отражает ни химической природы, ни состава этих соединений, однако предложенный для них термин "глициды” не получил распространения. Характерным отличительным признаком углеводов является наличие в их составе не менее двух гидроксильных групп и карбонильной (альдегидной или кетонной) группы, т. е. углеводы это полиоксикарбонильные соединения и их производные.
Углеводы - наиболее распространенный в природе класс органических соединений. Функции углеводов в клетках весьма разнообразны. Они служат источником и аккумулятором энергии клеток, выполняя структурную роль, они в виде гликозамингликанов входят в состав межклеточного матрикса, участвуют во многих метаболических процессах.
Моносахариды - это углеводы, которые не подвергаются гидролизу, т.е. не распадаются на более простые сахара. Олигосахариды - сложные углеводы, которые содержат от 2 до 10 остатков моносахаридов.
Полисахариды являются высокомолекулярными соединениями, макромолекулы которых содержат сотни и тысячи моносахаридных остатков либо одного типа (гомополисахариды), либо разных типов (гетерополисахариды).
2.2. Моносахариды
В основе классификации моносахаридов лежат два признака:
Наличие функциональных групп.
Количество атомов углерода в составе моносахаридов.
В зависимости от положения в молекуле карбонильной группы моносахариды разделяются на альдозы и кетозы. Альдозы содержат альдегидную группу, тогда как кетозы содержат кетогруппу.
В зависимости от числа углеродных атомов выделяются следующие группы моносахаридов: триозы, тетрозы, пентозы, гексозы, гептозы
Открытые (незамкнутые) формы моносахаридов изображаются в виде проекционных формул Фишера. Молекулы моносахаридов содержат несколько центров хиральности (С*) и принадлежат к соединениям L- или D-ряда.
Относительная конфигурация моносахаридов определяется по конфигурационному стандарту – глицериновому альдегиду.
Моносахариды относятся к D-ряду, если ОН-группа при нижнем хиральном атоме углерода стоит справа и к L-ряду, если ОН группа стоит слева. Поэтому гидроксил, стоящий при нижнем хиральном атоме, называется D-, L-определяющим.
В водном растворе находятся как открытые, так и циклические формы моносахаридов. Циклические формы пятичленные (фуранозные) и шестичленные (пиранозные) гетероциклы.
Названия циклов происходят от названия родственных соединений – фурана и пирана
Циклические формы моносахаридов являются полуацеталями. Они образуются за счет внутримолекулярного взаимодействия между карбонильной и гидроксильной группами моносахарида. В циклической форме возникает новый центр хиральности,а также новый гидроксил – полуацитальный. Это приводит к образованию еще пары изомеров, которые называются аномерами.
Для циклических форм моносахаридов приняты перспективные формулы Хеуорса, в которых циклы изображаются в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагается в пиранозном цикле в дальнем правом углу, в фуранозном – за плоскостью цикла. Символы атомов углерода в циклах не пишутся.
Для перехода от Фишеровских проекционных формул к формулам Хеуорса нужно иметь в виду следующее: атомы и группы атомов находящиеся в формулах Фишера слева от углеродной цепи, в формулах Хеуорса располагаются над плоскостью цикла; заместители расположенные справа – под плоскостью.
Учитывая выше изложенное наиболее важные моносахариды в формулах Хеуорса имеют следующий вид.
Производные моносахаридов
Сиаловые кислоты во многом определяют взаимодействие лиганда с рецепторами…Олигосахариды
Лактоза и мальтоза относятся к восстанавливающим дисахаридам. Гликозидная связь в них образуется за счет полуацетальной (гликозидной) ОН-группы… В отличие от мальтозы и лактозы сахароза относится к невосстанавливающим… Мальтоза (солодовый сахар) образуется при расщеплении крахмала в кишечнике. Содержится в больших количествах в солоде…Гомополисахариды (ПС).
- строением моносахаридов, составляющих цепь - типом гликозидных связей, соединяющих мономеры в цепь - последовательностью остатков моносахаридов в цепи.Гетерополисахариды
Гликозамингликаны представляют собой длинные неразветвленные цепи гетерополисахаридов, построеныые из повторяющихся дисахаридных единиц – димеров.… Основными гликозамингликанами являются: гиалуроновая кислота,… Гиалуроновая кислота построена из повторяющихся единиц, включающих глюкуроновую кислоту и N - ацетилглюкозамин.Липиды
Липиды
Термин «ЛИПИДЫ» объединяет вещества, обладающие общим физическим свойством – гидрофобностью, т.е. нерастворимостью в воде. По структуре липиды – соединения разного химического строения. Их разделяют на классы, в которые объединяют молекулы, имеющие сходное химическое строение и общие биологические свойства.
Основную массу липидов в организме составляют жиры – триацилглицеролы, служащие формой депонирования энергии.
ФОСФОЛИПИДЫ – большой класс липидов, содержащих остаток фосфорной кислоты, придающей им свойства амфифильности. Благодаря этому свойству фосфолипиды формируют бислойную структуру мембран, в которую погружены белки.
СТЕРОИДЫ, представленные в животном мире холестеролом и его производными, выполняют разнообразные функции.
Жирные кислоты и ацилглицеролы.
Жирные кислоты – структурные компоненты различных липидов. Жирные кислоты липидов человека представляют собой углеводородную неразветвленную цепь на… Двойные связи в жирных кислотах в организме человека имеют цис-конфигурацию. … Насыщенные кислотыФосфолипиды и сфинголипиды
ФОСФОЛИПИДЫ
Глицерофосфолипиды – это производные глицерола, в котором первый и второй атомы углерода связаны сложно-эфирными связями с остатками жирных кислот,… небольшом количестве, но является промежуточным продутом на пути синтеза… У глицерофосфолипидов первый атом углерода глицерола этерифицирован предельными жирными кислотами, второй…Сфинголипиды
Вцерамидахспирт сфингозинсвязан с жирными кислотами необычной (амидной связью), а гидраксильные группыспособны взаимодействовать с другими… СфингомиелиныN–ацильные производныесфингозина, аминогруппа в которых… В клетке сфингомиелины – основные компоненты миелина и мембран клетокмозга и нервной ткани. Некоторые патологические…Стероиды
Холестерол может бытьэтерифицирован по гидроксильной группе с жирными кислотами, образуя эфирыхолестерола. В неэтерифицированном виде холестерол входит в состав мембран различныхклеток.…Витамины
В середине XIX века сложились представления о пищевой ценности белков, жиров, углеводов, минеральных веществ и воды. Однако экспериментальные… В 1880 году Н.И. Лунин провел исследование с мышами, одна группа мышей… Врачи Японии, Индонезии отмечали в своей практике, что пациенты, употребляющие, в основном, полированный рис чаще…Рацион взрослого человека
В развитии недостаточной обеспеченности витаминами определенную роль играет использование в настоящее время пищевых продуктов, подвергнутых… Таким образом, рацион современного человека, достаточный по калорийности, не…Жирорастворимые витамины
Витамин А химическое название - ретинол, клиническое название - антиксерофтальмический. Ретинол состоит из кольца бета-ионона и боковой цепи… В продуктах витамин А может находится в виде эфиров-ретинилпалбмитата,… Биологические эффекты витамина А.Водорастворимые витамины
Витамин С. Клиническое название этого витамина – антискорбутный, а химическое название –…ВИТАМИНОПОДОБНЫЕ ВЕЩЕСТВА.
ПАБК (ПАРААМИНОБЕНЗОЙНАЯ К-ТА) 1.Участвует в образовании ФОЛИЕВОИ кислоты, 2.Участвует в образовании ряда ферментов,Ферменты и неорганические катализаторы
Ферменты - это биологические катализаторы в основном белковой природы. Роль ферментов в организме огромна. В каждой клетке организма находится до… ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ.Строение ферментов
Простые ферменты представлены только белковой частью (состоят из аминокислот) - пепсин, трипсин, фосфатазы. Сложные ферменты представлены: 1 .Белковой частью (состоит из аминокислот) - апофермент;Рис. Активный центр фермента
Коферменты
Коферменты – небелковая часть сложных ферментов. Их делят на две группы: 1.Витаминные. 2.Невитаминные.Свойства ферментов
1 .Высокая каталитическая активность. 2.Ферменты, являясь белками, проявляют термолабильные свойства -… При повышении температуры на каждые 10 градусов Цельсия, скорость ферментативных реакций повышает в 1,5 - 2 раза…Специфичность действия ферментов.
1. Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. Уреаза катализирует гидролиз мочевины.Номенклатура ферментов
1. Тривиальная номенклатура. Пример: пепсин, трипсин. 2. Рабочая номенклатура: название S + тип превращения + окончание «аза».Классификация ферментов
Классификация ферментов
В основе лежит тип катализируемой реакции
Классы ферментов
Оксидоредуктазы
Трансферазы
Гидролазы
Лиазы
Изомеразы
Синтетазы
Механизм действия ферментов
1 стадия характеризуется диффузией субстрата к ферменту и их стерическимм взаимодействием с образованием фермент-субстратного комплекса. Эта стадия… Е + S > ЕSНа второй стадии происходит преобразование Е-S комплекса в один, или несколько, активированных комплексов.
Е + S > ЕS > ЕS*> ЕS** > ЕР
Эта стадия является наиболее продолжительной по времени. При этом происходит разрыв связей в молекуле субстрата, образование новых связей, т.е. образуются продукты реакции. Энергия активации снижается значительно.
На третьей стадии происходит освобождение продуктов реакции от фермента и поступление их в окружающую среду.
ЕР > Е + Р
Ускорение химическокой реакции ферментами происходит за счет существенного снижения энергии активации реагирующих веществ. Ряд молекулярных эффектов позволяют снижать энергию активации.
МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ
Эффект концентрации.
Молекулы субстрата концентрируются в области активного центра фермента.
Эффект сближения и ориентации.
Это характерное свойство ферментов, которое позволяет ускорить превращение субстрата и повышение скорости реакции в 1000 и 10000 раз. Контактные участки активного центра фермента связывают специфически молекулы субстрата, сближают их и обеспечивают взаимную ориентацию так, чтобы это было выгодно для действия каталитических групп фермента. Такое упорядоченное расположение субстрата приводит к снижению энергии активации.
Эффект натяжения.
До присоединения субстрата к активному центру фермента, его молекула как бы в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. При этом увеличивается длина межатомных связей, следовательно, понижается энергию активации.
Кислотно-основный катализ.
Ковалентный катализ.
Наблюдается у ферментов, которые образуют ковалентные связи между каталитическими группами активного центра и субстрата. В результате формируется промежуточный фермент-субстратный комплекс, который неустойчив, легко распадается, продукты реакции быстро освобождаются.
Эффект индуцированного соответствия.
Он объясняет специфичность действия ферментов. По этому поводу имеется 2 точки зрения:
А). Гипотеза Фишера.
Б). Теория индуцированного соответствия Кошленда дополнила теорию Фишера. Согласно ей молекула фермента - это не жёсткая, а гибкая структура. После… Предыдущий раздел Раздел верхнего уровня …- это снижение каталитической активности в присутствии определенных веществ – ингибиторов.

По характеру действия ингибиторы делятся на 2 большие группы:
Обратимые - это соединения, которые НЕКОВАЛЕНТНО взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные КОВАЛЕНТНЫЕ связи, поэтому такой комплекс трудно разрушить.
Виды ингибирования.
По механизму действия выделяют следующие виды ИНГИБИРОВАНИЯ:
Конкурентное ингибирование - это торможение ферментативной реакции, вызванное связыванием с активным центром фермента ингибитора, который по своей структуре близок к структуре субстрата. При этом и субстрат, и ингибитор могут взаимодействовать с ферментом, но они будут конкурировать за активный центр фермента, и связываться будет то вещество, которого больше.
пример:
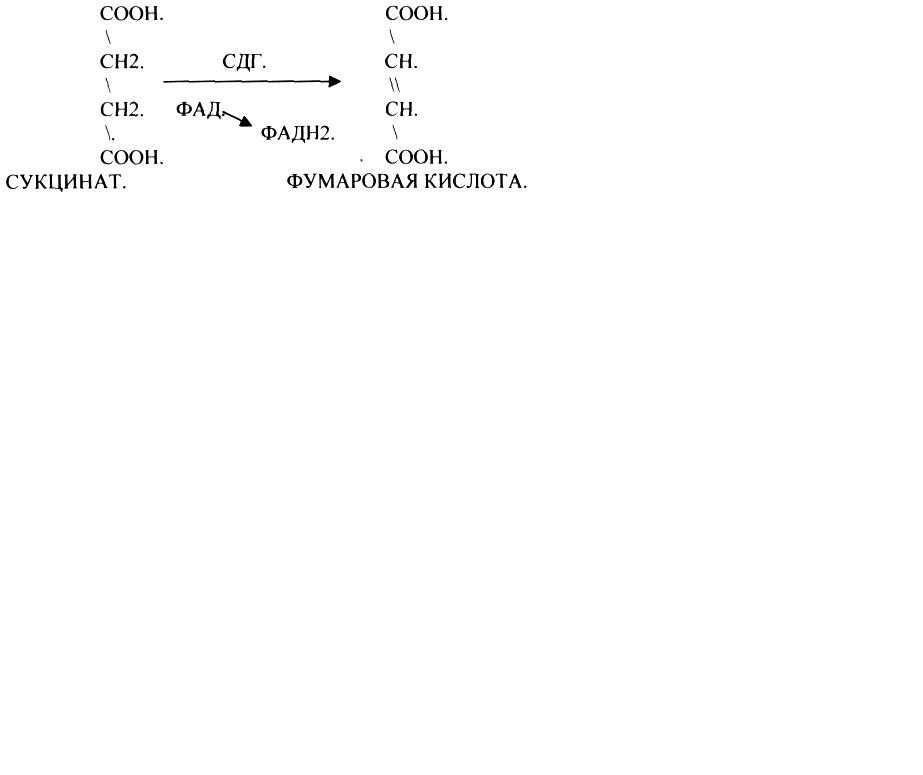
Сукцинатдегидрогеназная реакция.
Конкурентным ингибитором данной реакции является малоновая кислота, поэтому с активным центром фермента связывается и та, и другая кислота, в зависимости от их соотношения в растворе. Чтобы снять частично или полностью действие конкурентного ингибитора, нужно повысить концентрацию субстрата. При этом весь фермент будет находиться в форме фермент-субстратного комплекса, а доля комплекса фермент-ингибитор будет резко понижаться, поэтому скорость ферментативной реакции может быть максимальной даже в присутствии ингибитора.
Многие лекарственные препараты действуют по типу конкурентного ингибитора. При этом они тормозят активность ряда ферментов, необходимых для функционирования бактериальных клеток. Примером является применение сульфаниламидов. При различных инфекционных заболеваниях, которые вызываются бактериями, применяются сульфаниламидные препараты.
Эти препараты имеют структурное сходство с парааминобензойной кислотой, которая используется бактериями для синтеза фолиевой кислоты, необходимой для роста и размножения бактерий
Введение сульфаниламидов приводит к ингибированию ферментов бактерий, которые синтезируют фолиевую кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
По принципу конкурентных ингибиторов действует целая группа различных препаратов – это антихолинэстеразы. Они являются конкурентными ингибиторами фермента холинэстеразы, катализирующего гидролиз ацетилхолина. Ацетилхолин обеспечивает проведение нервного импульса. Антихолинэстеразы конкурируют с ацетилхолином за активный центр фермента холинэстеразы. В результате этого распад ацетилхолина тормозится, он накапливается в организме, вызывая нарушение проведения нервного импульса.
Неконкурентное ингибирование - это торможение ферментативной реакции, вызванное влиянием ингибитора на каталитическое превращение субстрата. При этом ингибитор не влияет на связывание фермента с субстратом. Неконкурентный ингибитор может связываться либо с каталитическими группами активного центра фермента, либо вне активного центра фермента, но при этом он изменяет конформацию фермента и затрагивает каталитический участок его активного центра. При неконкурентном ингибировании, возможно образование тройного, неактивного комплекса.

Схема неконкурентноеого ингибирования
В качестве неконкурентного ингибитора выступают цианиды. Они прочно связываются с ионами железа, которые входят в состав каталитического геминового фермента -цитохромоксидазы. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи выключает её из работы, что приводит к мгновенной гибели организме.
Примером неконкурентного ингибитора является действие солей тяжёлых металлов. Они блокируют -SH группы, которые входят в каталитический участок фермента. При этом образуется комплекс фермент-ингибитор. Он способен присоединять субстрат, но дальнейшего превращения субстрата не происходит, т.к. каталитические группы фермента заблокированы. Реакция непродуктивна. Снять действие неконкурентного ингибитора очень сложно, т.к. ионы металлов очень прочно связываются с активным центром фермента. Действие этого ингибитора можно снять только с помощью специальных веществ - реактиваторов.
3.Субстратное ингибирование - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется фермент-субстратный комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата.
4.Аллостерическое ингибирование характерно для ферментов, имеющих четвертичную структуру, молекула которых состоит из нескольких единиц (протомеров). Аллостерические ферменты могут иметь 2 и более единиц. При этом одна имеет каталитический центр и называется каталитической, а другая - аллостерический центр и называется регуляторной. В отсутствии аллостерического ингибитора субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении аллостерического ингибитора, он присоединяется к регуляторной единице, т.е. к аллостерическому центру, и изменяет конформацию центра фермента, в результате этого активность фермента снижается.
Обмен углеводов
1. Основные углеводы животного организма, их биологическая роль. 2. Превращение углеводов в органах пищеварительной системы. 3. Биосинтез и распад гликогена в тканях.Биологическая роль углеводов
1. ЭНЕРГЕТИЧЕСКАЯ. При окислении1 г углеводов до конечных продуктов (СО2 и Н2О) выделяется… 2. СТРУКТУРНАЯ.Превращение углеводов в пищеварительном тракте
ПИЩЕВАРИТЕЛЬНОМ ТРАКТЕ Основными углеводами пищи для организма человека являются: крахмал, гликоген,… Поступивший с пищей крахмал (гликоген) в ротовой полости подвергается гидролизу под действием альфа-амилазы слюны,…Биосинтез и распад гликогена
ГЛИКОГЕНОВЫЕ БОЛЕЗНИ. Было установлено, что гликоген может синтезироваться практически во всех…Анаэробный гликолиз
1.В АНАЭРОБНЫХ УСЛОВИЯХ 2.В АЭРОБНЫХ УСЛОВИЯХ. АНАЭРОБНЫЙ ГЛИКОЛИЗ (ГЛИКОГЕНОЛИЗ) протекает в цитоплазме клеток. Окисление глюкозы или глюкозного остатка гликогена…Рис. Аэробный распад глюкозы
Аэробный гликолиз (гексозодифосфатный путь)
Это классический путь аэробного катаболизма углеводов в тканях протекает в цитоплазме до стадии образования пирувата и завершается в митохондриях с… Когда в клетки начинает поступать кислород- происходит подавление анаэробного… 1. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТАРис. Аэробный распад глюкозы
Гексозомонофосфатный путь
В ТКАНЯХ, ХИМИЗМ РЕАКЦИЙ. Окисление глюкозы по этому пути протекает в цитоплазме клеток и представлено… Биологическая роль этого пути окисления глюкозы связывается прежде всего с производством двух веществ:Глюконеогенез
Основными источниками глюкозы для организма человека являются: 1. углеводы пищи; 2. гликоген тканей;Основные липиды организма человека их биологическая роль.
ЛИПИДЫ являются основным продуктом питания. Они поступают в организм человека с продуктами растительного и животного происхождения. Суточная… В организме человека ЛИПИДЫ представлены: 1.Структурными липидами (холестерол, фосфолипиды, гликолипиды).Переваривание липидов, ресинтез жира
Поступающие с пищей ЛИПИДЫ в ротовой полости подвергаются только механической переработке. ЛИПОЛИТИЧЕСКИЕ ферменты в ротовой полости не образуются.… 1. Наличие желчных кислот. 2. Наличие ферментов.Липопротеины крови
По своему строению мицеллы ЛИПОПРОТЕИНЫ имеют наружный слой и ядро. Наружный слой формируется из БЕЛКОВ, ФОСФОЛИПИДОВ и ХОЛЕСТЕРИНА, которые имеют… Выделяют 4 класса ЛИПОПРОТЕИНОВ крови, которые отличаются друг от друга по… 1. ХИЛОМИКРОНЫ. Образуются в стенке кишечника и имеют самый крупный размер частиц.Окисление высших жирных кислот
В клетках жировой ткани при участии липаз происходит распад ТАГ. Липаза находится в неактивной форме, она активируется гормонами (адреналином,… ВЖК с помощью альбуминов переносятся кровью к клеткам тканей, органов, где… Окисление высших жирных кислот.Окисление глицерина
Окисление глицерина в тканях тесно связано с ГЛИКОЛИЗОМ, в который вовлекаются метаболиты обмена глицерина по следующей схеме:
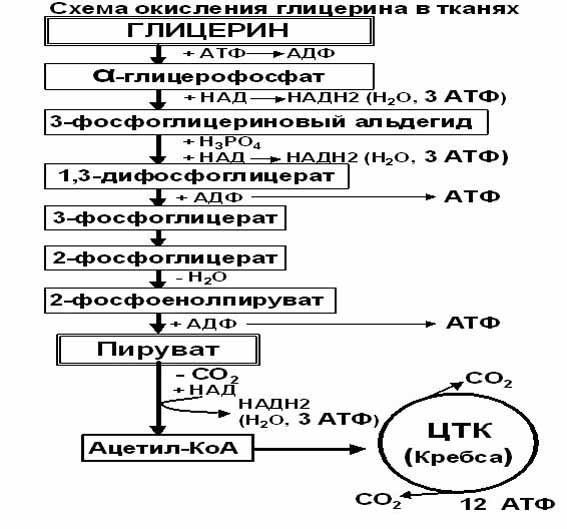
При окислении глицерина образовались конечные продукты:
СО2 на этапе превращения:
ПИРУВАТА
ИЗОЦИТРАТА
Альфа-КЕТОГЛУТАРАТА
Н 2 О на этапе превращения:
Альфа -ГЛИЦЕРОФОСФАТА
ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА
ФОСФОГЛИЦЕРАТА
ПИРУВАТА
ИЗОЦИТРАТА
Альфа-КЕТОГЛУТАРАТА
СУКЦИНАТА
МАЛАТА
АТФ выделилось за счёт реакций
А) Субстратного фосфорилиования на этапах превращения:
Дифосфоглицерата
Фосфоенолпирувата
Сукцинил-КоА
Б) Окислительного фосфорилирования на этапах превращения:
Альфа-глицерафосфата
Глицеральдегид-3 фосфата
Пирувата
Изоцитрата
Альфа-КЕТОГЛУТАРАТА
Сукцината
Малата
Суммарный энергетический эффект окисления одной молекулы глицерина равен 22 АТФ.
Биосинтез ВЖК в тканях
Условиями для биосинтеза ВЖК являются: 1.Наличие АЦЕТИЛ-КоА, АТФ, СО2, Н2О, НАДФ*Н2, 2.Наличие специальных белков-переносчиков (HS -АПБ). 3.Наличие ферментов синтеза.Обмен холестерина
Холестерин является предшественником в синтезе стероидов: желчных кислот, стероидных гормонов, витамина D3.Холестерин является обязательным…Переваривание белков
Пищевые белки подвергаются гидролитическому расщеплению под действием ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (класс – гидролазы, подкласс - пептидазы). Большинство этих ферментов вырабатывается в неактивной форме, т.е. в форме… Проферменты вырабатываются в клетках слизистой оболочки желудка или кишечника, клетках поджелудочной железы и…Гниение аминокислот, обезвреживание продуктов гниения
Аминокислоты, которые не подверглись всасыванию, поступают в толстую кишку, где подвергаются гниению. ГНИЕНИЕ АМИНОКИСЛОТ - это процесс распада… РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ:Метаболизм аминокислот
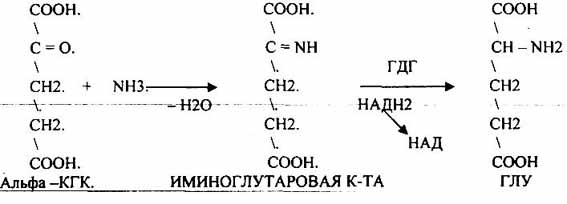
Источниками аминокислот в клетке являются: 1. белки пищи после их гидролиза в органах пищеварения; 2. синтез заменимых аминокислот;Рис. Окислительное дезаминирование глутаминовой кислоты
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ
Этому виду дезаминирования подвергаются остальные аминокислоты, но через стадию трансаминирования с альфа-кетоглутаровой кислотой. Затем глутаминовая кислота (продукт этой реакции) подвергается окислительному дезаминированию.
Пути обезвреживания аммиака
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 - 0,7мг/л). Особенно… ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА.Рис. Образование глутамина
ГЛУТАМИН и АСПАРАГИН - нетоксические вещества. Их называют транспортной формой аммиака в организме. Они не проникают через мембраны и в почках распадаются до аминокислот и аммиака.
2. Восстановительное АМИНИРОВАНИЕ альфа – кетоглутаровой кислоты
3. Образование солей АММОНИЯ
4. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ.
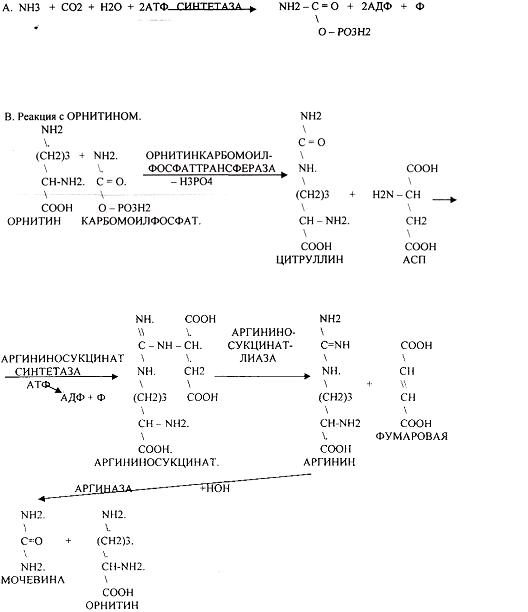
АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе мочевины содержится два атома азота: один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в МИТОХОНДРИЯХ, остальные в цитоплазме.
В организме в сутки образуется 25г мочевины. Этот показатель характеризует мочевинообразовательную функцию печени. Мочевина из печени поступает в почки, где и выводится из организма, как конечный продукт азотистого обмена.
- 6.1. Сигнальные молекулы
- 6.2. Гормоны гипоталамуса
- 6.3. ГОРМОНЫ ГИПОФИЗА
- 6.4. ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- 6.5. ГОРМОНЫ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
- 6.6. Гормоны половых желез
- 6.7. Гормоны надпочечников
- 6.8. Гормоны поджелудочной железы
Регуляция обмена веществ
Основные задачи регуляции метаболизма и клеточных функций: 1. внутриклеточное и межклеточное согласование обменных процессов; 2. исключение «холостых» циклов метаболизма, продукты которых не востребованы;Сигнальные молекулы
Гормоны гипоталамуса
ГИПОТАЛАМУС является компонентом и своеобразным «выходным каналом» лимбической системы. Это отдел промежуточного мозга, контролирующий различные параметры… С одной стороны он связан с центральной нервной системой, с другой - с гипофизом через аксоны нейронов и систему…ГОРМОНЫ ГИПОФИЗА
ГОРМОНЫ ГИПОФИЗА
В гипофизе выделяют переднюю (аденогипофиз) и заднюю доли (нейрогипофиз).ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
В щитовидно железе синтезируются гормоны, которые являются йодированными производными тирозина (йодтиронины). К ним относятся трийодтиронин (3, 5, 3? - трийодтиронин, Т 3) и тироксин (3, 5, 3?, 5?, - тетрайодтиронин, Т 4).
Рис. Йодтиронины
Биосинтез йодтиронинов
Йодирование тирозина и образование йодтиронинов осуществляется в несколько этапов: 1. транспорт йода в клетки щитовидной железы; 2. окисление йода;Влияние на метаболические процессы
Обмен белков
В физиологической концентрации йодтиронины усиливают биосинтез белков, но в высокой концентрации проявляется их катаболический эффект в отношении синтеза белков.
Обмен углеводов
В печени под влиянием данных гормонов происходит увеличение скорости распада глюкозы, мобилизации гликогена.
Обмен липидов
Под влиянием гормонов щитовидной железы происходит увеличение активности Na+, K+ - АТФ-азы, что ведет к уменьшению АТФ в клетке и, следовательно, к… В нормальной концентрации йодтиронины стимулируют процессы роста и клеточной…Нарушения секреции тиреоидных гормонов
Гипосекреция
У взрослых тяжелым проявлением недостатка гормонов щитовидной железы является микседема. В этом случае происходит замедление распада… Гипотиреоз может возникать также вследствие недостаточного поступления йода в…Гиперсекреция
ГОРМОНЫ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
ГОРМОНЫ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Рецепторы для ПТГ расположены на поверхности клеток почек и костной ткани (остеобласты, остеоциты). Механизм действия - цАМФ-зависимый. Эффекты гормона напралены на повышение концентрации ионов кальция и снижение концентрации фосфатов в крови.Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:













