Таблица закономерности изменения свойств атомов простых веществ. Экзамен по химии - Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимос
С увеличением заряда ядра атомов наблюдается закономерное изменение в их электронной структуре, что приводит к закономерному изменению химических и тех физических свойств атомов элементов, которые зависят от электронного строения (радиус атома или иона, потенциал ионизации, температуры плавления, кипения, плотность, стандартная энтальпия образования и др.)
Изменение химических свойств . При химическом взаимодействии атомов любых элементов наибольшее участие в этом процессе принимают электроны внешних слоев, наиболее удаленных от ядра, наименее связанных с ним, называемые валентными . У s- и р-элементов валентными являются электроны только внешнего слоя (s- и р-). У d-элементов валентными являются s-электроны внешнего слоя (в первую очередь) и d-электроны предвнешнего слоя. У f-элементов валентными будут s-электроны внешнего слоя (в первую очередь) , d-электроны предвнешнего слоя (если они есть) и f-электроны предпредвнешнего слоя.
Элементы, расположенные в одной подгруппе ПСЭ , имеют одинаковую структуру одного (электронные аналоги ) или двух внешних слоев (полные электронные аналоги ) и характеризуются близкими химическими свойствами, являются химическими аналогами.
Рассмотрим элементы 7 группы главной подгруппы А:
F 2s 2 2p 5
Cl 2s 2 2p 6 3s 2 3p 5 электронные аналоги
Br 3s 2 3p 6 3d 10 4s 2 4p 5
I 4s 2 4p 6 4d 10 5s 2 5p 5 полные аналоги
Элементы, расположенные в одной группе ПСЭ, но в разных погруппах , являются неполными электронными аналогами , например, Cl и Mn, V и Р и др. Почему?
Электронное строение нейтральных атомов хлора и марганца отличаются совершенно и химические свойства этих веществ в свободном состоянии не похожи: Cl –это р-элемент, типичный неметалл, газ, Mn – d-металл. Ионы хлора и марганца со степенями окисления (+7) уже являются электронными аналогами и имеют много общего в химическом отношении:
Оксиды Кислоты Соли
Cl 2s 2 2p 6 3s 2 3p 5 Cl (+7) 2s 2 2p 6 Cl 2 O 7 HClO 4 хлорная КClO 4 перхлорат калия
Mn 3s 2 3p 6 3d 5 4s 2 Mn(+7) 3s 2 3p 6 Mn 2 O 7 HMnO 4 марганцовая КMnO 4 перманганат калия
Закономерное изменение химических свойств элементов по периодам связано с закономерным изменением радиусов атомов и строения внешних и предвнешних электронных слоев атомов.
Рассмотрим на примере элементов 2, 3, 4 периодов.
Изменение атомных радиусов . Радиусы атомов не могут быть измерены непосредственно. Подразумевают так называемый “эффективный радиус”, который определяют экспериментально как ½ межъядерного расстояния для рассматриваемого элемента в кристалле. Самый малый радиус у атома водорода 0,53 о А (0,053 нм), самый большой – у Cs – 0,268 нм.
В пределах периода радиус атома уменьшается (®), т.к. увеличивается заряд ядра при том же числе электронных слоев (увеличивается притяжение электронов к ядру). В пределах подгруппы данной группы радиус атома увеличивается (¯), т.к. увеличивается число электронных слоев.
Рис.11. Изменение радиусов атомов элементов 2,3,4 периодов
Тенденция уменьшения радиуса по периоду повторяется (в каждом периоде), но на новом качественном уровне. В малых периодах, в которых только s- и p-элементы, изменение радиуса от элемента к элементу очень существенно, поскольку происходит изменение внешнего электронного слоя. У переходных d-элементов радиус меняется более монотонно, поскольку электронная структура внешнего слоя не меняется, а внутренние d-орбитали экранируют ядро и ослабляют влияние возрастающего заряда на внешние электронные слои атома. У f-элементов изменяется электронная структура еще более глубоко лежащего слоя, поэтому радиус изменяется еще менее значительно. Замедленное уменьшение размера атома с ростом заряда ядра за счет экранирующего действия на ядро d- и f-орбиталей называется d- и f-сжатием .
Рассмотрим теперь условное свойство, называемое «металличностью». Тенденция изменения этого свойства повторяет тенденцию изменения радиусов атомов, приведенных на рис.11.
Во 2, 3 периодах от элемента к элементу химические свойства меняются очень существенно: от активного металла Li (Na) через пять элементов к активному неметаллу F (Cl), поскольку от элемента к элементу происходит изменение структуры внешнего электронного слоя.
В 4 периоде за s-элементами К, Са следует группа переходных d-металлов от Sc до Zn, атомы которых отличаются структурой не внешнего, а предвнешнего слоя, что меньше отражается на изменении химических свойств. Начиная с Ga снова меняется внешний электронный слой и резко нарастают неметаллические свойства (Br).
У f-элементов изменяется предпредвнешний электронный слой, поэтому в химическом отношении эти элементы особенно близки. Отсюда – совместное нахождение их в природе, трудности разделения.
Таким образом, в любом периоде ПСЭ наблюдается закономерное, объясняемое с позиции электронного строения, изменение химических свойств элементов (а не простое повторение свойств).
Изменение характера оксидов по периоду (на примере 3 периода).
оксид: Na 2 O MgO Al 2 O 3 SiO 2 P 2 O 5 SO 3 Cl 2 O 7
1444424443 + + +
Н 2 О Н 2 О в Н 2 О нерастворимы 3 Н 2 О Н 2 О Н 2 О
оксида: 2NaOH Mg(OH) 2 ¯ Al 2 O 3 ×3Н 2 Оº2Al(OH) 3 ¯ SiO 2 ×Н 2 ОºH 2 SiO 3 ¯ 2H 3 PO 4 H 2 SO 4 2HClO 4
Al 2 O 3 ×Н 2 Оº2HAlO 2 14444442444443
Свойства: основания кислоты
сильное слабое слабая средней сильная очень
(щелочь) труднораств труднораств силы сильная
Характер
оксида: основной основной амфотерный кисл кисл кисл кисл
Таким образом, в любом периоде характер оксидов (и других однотипных соединений) меняется закономерно: от основного к кислотному через амфотерный.
Амфотерность гидроксида алюминия проявляется в его способности реагировать как с кислотами, так и основаниями: Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O; Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O.
Поскольку оксид кремния непосредственно в воде не растворяется, соответствующая ему кислота может быть получена косвенном путем: Na 2 SiO 3 + H 2 SO 4 = H 2 SiO 3 ¯ + Na 2 SO 4 . Кислотный характер оксида проявляется в реакции со щелочью: SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O.
Ионизационные потенциалы. Энергия ионизации и сродства к электрон у.
Нейтральные атомы элементов при различных взаимодействиях обладают способностью отдавать или присоединять электроны, превращаясь при этом в положительно- или отрицательнозаряженные ионы.
Способность атомов отдавать электроны характеризуется величиной потенциала ионизации
I (эВ/атом) или энергии ионизации (энтальпии ионизации) DН иониз. (кДж/моль атомов).
Потенциал ионизации – это та энергия, которую необходимо затратить, чтобы отделить электрон от атома (нейтрального, невозбужденного, газообразного) и увести его в бесконечность.
Энергию ионизации определяют путем бомбардировки атомов электронами, ускоренными в электрическом поле. То напряжение поля, при котором скорость электронов достаточна для ионизации атомов, называется ионизационным потенциалом . Ионизационный потенциал численно равен энергии ионизации, выраженной в эВ.
Н – е = Н + , I=13,6 эВ/атом, 1эВ = 1,6.10 -22 кДж, N A = 6,02.10 23
DН иониз. = 13,6 × 1,6.10 -22 × 6,02.10 23 » 1300кДж/моль
Обычно сравниваются только первые потенциалы ионизации, т.е. отрыв первого электрона. Отрыв последующих электронов требует большей энергии, например, для атома Са I 1 I 2 I 3
6,11®11,87® 151,2
По периоду (¾®) потенциал ионизации растет, что связано с уменьшением радиуса атомов.
В подгруппах ПСЭ ионизационные потенциалы изменяются неодинаково. В главных подгруппах потенциал уменьшается сверху вниз, что связано с возрастанием радиуса и эффектом экранирования ядра внутренними устойчивыми оболочками s 2 p 6 . В побочных подгруппах ионизационный потенциал возрастает сверху вниз, поскольку радиус меняется незначительно, а недостороенная оболочка плохо экранирует ядро.
В целом, для металлов характерны малые значения потенциала ионизации , т.е. атомы металлов легко отдают электроны (минимальный потенциал ионизации имеют Cs, Fr), для неметаллов – большие значения потенциала ионизации (максимальный у F).
Среди известных элементов больше металлов. Все s- (кроме H, He), d-, f-элементы – металлы. Среди р-элементов металлы: Al, Ga, In, Tl, Sn, Pb, Bi.
Максимальное количество валентных электронов, которые атом может “отдать” при взаимодействии, приобретая при этом максимальную положительную степень окисления, соответствует № группы в ПСЭ.
3 гр. Al 2s 2 2p 6 3s 2 3p 1 -3e ------- Al(+3) 2s 2 2p 6
6 гр. S 2s 2 2p 6 3s 2 3p 4 -6e ------- S(+6) 2s 2 2p 6
6 гр. Cr 3s 2 3p 6 3d 5 4s 1 -2e -----Cr(+2) 3s 2 3p 6 3d 4 -1e ---- Cr(+3) 3s 2 3p 6 3d 3 - 3e ----- Cr(+6) 3s 2 3p 6
ИСКЛЮЧЕНИЕ: F - нет положительной степени окисления
О - максимальная положительная степень окисления +2 в соединении OF 2
Элементы 1 группы п/гр Б Au - максимально +3
Cu, Ag - максимально +2
Элементы 8 группы п/гр Б Co, Ni, Rh, Pd, Ir, Pt
Способность атома присоединять электроны характеризует энергия сродства к электрону –
Е (эВ/атом) или энтальпия сродства к электрону DН сродства (кДж/моль) – это та энергия, которая выделяется при присоединении электрона к нейтральному невозбужденному атому с образованием отрицательно заряженного иона.
F 2s 2 2p 5 + e = F - 2s 2 2p 6 + Q
Энергию сродства к электрону измерить непосредственно нельзя. Вычисляют косвенными методами из цикла Борна-Габера.
В целом, неметаллы характеризуются большими значениями Е. В электронной структуре их атомов во внешнем слое 5 и более электронов и до устойчивой восьмиэлектронной конфигурации не хватает 1-3 электронов. Присоединяя электроны, атомы неметаллов приобретают отрицательные степени окисления, например, S (-2), N (-3), O (-2) и т.д. Металлы характеризуются малыми значениями Е. Металлы не имеют отрицательных степеней окисления!
Электроотрицательность . Для того, чтобы решить вопрос о перемещении электрона от одного атома к другому, необходимо учесть обе эти характеристики. Полусумма энергии ионизации и сродства к электрону (по модулю), получила название электроотрицательности (ЭО). Обычно используют не абсолютные значения, а относительные (ОЭО).
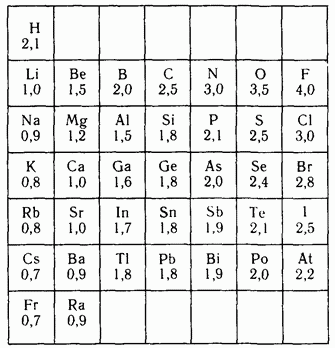
За единицу ОЭО берут ЭО атома Li или Са и вычисляют во сколько раз ЭО других элементов больше или меньше выбранного. Очевидно те атомы, которые прочно удерживают свои электроны и легко принимают чужие, должны иметь наибольшие значения ОЭО – это типичные неметаллы - фтор (ОЭО=4), кислород (ОЭО=3,5); у водород а ОЭО=2,1, а у калия - 0,9. По периоду ЭО увеличивается, по главным подгруппам – уменьшается. Металлы имеют малые значения ЭО и легко отдают свои электроны – восстановители. Неметаллы, наоборот, легко принимают электроны – окислители. Значения ОЭО приведены в справочнике. Мы будем их использовать для качественной оценки полярности химической связи.
* Примечание . Используя понятие электроотрицательности надо помнить, что значения ЭО нельзя считать постоянными, т.к. они зависят от степени окисления и от того, с каким атомом взаимодействует данный.
Химические свойства элементов проявляются при взаимодействии их атомов. Периодическая система элементов отражает закономерное изменение этих свойств.
Типы конфигураций внешних энергетических уровней атомов определяют основные особенности химического поведения элементов. Эти особенности являются специфическими для элементов главных подгрупп (s- и p-элементы), побочных подгрупп (-элементы) и -элементов (лантаноиды и актиноиды).
Особое место занимают элементы первого периода (Н и Не). Высокая химическая активность атомарного водорода объясняется способностью легко отдавать единственный -элекрон, тогда как электронная конфигурация атома гелия весьма устойчива, что обусловливает его химическую инертность.
Поскольку у элементов главных подгрупп происходит заполнение внешних энергетических уровней (с равным номеру периода), свойства элементов заметно меняются по мере роста порядкового номера Так, во втором периоде (конфигурация - химически активный металл, легко теряющий электрон, - также металл, но менее активный. Металлический характер следующего элемента выражен слабо, все последующие элементы второго периода, у которых происходит заполнение -подуровня, являются уже неметаллами.
Восьмиэлектронная конфигурация внешнего энергетического уровня чрезвычайно прочна, поэтому неон - благородный газ.
Аналогичный характер изменения свойств наблюдается у элементов третьего периода, а также и -элементов всех последующих периодов. Однако ослабление прочности связи внешних электронов с ядром у элементов главных подгрупп по мере роста определенным образом сказывается на их свойствах. Так, у р-элементов одной и той же группы отмечается нарастание металлических свойств. В главной подгруппе VIII группы ослабляется устойчивость конфигурации (по мере увеличения ), вследствие чего уже криптон (четвертый период) приобретает способность образовывать химические соединения.
Специфика -элементов четвертого - шестого периодов связана также с тем, что они отделены от -элементов совокупностями элементов, в атомах которых происходит заполнение предшествующих энергетических уровней.
У d-элементов побочных подгрупп достраиваются незавершенные уровни, главное квантовое число электронов которых на единицу меньше номера периода. Конфигурация внешних энергетических уровней d-элементов, как правило, Все d-элементы - металлы.
Экспериментальными исследованиями была установлена зависимость

Рис. 1.7. Зависимость первой энергии ионизации от порядкового номера элемента Z
химических и физических свойств элементов от их положения в периодической системе.
Энергия ионизации.
Важнейшей характеристикой элемента, непосредственно связанной с электронной структурой атома, является энергия ионизации.
Энергией ионизации называется энергия, которую необходимо затратить для отрыва и удаления электрона от атома иона или молекулы. Энергия ионизции выражается в джоулях или электронвольтах, эВ . Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электроны, превращаются в положительно заряженные ионы. Для данного атома или иона энергия, необходимая для отрыва и удаления первого электрона, называется первой энергией ионизации второго - второй энергией ионизации
Энергия ионизации увеличивается в следующем порядке: так как удаление электрона от электронейтрального атома происходит легче, чем от иона. На рис. 1.7 представлена зависимость от порядкового номера элемента Резкие максимумы соответствуют атомам благородных газов, которые обладают наиболее устойчивой электронной конфигурацией Минимумы кривой характерны для щелочных металлов, атомы которых, отдавая свой единственный -электрон внешнего уровня, приобретают конфигурацию атома предшествующего благородного газа. Таким образом, периоды на кривой рис. 1.7 полностью соответствуют периодам системы Менделеева. В пределах одного периода изменяется не монотонно. На кривой наблюдаются вторичные менее резкие максимумы, соответствующие
заполнению -подуровня у элементов II группы . У следующих за ними элементов III группы появление первого -электрона снова снижает энергию ионизации. Следующие максимумы на кривой отвечают элементам V группы что соответствует энергетически выгодному половинному заполнению -подуровня. У расположенных за ними элементов VI группы энергия ионизации снова снижается.
Во II группе периодической системы резкие вторичные максимумы, соответствующие объясняются влиянием застроенного d-подуровня. В пределах одной группы с увеличением значения обычно убывают, что связано с увеличением расстояния внешнего электронного уровня от ядра.
Сродство к электрону.
Сродством к электрону называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Она выражается в тех же единицах, что и энергия ионизации.
Атомы элементов-окислителей, принимая электроны, превращаются в отрицательно заряженные ионы. Энергия сродства к электрону атомов (как и энергия ионизации) закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Галогены отличаются самым высоким сродством к электрону, так как при присоединении одного электрона к нейтральному атому они приобретают законченную электронную конфигурацию благородного газа. Щелочные металлы характеризуются низким сродством к электрону. Для решения вопроса о том, какой из атомов легче отдает или присоединяет электрон, учитывают оба показателя: энергию ионизации и сродство к электрону. Согласно Малликену, полусумма энергии ионизации и сродства к электрону называется электроотрицательностью (ЭО)
Учитывая сложность определения величины сродства к электрону, американский ученый Полинг предложил термохимическую систему, согласно которой электроотрицательности атомов А и В определяют исходя из энергий связей Шкала электроотрицательностей атомов по Полингу приведена на с. 28.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы периодической системы Менделеева.
Размеры атомов и ионов (радиусы атомов и ионов).
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в
кристаллах. На рис. 1.8 представлена кривая, выражающая периодическую зависимость радиусов атомов от порядкового номера элемента
Радиусы атомов металлов в периодах с ростом порядкового номера элемента уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, и притяжение им электронов Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит

Рис. 1.8. Зависимость радиусов атомов от порядкового номера элемента
заполнение электронами внешнего энергетического уровня. В больших периодах и -элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число энергетических уровней.
Радиусы ионов отличаются от радиусов атомов, так как они или лишились нескольких электронов, или присоединили последние. Поэтому радиусы положительно заряженных ионов меньше, а радиусы отрицательно заряженных ионов больше радиусов соответствующих атомов. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента. Например, в пределах одной группы радиусы ионов одинакового заряда возрастают с увеличением номера элемента (заряда ядра).
Значение периодического закона.
Открытие Д. И. Менделеевым периодического закона имеет огромное значение для развития химии. Периодический закон обобщил большое число природных закономерностей, он явился научной основой химии. Прежде всего удалось систематизировать богатейший, но разрозненный материал, накопленный к тому времени поколениями химиков, по свойствам элементов и их соединений, уточнить многие понятия, например понятия «химический элемент» и «простое вещество». К моменту открытия периодического закона были известны 63 элемента. Менделеев предсказал существование многих не известных к тому времени элементов; скандия (экабор), галлия (экаалюминий) и германия (экасицилий).
В отличие от своих предшественников, пытавшихся дать ту или иную систематику элементов, Менделеев был убежден, что им открыт закон природы и, основываясь на нем, он подошел к оценке имевшихся экспериментальных данных, далеко не все из которых казались достоверными. В ряде случаев, основываясь на периодическом законе, им были изменены принятые в то время атомные массы элементов которые ранее были определены на основе ошибочных представлений о валентности элементов и составе соединений. Например, высшему оксиду урана приписывался состав вместо
В некоторых случаях Д. И. Менделеев расположил элементы в соответствии с закономерным изменением свойств, предполагая возможную неточность значений их атомных масс ). Этим была поставлена задача уточнения атомных масс указанных элементов, и для некоторых из них атомные массы были исправлены. Первоначально казалось, что открытие благородных газов нарушит периодичность изменения свойств элементов, однако затем были открыты остальные благородные газы, которые хорошо вписались в периодическую систему.
Предсказания ученого блестяще оправдались. С тех пор периодический закон и периодическая система элементов
Д. И. Менделеева служат научной базой прогнозирования в химии. С момента опубликования периодической системы элементов в ней появилось более 40 новых элементов. На основе периодического закона были получены искусственным путем трансурановые элементы, в том числе № 101, названный менделевием. Периодический закон позволил предсказать свойства не открытых еще элементов, например 117, 118, 119 и 120.
Периодический закон сыграл решающую роль в выяснении сложной структуры атома. С помощью периодической системы элементов удается определять физико-химические константы химических соединений на основе сопоставления известных величин. Периодический закон - фундамент химии, в первую очередь неорганической; он помогает решению задач синтеза веществ с заданными свойствами; разработке новых материалов, в частности полупроводниковых; подбору специфических катализаторов для различных химических процессов и т. д.
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона.
Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются (точнее, веществ, образованных элементами, но это часто опускают, говоря «свойства элементов»).
Сравните: периодичность смены времен года с течением времени.
Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе – это не просто очередность, он имеет физический смысл – равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период – это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор – неметалл, и т.д. В конце фтор – галоген и неон – инертный газ.
(Третий период снова начинается щелочным металлом – это и есть периодичность)
1-3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4-7 – большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы – это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы – I А, галогены – VII A, инертные газы – VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б – под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
-
Периодический закон и периодическая система химических элементов Д . И . Менделеева . Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного ) номера . -
Периодический закон и периодическая система химических элементов Д . И . Менделеева . Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного ) номера . -
Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного ) номера .
Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д . И . Менделеева . -
Строение атомов химических элементов . Состав атомного атомов первых 20 химических элементов периодической системы Д . И . Менделеева . -
1. Соединения атомов углерода (С) друг с другом и другими элементами периодической системы Д . И . Менделеева . При этом образуются цепи и циклы. 2. Атом углерода может находиться в трех разных гибридных состояниях. -
...(например, Периодический закон и периодическая система химических элементов Д .И .Менделеева , теория строения органических соединений Д .М.Бутлерова, открытие законов термодинамики, становление и развитие химической кинетики и др.) -
Строение атомов химических элементов . Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д . И . Менделеева . -
С учетом химического состава и строения исходных материалов выбирают наиболее рациональную конструкцию изделий и устанавли-вают оптимальные режимы технологических процессов их изготовления.В зависимости от размера, структурных элементов различают... -
6. Закономерности биологических ритмов учитывают при профилактике, диагностике и лечении заболеваний.
Физиологические ритмы, как правило, имеют периоды от долей секунды до нескольких минут (ритмы давления
Ритм - это универсальное свойство живых систем . -
Химические свойства . Важнейшими общими химическими свойствами ароматических углеводородов являются их склонность к реакциям замещения и большая прочность бензольного ядра.
Найдено похожих страниц:10