אטומים של הטבלה המחזורית. החוק המחזורי והטבלה המחזורית של יסודות כימיים של D.I.Mendeleev מבוסס על רעיונות לגבי מבנה האטום
תְקוּפָתִיד.אי. מנדלייב:תכונות של גופים פשוטים, כמו גם צורות ותכונות של חיבוריםערכים של אלמנטים תלויים מעת לעתערכי המשקלים האטומיים של היסודות (תכונות האלקטרונים תלויות מעת לעת במטען האטומים של הגרעינים שלהם).
הטבלה המחזורית של היסודות. את סדרת היסודות שבתוכם המאפיינים משתנים ברצף, כמו, למשל, סדרה של שמונה יסודות מליתיום לנאון או מנתרן לארגון, כינה מנדלייב תקופות. אם נכתוב את שתי התקופות הללו אחת מתחת לשנייה כך שמתחת לליתיום יש נתרן, ומתחת לניאון יש ארגון, אז נקבל את סידור היסודות הבא:
בסידור זה העמודים האנכיים מכילים יסודות הדומים בתכונותיהם ובעלי ערכיות זהה, למשל ליתיום ונתרן, בריליום ומגנזיום וכו'.
מחלק את כל היסודות לתקופות והצבת תקופה אחת מתחת לשנייה כך שאלמנטים דומים במאפיינים ובסוג התרכובות שנוצרו ייפלו זה תחת זה, מנדלייב הרכיב טבלה, שאותה כינה המערכת המחזורית של יסודות לפי קבוצות וסדרות.
ערך מערכת תקופתיאָנוּ.לטבלה המחזורית של היסודות הייתה השפעה רבה על ההתפתחות שלאחר מכן של הכימיה. היא לא הייתה רק הסיווג הטבעי הראשון יסודות כימיים, שהראה שהם יוצרים מערכת הרמונית ונמצאים בקשר הדוק זה עם זה, אבל גם היה כלי רב עוצמה למחקר נוסף.
7. שינוי תקופתי בתכונות היסודות הכימיים. רדיוסים אטומיים ויונים. אנרגיית יינון. משיכת אלקטרון. אלקטרוני שליליות.
לתלות של רדיוסים אטומיים במטען של גרעין האטום Z יש אופי תקופתי. בתוך תקופה אחת, עם עלייה ב-Z, מופיעה נטייה לירידה בגודל האטום, הנראית בבירור במיוחד בתקופות קצרות.
עם תחילת הבנייה של שכבת אלקטרונים חדשה רחוקה יותר מהגרעין, כלומר עם המעבר לתקופה הבאה, גדלים הרדיוסים האטומיים (השווה, למשל, רדיוסים של אטומי פלואור ונתרן). כתוצאה מכך, בתוך תת-קבוצה, עם עלייה במטען הגרעיני, גדלים גדלים של האטומים.
אובדן אטומי האלקטרונים מביא לירידה בגודלו האפקטיבי, והוספת עודף אלקטרונים מביאה לעלייה. לכן, הרדיוס של יון טעון חיובי (קטיון) תמיד קטן יותר, והרדיוס של לא (אניון) בעל מטען שלילי תמיד יותר רדיוסאטום ניטרלי חשמלי מתאים.
בתוך תת-קבוצה אחת, רדיוסים של יונים מאותו מטען גדלים עם עלייה במטען הגרעיני תבנית זו מוסברת על ידי עלייה במספר שכבות האלקטרונים ומרחק הולך וגדל של אלקטרונים חיצוניים מהגרעין.
התכונה הכימית האופיינית ביותר למתכות היא היכולת של האטומים שלהן לתרום בקלות אלקטרונים חיצוניים ולהתמיר ליונים בעלי מטען חיובי, בעוד שאינן מתכות, להיפך, מתאפיינות ביכולת לחבר אלקטרונים ליצירת יונים שליליים. כדי לנתק אלקטרון מאטום עם הפיכתו של האחרון ליון חיובי, אתה צריך להוציא קצת אנרגיה, הנקראת אנרגיית יינון.
ניתן לקבוע אנרגיית יינון על ידי הפצצת אטומים באלקטרונים המואצים בשדה חשמלי. מתח השדה הקטן ביותר שבו מהירות האלקטרונים הופכת מספיקה לינון אטומים נקרא פוטנציאל היינון של האטומים של יסוד נתון והוא מתבטא בוולט. עם הוצאת אנרגיה מספקת, ניתן לקרוע שניים, שלושה או יותר אלקטרונים מהאטום. לכן, אנו מדברים על פוטנציאל היינון הראשון (אנרגיית ההפרדה של האלקטרון הראשון מהאטום), פוטנציאל היינון השני (אנרגיית ההפרדה של האלקטרון השני)
כפי שצוין לעיל, אטומים יכולים לא רק לתרום, אלא גם לצרף אלקטרונים. האנרגיה המשתחררת כאשר אלקטרון מחובר לאטום חופשי נקראת זיקה של אטום לאלקטרון. זיקה אלקטרונית, כמו אנרגיית יינון, מתבטאת בדרך כלל בוולט אלקטרוני. אז, זיקת האלקטרונים של אטום מימן היא 0.75 eV, חמצן הוא 1.47 eV, פלואור הוא 3.52 eV.
זיקת האלקטרונים של אטומי מתכת היא בדרך כלל קרובה לאפס או שלילית; מכאן נובע שעבור האטומים של רוב המתכות, תוספת האלקטרונים אינה חיובית מבחינה אנרגטית. הזיקה לאלקטרון של אטומים של לא-מתכות היא תמיד חיובית וככל שהיא גדולה יותר, כך הלא-מתכת ממוקמת קרוב יותר לגז האציל במערכת המחזורית; זה מעיד על עלייה תכונות לא מתכתיותככל שאנו מתקרבים לסוף התקופה.
1.ניסוח החוק התקופתי
DI מנדלייב לאור התיאוריה של מבנה האטום.
גילוי החוק המחזורי והתפתחות המערכת המחזורית של יסודות כימיים על ידי D.I. Mendeleev היו פסגת התפתחות הכימיה במאה ה-19. הכמות העצומה של הידע על תכונותיהם של 63 יסודות הידועים באותה תקופה הוכנסה לסדר.
DI מנדלייב האמין שהמאפיין העיקרי של יסודות הוא משקלם האטומי, ובשנת 1869 הוא ניסח את החוק המחזורי לראשונה.
התכונות של גופים פשוטים, כמו גם הצורות והתכונות של תרכובות של יסודות, תלויות מעת לעת בערך המשקלים האטומיים של היסודות.
את כל סדרת היסודות, המסודרים בסדר עולה של מסות אטומיות, חילק מנדלייב לתקופות, שבתוכם תכונות היסודות משתנות ברצף, וממקמים את התקופות כך להבליט יסודות דומים.
אולם למרות המשמעות העצומה של מסקנה זו, החוק התקופתי ושיטתו של מנדלייב היו רק הכללה גאונית של העובדות, ומשמעותן הפיזית נותרה בלתי מובנת במשך זמן רב. רק כתוצאה מהתפתחות הפיזיקה של המאה ה-20 - גילוי האלקטרון, הרדיואקטיביות, התפתחות התיאוריה של מבנה האטום - קבע הפיזיקאי האנגלי הצעיר והמוכשר ג'י מוסל כי ערכם של המטענים של גרעיני האטומים גדל בהדרגה מיסוד ליסוד באחד. עם גילוי זה, מוסל אישרה את הניחוש הגאוני של מנדלייב, שבשלושה מקומות בטבלה המחזורית חרג מהרצף ההולך וגובר של משקלים אטומיים.
אז, כאשר הרכיב אותו, מנדלייב שם את 27 Co לפני 28 Ni, 52 Ti מול 5 J, 18 Ar מול 19 K, למרות העובדה שזה סותר את הניסוח של החוק המחזורי, כלומר, הסידור של יסודות לפי סדר הגדלת משקלם האטומי.
על פי חוק מוסל, המטענים של גרעיני היסודות הללו תאמו את מיקומם בטבלה.
בהקשר לגילוי חוק משה, הניסוח המודרני של החוק התקופתי הוא כדלקמן:
המאפיין של יסודות, כמו גם הצורה והתכונות של התרכובות שלהם, תלויים מעת לעת במטען של גרעין האטומים שלהם.
חיבור של החוק המחזורי והמערכת המחזורית עם מבנה האטומים.
לכן, מאפיין עיקריהאטום אינו המסה האטומית, אלא גודל המטען החיובי של הגרעין. זה יותר כללי אפיון מדויקאטום, ומכאן היסוד. כל המאפיינים של היסוד ומיקומו במערכת המחזורית תלויים בגודל המטען החיובי של גרעין האטום. בדרך זו, המספר הסידורי של יסוד כימי עולה בקנה אחד עם המטען של גרעין האטום שלו. מערכת תקופתיתאלמנטים הוא ייצוג גרפי של החוק המחזורי ומשקף את מבנה האטומים של היסודות.
התיאוריה של מבנה האטום מסבירה את השינוי התקופתי בתכונות היסודות. עלייה במטען החיובי של גרעיני אטום מ-1 ל-110 מובילה לחזרה תקופתית של מרכיבי המבנה של רמת האנרגיה החיצונית לאטומים. ומכיוון שתכונות היסודות תלויות בעיקר במספר האלקטרונים ברמה החיצונית; ואז הם חוזרים על עצמם מעת לעת. זוהי המשמעות הפיזית של החוק התקופתי.
כדוגמה, שקול לשנות את המאפיינים של האלמנטים הראשונים והאחרונים של התקופות. כל תקופה בטבלה המחזורית מתחילה ביסודות של אטומים, שברמה החיצונית יש להם s-אלקטרון אחד (רמות חיצוניות לא שלמות) ולכן מציגים תכונות דומות - הם תורמים בקלות אלקטרוני ערכיות, מה שקובע את אופיים המתכתי. אלו מתכות אלקליות - Li, Na, K, Rb, Cs.
התקופה מסתיימת ביסודות שהאטומים שלהם ברמה החיצונית מכילים 2 (s 2) אלקטרונים (בתקופה הראשונה) או 8 (s 1 p 6) אלקטרונים (בכל אלה שלאחר מכן), כלומר, יש להם רמה חיצונית מלאה. אלו הם גזים אצילים He, Ne, Ar, Kr, Xe, בעלי תכונות אינרטיות.
בשל הדמיון במבנה רמת האנרגיה החיצונית, תכונותיהם הפיזיקליות והכימיות דומות.
בכל תקופה עם מספר סידורי הולך וגדל של אלמנטים תכונות מתכתיותלא מתכתי בהדרגה להחליש ולהגדיל, התקופה מסתיימת עם גז אינרטי. בכל תקופה, עם עלייה במספר הסידורי של היסודות, התכונות המתכתיות נחלשות בהדרגה והתכונות הלא מתכתיות מתגברות, התקופה מסתיימת בגז אינרטי.
לאור התיאוריה של מבנה האטום, מתבררת החלוקה של כל היסודות לשבע תקופות, שנעשתה על ידי D.I.Mendeleev. מספר התקופה מתאים למספר רמות האנרגיה של האטום, כלומר, מיקום היסודות בטבלה המחזורית נקבע על פי מבנה האטומים שלהם. תלוי באיזו תת-רמה מלאה באלקטרונים, כל האלמנטים מחולקים לארבעה סוגים.
1.s-אלמנטים. ממלאים את תת-הרמה של הרמה החיצונית (ס 1 - ש' 2). זה כולל את שני האלמנטים הראשונים של כל תקופה.
2. p-אלמנטים. תת-הרמה של הרמה החיצונית ממולאת (עמ' 1 - עמ' 6) - זה כולל את ששת האלמנטים האחרונים של כל תקופה, החל מהשנייה.
3. ד-אלמנטים. תת-הרמה של הרמה האחרונה (d1 - d 10) מתמלאת, ו-1 או 2 אלקטרונים נשארים ברמה האחרונה (החיצונית). אלה כוללים את האלמנטים של עשרות שנים (10) של תקופות גדולות, החל מה-4, הממוקמות בין היסודות s- ו-p (הם נקראים גם יסודות מעבר).
4. אלמנטי f. תת-ה-f של המפלס העמוק (שליש ממנו בחוץ) (f 1 -f 14) מתמלא, ומבנה המפלס האלקטרוני החיצוני נשאר ללא שינוי. אלו הם לנתנידים ואקטינידים, שנמצאים בתקופה השישית והשביעית.
לפיכך, מספר היסודות בתקופות (2-8-18-32) מתאים למספר המרבי האפשרי של אלקטרונים ברמות האנרגיה המתאימות: בראשון - שניים, בשני - שמונה, בשלישי - שמונה עשר, ו ברביעי - שלושים ושניים אלקטרונים. חלוקת הקבוצות לתת-קבוצות (ראשית ומשנית) מבוססת על ההבדל במילוי רמות האנרגיה באלקטרונים. תת-הקבוצה העיקרית היא ס - ו-p-elements, ותת-הקבוצה המשנית היא d-elements. כל קבוצה מכילה יסודות, שלאטומים שלהם מבנה דומה של רמת האנרגיה החיצונית. במקרה זה, האטומים של היסודות של תת הקבוצות העיקריות מכילים, ברמות החיצוניות (האחרונות), את מספר האלקטרונים השווה למספר הקבוצה. אלה הם מה שנקרא אלקטרוני ערכיות.
אלמנטים תת קבוצות צדאלקטרוני ערכיות הם לא רק חיצוניים, אלא גם הרמות הלפני אחרונות (בחוץ השני), שהוא ההבדל העיקרי במאפיינים של היסודות של תת-הקבוצות הראשיות והמשניות.
מכאן נובע שמספר הקבוצה מציין בדרך כלל את מספר האלקטרונים שיכולים להשתתף בהיווצרות קשרים כימים... זה המשמעות הפיזית של מספר הקבוצה.
מנקודת המבט של תורת המבנה האטומי, ניתן להסביר בקלות את העלייה בתכונות המתכתיות של יסודות בכל קבוצה עם עלייה במטען של גרעין האטום. השוואה, למשל, התפלגות האלקטרונים על פני רמות באטומים 9 F (1s 2 2s 2 2p 5) ו-53J (1s 2 2s 2 2p 6 3s 2 Зр 6 תלת מימד 10 4s 2 4 עמ' 6 4 ד 10 5s 2 5p 5), ניתן לציין שלכל אחד יש 7 אלקטרונים ברמה החיצונית, מה שמעיד על הדמיון של תכונות. עם זאת, האלקטרונים החיצוניים באטום היוד רחוקים יותר מהגרעין ולכן הם פחות מוגבלים. מסיבה זו, אטומי יוד יכולים לתרום אלקטרונים או, במילים אחרות, להפגין תכונות מתכתיות, שאינן אופייניות לפלואור.
אז, מבנה האטומים קובע שתי תבניות:
א) שינוי במאפיינים של יסודות בצורה אופקית - בתקופה משמאל לימין, התכונות המתכתיות נחלשות והתכונות הלא מתכתיות משופרות;
ב) שינוי בתכונות האלמנטים לאורך האנכי - בקבוצה עם עלייה במספר הסידורי, התכונות המתכתיות עולות והתכונות הלא מתכתיות נחלשות.
בדרך זו: ככל שגדל המטען של גרעין האטומים של יסודות כימיים, מבנה הקליפות האלקטרוניות שלהם משתנה מעת לעת, וזו הסיבה לשינוי התקופתי בתכונותיהם.
3. מבנה תְקוּפָתִי המערכות של DI מנדלייב.
הטבלה המחזורית של D.I. תצורה אלקטרוניתאטומים ותכונות כימיות דומות.
שלוש התקופות הראשונות נקראות קטנות, השאר נקראות גדולות. התקופה הראשונה כוללת שני יסודות, התקופה השנייה והשלישית - שמונה כל אחת, הרביעית והחמישית - שמונה עשרה כל אחת, השישית - שלושים ושתיים, השביעית (לא גמורה) - עשרים ואחד יסודות.
כל תקופה (למעט הראשונה) מתחילה במתכת אלקלית ומסתיימת בגז אציל.
יסודות של 2 ו-3 תקופות נקראים טיפוסיים.
תקופות קטנות מורכבות משורה אחת, גדולות - משתי שורות: זוגיות (עליון) ואי זוגי (תחתונה). בשורות אחידות של תקופות גדולות, מתכות ממוקמות, ותכונות היסודות משתנות מעט משמאל לימין. בשורות אי-זוגיות של תקופות גדולות, המאפיינים של אלמנטים משתנים משמאל לימין, כמו באלמנטים של 2 ו-3 תקופות.
בטבלה המחזורית, עבור כל יסוד מצוין הסמל והמספר הסידורי שלו, שם היסוד והמסה האטומית היחסית שלו. הקואורדינטות של מיקום האלמנט במערכת הן מספר התקופה ומספר הקבוצה.
אלמנטים עם המספרים הסידוריים 58-71, הנקראים lanthanides, ואלמנטים עם המספרים 90-103 - אקטינידים - ממוקמים בנפרד בתחתית הטבלה.
קבוצות של יסודות, המסומנות בספרות רומיות, מחולקות לתת-קבוצות עיקריות ומשניות. תת הקבוצות העיקריות מכילות 5 אלמנטים (או יותר). תת-הקבוצות הצדדיות כוללות אלמנטים של תקופות החל מהרביעית.
התכונות הכימיות של יסודות נקבעות על פי מבנה האטום שלהם, או ליתר דיוק המבנה מעטפת אלקטרוניתאטומים. השוואה בין מבנה קליפות האלקטרונים למיקום היסודות בטבלה המחזורית מאפשרת לקבוע מספר חוקיות חשובות:
1. מספר התקופה שווה למספר הכולל של רמות האנרגיה המלאות באלקטרונים באטומים של יסוד נתון.
2. בתקופות קטנות ובסדרות אי זוגיות של תקופות גדולות, עם עלייה במטען החיובי של גרעינים, מספר האלקטרונים ברמת האנרגיה החיצונית עולה. זה קשור להיחלשות של המתכתי וחיזוק התכונות הלא מתכתיות של היסודות משמאל לימין.
מספר הקבוצה מציין את מספר האלקטרונים שיכולים להשתתף ביצירת קשרים כימיים (אלקטרוני ערכיות).
בתתי קבוצות, עם עלייה במטען החיובי של גרעיני האטומים של יסודות, התכונות המתכתיות שלהם משופרות ותכונותיהם הלא מתכתיות נחלשות.
היסודות הכימיים של DI מנדלייב הם הבסיס של הכימיה המודרנית. הם מתייחסים לחוקים מדעיים כאלה המשקפים את התופעות הקיימות בפועל בטבע, ולכן לעולם לא יאבדו ממשמעותן.
התגלית שלהם הוכנה על ידי כל מהלך ההיסטוריה של התפתחות הכימיה, אך נדרשה הגאונות של DI מנדלייב, מתנתו של ראיית הנולד המדעית, כך שהתבניות הללו נוסחו והוצגו בצורה גרפית בצורת טבלה. נשתמש במילים נרדפות מודרניות לאותם מונחים המשמשים את הכימאי הרוסי הגדול.
תנאים מוקדמים לגילוי החוק התקופתי מאת D.I.Mendeleev
צבירת חומר עובדתי
עד לגילוי החוק התקופתי, היו ידועים 63 יסודות כימיים, ההרכב והתכונות של תרכובותיהם הרבות תוארו.
עבודות של מדענים - קודמיו של D.I. Mendeleev
הסיווג של ברזליוס. הכימאי השוודי המצטיין J.J. Berzelius חילק את כל היסודות למתכות ולא-מתכות על סמך ההבדלים בתכונות שנוצרו על ידם. חומרים פשוטיםוקשרים. הוא קבע כי תחמוצות ובסיסים בסיסיים תואמים למתכות, ותחמוצות חומצה וחומצות לא-מתכות.
אבל היו רק שתי קבוצות, הן היו גדולות וכללו אלמנטים שונים זה מזה באופן משמעותי. הנוכחות של תחמוצות אמפוטריות והידרוקסידים במתכות מסוימות הייתה מבלבלת. הסיווג לא צלח.
השלשות של דברינר (1816). הכימאי הגרמני IV Debereiner חילק את היסודות לשלושה על בסיס הדמיון בתכונות החומרים שנוצרו על ידו וכדי שהערך, שאנו מבינים כעת כמסה האטומית היחסית (Am) של היסוד האמצעי, שווה לממוצע האריתמטי של שני הקיצוניים. דוגמה לטריאדה: Li, Na, K.
ו-r (Na) = (7 + 39): 2 = 23
דוגמאות לשלשות אחרות כוללות:
עבודתו של I. Debereiner שימשה אישור לרעיון קיומו של קשר מסוים בין המסות האטומיות לתכונות היסודות. אבל הוא הצליח לחבר רק ארבע שלשות, הוא לא יכול היה לסווג את כל היסודות הידועים באותה תקופה.
ספירלה שנקורטואה (1862). פרופסור מפריז בית ספר תיכון A. Beguier de Chancourtois הציע לסדר את היסודות בספירלה או בגנרטריקס של הגליל לפי סדר הגדלת המסה האטומית שלהם והצביע על כך שבמקרה זה ניתן להבחין בדמיון של תכונות החומרים הנוצרים על ידי היסודות. הם נופלים על אותו קו אנכי של הגליל, הממוקם אחד מתחת לשני, לדוגמה:
אוקטבות של ניולנדס(1865). הכימאי האמריקאי D.A.R Newlands ניסה לסדר את היסודות המוכרים לו בסדר הגדלת המסה האטומית שלהם ומצא קווי דמיון בולטים בין כל יסוד שמיני ברציפות, החל בכל אחד, כמו מבנה של אוקטבה מוזיקלית, המורכב משמונה צלילים. הוא כינה את הגילוי שלו חוק האוקטבות:
[]
עם זאת, הוא לא הצליח להסביר בצורה משביעת רצון את התבנית שנמצאה, יתר על כן, בטבלה שלו לא היה מקום לאלמנטים שטרם התגלו, ואלמנטים שהיו שונים מאוד בתכונותיהם נפלו לכמה עמודות אנכיות. האגודה הכימית של לונדון עמדה באדישות בחוק האוקטבות שלו והזמינה את ניולנדס לנסות לסדר את היסודות בסדר אלפביתי ולזהות כל דפוס. שולחנו של מאיר (1864). החוקר הגרמני ל' מאייר גם סידר את היסודות הכימיים לפי סדר הגדלת המסה האטומית שלהם: 
אבל בטבלה זו מייר מייר רק 27 אלמנטים, כלומר פחות ממחצית מאלה הידועים באותה תקופה. מיקומם של היסודות הנותרים: B, Al, Cu, Ag וכו' נותר לא ברור, ומבנה הטבלה לא היה מוגדר.
לפני DI מנדלייב, נעשו כ-50 ניסיונות לסווג יסודות כימיים. רוב המדענים ניסו לזהות את הקשר בין התכונות הכימיות של יסודות והתרכובות שלהם והמסה האטומית. אך לא ניתן היה ליצור סיווג שיכלול את כל היסודות הכימיים הידועים באותה תקופה. אף אחד מהניסיונות לא הוביל ליצירת מערכת המשקפת את יחסי הגומלין של אלמנטים וחושפת את אופי הדמיון והשוני ביניהם. גילוי החוק המחזורי ובניית הטבלה המחזורית של יסודות כימיים הוא הכשרון של המדען הרוסי הגדול D.I.Mendeleev.
שלא כמו עבודותיהם של קודמים, טבלת הטבלה המחזורית של יסודות כימיים שהוצעה על ידי D.I. חללים ריקיםכי עדיין לא נפתח. המערכת של DI מנדלייב אפשרה לא רק לחזות את קיומם של יסודות לא ידועים, אלא גם לחזות את תכונותיהם, לתקן את המסות האטומיות שנקבעו בצורה שגויה של יסודות ידועים כבר.
קונגרס הכימאים בקרלסרוהה
התנאי המקדים השלישי לפתיחת החוק התקופתי היה החלטות הקונגרס הבינלאומי של כימאים בקרלסרוהה ב-1860, כאשר הוראה אטומית-מולקולרית, ההגדרות המאוחדות הראשונות של המושגים של מולקולה ואטום, כמו גם משקל אטומי, שאנו מכנים כעת מסה אטומית יחסית (Ar), אומצו. המושג הזה כמאפיין בלתי משתנה של אטומים של יסודות כימיים הוא ש-D.I. מנדלייב עשה את הבסיס לסיווג שלו. הוא כתב: "מסה של חומר היא בדיוק תכונה כזו שלו, שכל שאר התכונות חייבות להיות תלויות בה. לכן, הכי קרוב או טבעי לחפש קשר בין תכונות ודמיון של יסודות, מצד אחד, לבין משקלם האטומי, מצד שני".
קודמיו של די.י.מנדלייב השוו רק אלמנטים דומים זה לזה, ולכן לא יכלו לגלות חוק תקופתי... בניגוד אליהם, ד.י.
D.I. מנדלייב בתגליתו הסתמך על עמדות מוצא מנוסחות בבירור:
התכונה הבלתי משתנה המשותפת של האטומים של כל היסודות הכימיים היא המסה האטומית שלהם;
תכונות היסודות תלויות במסה האטומית שלהם;
צורת התלות הזו היא תקופתית.
התנאים המוקדמים שנחשבו לעיל יכולים להיקרא אובייקטיביים, כלומר, הם אינם תלויים באישיותו של המדען, שכן הם היו בשל התפתחות היסטוריתכימיה כמדע.
אך ללא תכונותיו האישיות של הכימאי הגדול, המהוות את התנאי הרביעי, הסובייקטיבי, לגילוי החוק התקופתי, הוא בקושי היה מתגלה בשנת 1869. אם איזה כימאי אחר היה מגלה אותו, כנראה שזה היה קורה הרבה יותר מאוחר. אופיו האנציקלופדי של הידע, האינטואיציה המדעית, היכולת להכליל, החתירה המתמדת לידע על הלא נודע, מתנת ראיית הנולד המדעית מאת ד.י. מנדלייב מילאו תפקיד משמעותי בגילוי החוק התקופתי.
ד.י. גילוי החוק התקופתי של מנדלייב
בבסיס עבודתו על סיווג היסודות הכימיים, הציב D.I. מנדלייב שניים מהמאפיינים העיקריים והקבועים שלהם: הערך של המסה האטומית והתכונות. הוא כתב על הכרטיסים את כל המידע הידוע על היסודות הכימיים והתרכובות שלהם שהתגלו ונלמדו באותה תקופה. בהשוואת מידע זה, המדען ריכז קבוצות טבעיות של יסודות דומים בתכונותיהם, שהשוואה ביניהם הראתה שאפילו לאלמנטים של קבוצות שונות יש מאפיינים המאחדים אותם. לדוגמה, המסות האטומיות של פלואור ונתרן, כלור ואשלגן (גזים אינרטיים עדיין לא היו ידועים) קרובים בערכים, לכן, ניתן למקם מתכות אלקליות והלוגנים זה לצד זה, ולסדר יסודות כימיים בסדר עולה של מסות אטומיות. אז DI מנדלייב שילב קבוצות טבעיות של יסודות כימיים למערכת אחת.
דמיטרי איבנוביץ' מנדלייב (1834-1907)
המדען הרוסי הגדול, ממייסדי הכימיה המודרנית. יוצר הסיווג הטבעי של יסודות כימיים - הטבלה המחזורית של היסודות, שהיה ביטוי לחוק המחזורי של יסודות כימיים. הוא יצר יצירה יסודית - ספר הלימוד "יסודות הכימיה", שבו מוצגת לראשונה כל הכימיה האנאורגנית על בסיס החוק התקופתי. הוא המחבר תיאוריה כימיתפתרונות. בכתביו הוא הקדיש תשומת לב רבה לפיתוח התעשייה המקומית ולכימיזציה של החקלאות.
DI מנדלייב טען את הצורך ליצור תעשיות כימיות: סודה, חומצה גופרתית, דשנים מינרליים. ביססו את הרעיונות של גיזוז פחם תת קרקעי והשימוש בחמצן ב תעשיית מתכות... הוא הציע שיטה לעיבוד מתמשך של שמן, כמו גם תיאוריה מקורית של מקורו.
במקביל, הוא גילה שתכונות היסודות משתנות באופן ליניארי בתוך קבוצות מסוימות שלהם (עלייה או ירידה מונוטונית), ואז חוזרות על עצמן מדי פעם, כלומר לאחר מספר מסוים של יסודות, נתקלים באלה דומים. המדען זיהה תקופות שבהן תכונות היסודות הכימיים והחומרים הנוצרים על ידם משתנות באופן קבוע. הבה נשקול את השינויים הללו באמצעות מונחים מודרניים.
1. התכונות המתכתיות של חומרים פשוטים, הבולטים ביותר במתכות אלקליות, נחלשות ומוחלפות באלה שאינם מתכתיים, הבולטים ביותר בהלוגנים.
2. הערך של מצב החמצון של אטומים של יסודות בתחמוצות גבוהות יותר עולה מ-+1 ל-+7 (+8 רק עבור Os ו-Ru).
3. ערך מצב החמצון של אטומים של יסודות בהידרידים (תרכובות של מתכות עם מימן) ובתרכובות מימן נדיפות עולה תחילה מ-+1 ל-+3 ולאחר מכן מ-4 ל-1.
4. התחמוצות העיקריות של היסודות של תחילת התקופה מוחלפות בתחמוצת אמפוטרית ולאחר מכן בחומצית, שתכונותיה משופרות.
5. הידרוקסידים-בסיסים דרך הידרוקסיד אמפוטרי מוחלפים ביותר ויותר חומצות חזקות.
בהתבסס על תצפיות אלו, גיבש די.י.מנדלייב את החוק התקופתי, אשר בהתאם למינוח המקובל כיום, נשמע כך:
המאפיינים של יסודות כימיים והחומרים הנוצרים על ידם תלויים מעת לעת במסה האטומית היחסית שלהם.
כדי להמחיש את החוק הזה, השתמשנו במחזוריות הנחשבת (בדידות, אי רציפות במרווחים מסוימים) רק בצורה אופקית. עם זאת, החוק המחזורי והטבלה המחזורית עשירים הרבה יותר בחוקים תקופתיים: בנוסף למחזוריות הנחשבת האופקית (לפי תקופות), יש גם מחזוריות אנכית (לפי קבוצות) ואלכסונית.
אתה כבר מודע היטב למחזוריות האנכית: בקבוצות (תת-קבוצות עיקריות), עם עלייה במספר הסידורי של היסודות, התכונות המתכתיות של החומרים הפשוטים שנוצרו על ידם מתגברות והתכונות הלא מתכתיות נחלשות; האופי הבסיסי של תחמוצות והידרוקסידים עולה; כוחן של תרכובות מימן נדיפות יורד ובהתאם לכך, תכונות החומציות שלהן גדלות.
מחזוריות אלכסונית מובנת כהישנות של דמיון תכונות כימיותחומרים פשוטים ותרכובות של יסודות הממוקמים באלכסון זה מזה בטבלה המחזורית.
הדמיון בתכונות בין חומרים פשוטים ותרכובות שנוצרו על ידי יסודות כימיים הממוקמים באלכסון מוסבר בכך שהעלייה בתכונות הלא מתכתיות בתקופות משמאל לימין מאוזנת בערך על ידי ההשפעה של עלייה בתכונות מתכתיות בקבוצות מלמעלה לתחתית.
לדוגמה, המתכת ליתיום Li דומה למגנזיום בכל המובנים המבדילים אותה מהנתרן Na. באופן דומה, בורון B נראה יותר כמו סיליקון מאשר אלומיניום אל. 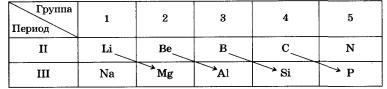
התכונות הכימיות הכלליות של Li ו-Mg כוללות את יכולתם להתלקח בקלות, חוסר היציבות של החנקות והקרבונטים שלהם, והמסיסות הנמוכה של פלואורידים, פוספטים וסיליקטים במים.
הדמיון האלכסוני של Be ו-Al מתבטא בעובדה ששתי המתכות מגיבות באופן זהה עם חומצות ואלקליות, והתחמוצות וההידרוקסידים שלהן אמפוטריות.
בורון וסיליקון יוצרים חומרים פשוטים דומים שהם אינרטים ועמידים, בעוד לתחמוצות והידרוקסידים יש תכונות חומציות. בורון, כמו פחמן וסיליקון, יוצר נדיף תרכובות מימן, בשיטות ייצור ותכונות הדומות לסיליקות (סילאנים): B2H6, B4H10 וכו'.
והכי חשוב, המחזוריות האלכסונית של תכונות לא-מתכות מאופיינת באלכסון הידוע B - Si - As - Te - At, המחלק באופן קונבנציונלי את היסודות למתכות ולא-מתכות, או באלכסון C - P - סה - אני.
שני אלכסונים: Al - Ge - Sb ו-Zn - In - Pb - כוללים יסודות, תחמוצות והידרוקסידים שיש להם תכונות אמפוטריות.
אם משלבים את המחזוריות האופקית, האנכית והאלכסונית, ניתן לקבל את "מחזוריות הכוכבים".
השיקול של כל סוגי המחזוריות הוא שאפשר ל-DIMendeleev לא רק לחזות ולתאר את תכונות החומרים שנוצרו על ידי יסודות כימיים שטרם התגלו, אלא גם לציין את דרכי הגילוי שלהם, מקורות טבעיים (עפרות ותרכובות) שמהם ניתן היה להשיג את החומרים הפשוטים המתאימים.
חוק תקופתי ומבנה האטום
ניסוח החוק, שניתן על ידי D.I.Mendeleev, לא יכול להיות מדויק ומלא מנקודת מבט מודרנית, שכן הוא תואם את מצב המדע באותה תקופה שבה לא היה ידוע מבנה האטום. לכן, גילויים מדעיים חדשים התנגשו איתו. אז התגלו איזוטופים.
איזוטופים - זנים של אטומים של אותו יסוד כימי, בעלי אותו מטען גרעיני, אך מספרי מסה שונים.
סכום מספרי הפרוטונים והנייטרונים בגרעין האטום נקרא מספר המסה ומסומן באות A.
ברור שלגרעינים של איזוטופים של יסוד כימי אחד יש מספר זהה של פרוטונים, אך שונים במספר הנייטרונים שהם מכילים. לָכֵן,
יסוד כימיהוא סוג של אטומים המאופיינים באותו מטען גרעיני, כלומר מכילים אותו מספר פרוטונים.
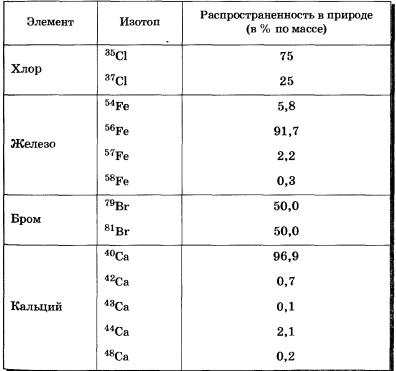
איזוטופים ידועים בכל היסודות הכימיים. בטבע, רובם קיימים כתערובת של איזוטופים. המסה האטומית היחסית של יסוד שווה לערך הממוצע של המסות האטומיות היחסיות של כל האיזוטופים הטבעיים שלו, בהתחשב בשפע שלהם.
נתונים על איזוטופים של כמה יסודות כימיים מובאים בטבלה 5, המסות והאחוז שלהם בטבע (במסה) מסומנים.
בטבלה של הטבלה המחזורית, מתחת לסמלים של יסודות כימיים, ניתנים הערכים הממוצעים של המסה האטומית היחסית שלהם. ניתן לחשב אותם בידיעה של מספר המסה של כל איזוטופ ו שבר מסהזה בתערובת טבעית. לכן,
А r (Сl) = 35 0.75 + 37 0.25 = 35.5
טבלה 5 איזוטופים של כמה יסודות כימיים
נוכחותם של איזוטופים מוכיחה שהתכונות של יסודות כימיים נקבעות לא כל כך על ידי המסה האטומית שלהם, כפי שהציע DI מנדלייב, אלא על ידי המטען של גרעיני אטום. זה מסביר את המיקום בטבלה המחזורית של ארבעה זוגות של יסודות המסודרים תוך הפרה של העיקרון של הגדלת המסה האטומית היחסית:
18Ag (39.948) - 19K (39.102) 27Co (58.933) - 28N (58.71) 52Te (127.60) - 531 (126.904) 90T (232.038) - 91)Pa (238)
זהו הגאונות, הביטוי של האינטואיציה המדעית של הכימאי הרוסי הגדול, שבמקרים אלה העדיף לסדר את היסודות לפי הדמיון שלהם בתכונות, חזה את הסדר האמיתי של סידור היסודות הכימיים לפי המטענים ההולכים וגדלים של גרעיני האטום שלהם, למרות שהוא לא ידע דבר על מבנה האטומים שלהם.
לראשונה נחשפה המשמעות הפיזיקלית של המספר הסידורי (אטומי) על ידי ואן דן ברוק ההולנדי, שהוכיח תיאורטית שמספרו הסידורי של יסוד כימי שווה למטען של גרעין האטום שלו. השערתו של ואן דן ברוק אושרה בניסוי על ידי האנגלי ג'י מוסלי.
גילוי האיזוטופים וחוק ואן דן ברוק-מוזלי אפשרו לתת הגדרה נוספת ומודרנית לחוק התקופתי:
תכונות היסודות הכימיים והחומרים שהם יוצרים תלויים מעת לעת במטענים של גרעיני האטום שלהם.
הטבלה המחזורית של יסודות כימיים ומבנה האטום
הטבלה המחזורית של יסודות כימיים מציגה בצורה גרפית את החוק המחזורי. כל מספר בו מאפיין תכונה כלשהי במבנה האטומים:
א) המספר הסידורי (אטומי) של יסוד כימי מציין את המטען של גרעין האטום שלו, כלומר מספר הפרוטונים הכלולים בו, ומכיוון שהאטום נייטרלי מבחינה חשמלית, מספר האלקטרונים סביב גרעין האטום. מספר הנייטרונים נקבע על ידי הנוסחה
N = A - Z
כאשר A הוא מספר המסה, Z הוא המספר הסידורי של היסוד;
ב) מספר התקופה מתאים למספר רמות האנרגיה (שכבות אלקטרוניות) באטומים של היסודות של התקופה הנתונה;
ג) מספר הקבוצה מתאים למספר האלקטרונים ברמה החיצונית עבור היסודות של תת הקבוצות הראשיות ולמספר המרבי של אלקטרוני ערכיות עבור היסודות של תת הקבוצות המשניות.
לאור מבנה האטום ניתן להסביר את הסיבות לשינוי בתכונות היסודות הכימיים והחומרים הנוצרים על ידם. בתקופה עם עלייה במטענים של גרעיני אטום של יסודות (משמאל לימין), התכונות המתכתיות נחלשות, והתכונות הלא מתכתיות עולות בשל העובדה ש:
א) מספר האלקטרונים במפלס החיצוני של האטום עולה;
ב) מספר רמות האנרגיה באטומים בתוך התקופה נשאר קבוע;
ג) רדיוס האטומים יורד.
בקבוצות ( תת קבוצה ראשית) עם עלייה במטענים של גרעיני אטום של יסודות (מלמעלה למטה), התכונות המתכתיות עולות, התכונות הלא מתכתיות נחלשות. זה מוסבר על ידי
מספר האלקטרונים ברמה החיצונית של האטומים נשאר זהה;
מספר רמות האנרגיה באטום גדל;
רדיוס האטומים גדל.
בתקופות גדולות, שינויים כאלה מתרחשים לאט יותר, שכן, החל מהיסוד השלישי, לא הושלמה רמת האנרגיה החיצונית עבור אטומים, אלא הרמה הקדם-חיצונית מ-8 עד 18 אלקטרונים (עבור יסודות של תת-קבוצות צד), ורק אז. הרמה החיצונית מ-2 עד 8 אלקטרונים מתמלאת (עבור אלמנטים של תת-קבוצות עיקריות).
בתקופות "על ארוכות" (שישית ושביעית, לא שלמות), שינויים אלו מתרחשים לאט יותר, שכן בלנתנידים ובאקטינידים, לא הרמה החיצונית הקדם-חיצונית מסתיימת, אלא הרמה החיצונית השלישית - מ-18 ל-32 אלקטרונים. . לכן, המאפיינים של יסודות אלו יהיו דומים כל כך למאפיינים של היסודות La ו-Ac, וגם דומים זה לזה. זאת בשל העובדה שתכונות היסודות הכימיים והחומרים הנוצרים על ידם תלויים בעיקר במבנה רמת האנרגיה החיצונית של אטומים, פחות במבנה הקדם-חיצוני וכמעט אינם תלויים במבנה הפנימיים. רמות.
טבעו של כל יסוד כימי, כלומר, מאפיינים מסוימים בלבד של אטומים, חומרים פשוטים, תרכובות, תלוי בעיקר במטען של גרעין האטומים שלו. המטען גם קובע את מבנה מעטפת האלקטרונים של האטום. אבל ערכי המטענים של גרעיני האטומים של יסודות כימיים בטבלה המחזורית של D.I.
הסיבה למחזוריות היא שינוי במבנה השכבות האלקטרוניות החיצוניות של האטומים. אז בכל המתכות האלקליות, רמת האנרגיה החיצונית תפוסה על ידי אלקטרון B אחד, ולכן התכונות שלהן כל כך דומות. אבל הם לא זהים, מידת הביטוי שלהם שונה, מכיוון שהאלקטרון החיצוני היחיד הזה ממוקם במרחקים שונים מגרעין האטומים של כל אחת מהמתכות האלקליות:

המאפיינים של יסודות כימיים והחומרים הנוצרים על ידם תלויים מעת לעת במבנה השכבות האלקטרוניות החיצוניות של האטומים.
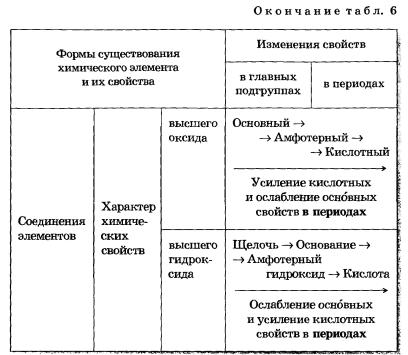
מידע מלא יותר על התלות האופקית והאנכית של תכונותיהם של אטומים, חומרים פשוטים ותרכובות שנוצרו על ידי יסודות כימיים מוצג בטבלה 6.
טבלה 6 שינויים בתכונות של אטומים, חומרים פשוטים ותרכובות של יסודות כימיים

משמעות החוק המחזורי והטבלה המחזורית של יסודות כימיים מאת D.I. Mendeleev
ד"ר מנדלייב כתב: "לפני החוק המחזורי, היסודות היו רק תופעות אקראיות מקוטעות של הטבע; לא הייתה סיבה לחכות לחדשים, והחדשים שנמצאו היו חידוש בלתי צפוי לחלוטין. הסדירות המחזורית הייתה הראשונה שאפשרה לראות אלמנטים שטרם התגלו במרחק כזה, שאליהם עדיין לא הגיעה הראייה, לא חמושה בקביעות זו".
עם גילוי החוק התקופתי, הפסיקה הכימיה להיות מדע תיאורי - היא קיבלה מכשיר של ראיית הנולד מדעית. חוק זה והייצוג הגרפי שלו - טבלת הטבלה המחזורית של יסודות כימיים של D.I. מנדלייב - מילאו את כל שלושת הפונקציות החשובות ביותר של הידע התיאורטי: הכללה, הסבר וחיזוי. על בסיסם, מדענים:
סיכם וסיכם את כל המידע על היסודות הכימיים והחומרים שהם יוצרים;
נתן נימוק לסוגים שונים של תלות תקופתית הקיימים בעולם היסודות הכימיים, והסביר אותם על בסיס מבנה האטומים של היסודות;
הם חזו, תיארו את התכונות של יסודות כימיים שטרם התגלו ואת החומרים שנוצרו על ידם, וכן ציינו את דרכי גילוים.
DI מנדלייב עצמו נאלץ לעשות שיטתיות ולהכליל מידע על יסודות כימיים כאשר גילה את החוק התקופתי, בנה ושיפר את הטבלה שלו. יתר על כן, טעויות בערכי המסות האטומיות ונוכחותם של יסודות שטרם התגלו יצרו קשיים נוספים. אבל המדען הגדול היה משוכנע בתוקף באמיתות חוק הטבע שהתגלה על ידו. בהתבסס על הדמיון בתכונות והאמונה בנכונות קביעת מקומם של היסודות בטבלה של הטבלה המחזורית, הוא שינה משמעותית את המסות האטומיות ואת הערכיות בתרכובות עם חמצן בעשרה יסודות שאומצו באותה תקופה ו"תיקן" אותן. עבור עשרה אחרים. הוא הציב בטבלה שמונה אלמנטים, בניגוד לרעיונות המקובלים באותה תקופה לגבי הדמיון שלהם לאחרים. לדוגמה, הוא הוציא את התליום מהמשפחה הטבעית של מתכות אלקליות ושם אותו בקבוצה השלישית לפי הערכיות הגבוהה ביותר שלו; הוא העביר בריליום עם מסה אטומית שנקבעה בצורה שגויה (13) וערכיות III מהקבוצה השלישית לשניה, ושינה את המסה האטומית שלו ל-9 ואת הערכיות הגבוהה ביותר ל-II.
רוב המדענים תפסו את התיקונים של מנדלייב כקלות דעת מדעית, חוצפה בלתי מוצדקת. החוק התקופתי וטבלת היסודות הכימיים נחשבו כהשערה, כלומר הנחה הדורשת אימות. המדען הבין זאת, ודווקא כדי לוודא את נכונות החוק ומערכת היסודות שהתגלו על ידו, הוא תיאר בפירוט את תכונותיהם של יסודות שטרם התגלו ואף את שיטות גילוים, על סמך מקומם המשוער במערכת. . לפי הגרסה הראשונה של הטבלה, הוא עשה ארבע תחזיות (גליום, גרמניום, הפניום, סקנדיום), ולפי המשופר השני - שבע נוספות (טכנציום, רניום, אסטטין, פרנציום, רדיום, כלניות, פרוטקטיניום).
לתקופה 1869-1886. שלושה יסודות חזויים התגלו: גליום (P.E. Lecoq de Boisabaudran, צרפת, 1875), סקנדיום (L.F. Nilsson, שוודיה, 1879) וגרמניום (K. Winkler, גרמניה, 1886) ... הגילוי של הראשון מבין היסודות הללו, שאישר את נכונות התחזית של המדען הרוסי הגדול, עורר רק עניין והפתעה בקרב עמיתיו. גילוי הגרמניום היה ניצחון אמיתי של החוק התקופתי. ק' וינקלר כתב במאמרו "דיווח על גרמניה": "אין עוד ספק שהיסוד החדש אינו אלא האקזיליקון שחזה מנדלייב חמש עשרה שנים קודם לכן. כי בקושי יכולה להיות הוכחה משכנעת יותר לתקפותה של דוקטרינת המחזוריות של יסודות מאשר התגלמות האקזיליציה ההיפותטית עד כה, והיא באמת משהו יותר מאשר אישור פשוט של תיאוריה שהועלתה באומץ - היא מסמלת תיאוריה יוצאת דופן. הרחבת שדה הראייה הכימי, צעד אדיר בתחום הדעת".
על בסיס החוק והטבלה של ד"י מנדלייב, חזו והתגלו גזים אצילים. ועכשיו החוק הזה משמש כוכב מנחה לגילוי או יצירה מלאכותית של יסודות כימיים חדשים. לדוגמה, ניתן לטעון שאלמנט מס' 114 יהיה דומה לעופרת (ekaslead) ו-#118 יהיה גז אצילי (ekaradon).
גילוי החוק המחזורי ויצירת טבלת הטבלה המחזורית של יסודות כימיים על ידי D.I. הוראה זו, בתורה, אפשרה לחשוף את המשמעות הפיזית של החוק המחזורי ולהסביר את סידור היסודות בטבלה המחזורית. זה הוביל לגילוי האנרגיה האטומית והשימוש בה לצרכי האנושות.