הסוגים העיקריים של קשרים כימיים. סוגי קשרים כימיים
הסוגים העיקריים של קשרים כימיים
סוגים עיקריים של קשרים כימיים.
אתה יודע שהאטומים יכולים להשתלב זה עם זה ליצירת חומרים פשוטים ומורכבים כאחד. במקרה זה נוצרים קשרים כימיים מסוגים שונים: יונים, קוולנטים (לא קוטביים וקוטביים), מתכת ומימן. אחד המאפיינים החיוניים ביותר של אטומי יסודות הקובעים אם נוצר קשר ביניהם - יוניים או קוולנטים, - זה אלקטרוניות, כלומר היכולת של האטומים בתרכובת למשוך אלקטרונים לעצמה.
הערכה כמותית מותנית של אלקטרונטיביות נותנת את קנה המידה של האלקטרוניטיביטי היחסי.
בתקופות נצפתה נטייה כללית לעלייה ברמת האלקטרונינגטיביות של האלמנטים, ובקבוצות ירידתם. אלמנטים על פי אלקטרונגטיוויות מסודרים בשורה, על בסיסם ניתן להשוות בין אלקטרונגטיביות של אלמנטים שנמצאים בתקופות שונות.
סוג הקשר הכימי תלוי בכמה גדול ההבדל בין האלקטרוניטיבים של האטומים המחברים של היסודות. ככל שהאטומים של היסודות היוצרים את הקשר נבדלים זה מזה ביחס האלקטרוניטיבי, כך הקישור הכימי קוטבי יותר. אי אפשר לשרטט גבול חד בין סוגי הקשרים הכימיים. ברוב התרכובות, סוג הקשר הכימי הוא בינוני; לדוגמה, קשר כימי קוולנטי קוטבי חזק הוא קרוב לקשר יוני. תלוי באילו מהמקרים המגבילים הקשר הכימי קרוב יותר לאופיו, הוא מוקצה לאיזון יוני או לקשר קוטבי קוולנטי.
קשר יונים.
קשר יוני נוצר על ידי אינטראקציה של אטומים, הנבדלים זה מזה בצורה חדה באלקטרונגטיביות.לדוגמא, מתכות טיפוסיות ליתיום (Li), נתרן (Na), אשלגן (K), סידן (Ca), סטרונציום (Sr), בריום (Ba) יוצרים קשר יוני עם טיפולים שאינם מתכות, בעיקר עם הלוגנים.
בנוסף להלידות מתכת אלקליות, נוצר קשר יוני גם בתרכובות כמו אלקליות ומלחים. לדוגמה, בנתרן הידרוקסיד (NaOH) ובנתרן סולפט (Na 2 SO 4), קיימים קשרים יוניים רק בין אטומי נתרן וחמצן (הקשרים הנותרים הם קוטביים קוולנטיים).
קשר לא-קוטבי קוולנטי.
כאשר אטומים עם אותה אלקטרונגטיביות מקיימים אינטראקציה, נוצרות מולקולות עם קשר קוולנטי לא קוטבי.קשר כזה קיים במולקולות של החומרים הפשוטים הבאים: H 2, F 2, Cl 2, O 2, N 2. הקשרים הכימיים בגזים אלה נוצרים על ידי זוגות אלקטרונים נפוצים, כלומר כאשר ענני האלקטרונים המקבילים חופפים, בשל האינטראקציה האלקטרונית-גרעינית, המתרחשת כאשר האטומים מתקרבים זה לזה.
בעת עריכת נוסחאות אלקטרוניות של חומרים, יש לזכור כי כל זוג אלקטרונים משותף הוא תמונה מותנית לצפיפות האלקטרונים המוגברת הנובעת מחפיפה של ענני האלקטרונים המקבילים.
קשר קוטבי קוולנטי.
באינטראקציה של אטומים, ערכם של אלקטרונגטיביות אשר שונה, אך לא בצורה חדה, מתרחשת מעבר של צמד האלקטרונים הכולל לאטום אלקטרונגטיבי יותר. זהו הסוג הנפוץ ביותר של קשר כימי המופיע בתרכובות אורגניות ואורגניות כאחד.
קשרים קוולנטיים כוללים במלואם את אותם קשרים הנוצרים על ידי מנגנון קבלת התורם, למשל, ביון הידרוקסוניום ואמוניה.
קשר מתכת.
הקשר, הנוצר כתוצאה מאינטראקציה של אלקטרונים חופשיים יחסית עם יוני מתכת, נקרא קשר המתכת.קשר מסוג זה מאפיין חומרים מתכתיים פשוטים.
מהות התהליך של היווצרות קשרים מתכתיים היא כדלקמן: אטומי מתכת מוותרים בקלות על אלקטרונים ערכיים והופכים ליונים טעונים חיוביים. אלקטרונים חופשיים יחסית, המנותקים מאטום, נעים בין יוני מתכת חיוביים. קשר מתכות נוצר ביניהם, כלומר נראה כי האלקטרונים מלטים יונים חיוביים של סריג הגביש של מתכות.
קשר מימן.
הקשר הנוצר בין אטומי המימן של מולקולה אחת לבין האטום של יסוד אלקטרונגטיבי חזק(O, N, F) מולקולה אחרת, הנקראת קשר מימן.
עלולה להתעורר השאלה: מדוע בדיוק נוצר מימן קשר כימי ספציפי כזה?
הסיבה לכך היא שהרדיוס האטומי של המימן הוא קטן מאוד. בנוסף, עם העקירה או השחרור המלא של האלקטרון היחיד שלו, מימן משיג מטען חיובי גבוה יחסית, שבגללו המימן של מולקולה אחת מתקיים אינטראקציה עם אטומים של אלמנטים אלקטרונגטיביים בעלי מטען שלילי חלקי, המהווה חלק ממולקולות אחרות (HF, H 2 O, NH 3) .
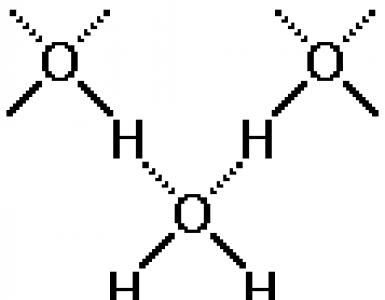
בואו נסתכל על כמה דוגמאות. בדרך כלל אנו מתארים את הרכב המים על ידי הנוסחה הכימית H 2 O. עם זאת, הדבר אינו מדויק לחלוטין. נכון יותר היה לציין את הרכב המים על ידי הנוסחה (H 2 O) n, כאשר n \u003d 2,3,4 וכו '. זה נובע מהעובדה שמולקולות מים אינדיבידואליות קשורות זו בזו באמצעות קשרי מימן.
קשר המימן נקרא בדרך כלל על ידי נקודות. הוא חלש בהרבה מהקשר היוני או הקוויאלי, אך חזק יותר מהאינטראקציה הבין-מולקולרית הרגילה.
נוכחותם של קשרי מימן מסבירה את העלייה בנפח המים עם הטמפרטורה יורדת. זה נובע מהעובדה שכאשר מורידים הטמפרטורה, המולקולות מתחזקות ולכן צפיפות ה"אריזה "שלהם יורדת.
כשלמדו כימיה אורגנית, עלתה השאלה הבאה: מדוע נקודות הרתיחה של אלכוהולים גבוהים בהרבה מהפחמימנים המקבילים? זה מוסבר על ידי העובדה שקשרי מימן נוצרים גם בין מולקולות אלכוהול.
עלייה בנקודת הרתיחה של אלכוהולים מתרחשת גם בגלל הגדלת המולקולות שלהם.
קשירת מימן אופיינית גם לתרכובות אורגניות רבות אחרות (פנולים, חומצות קרבוקסיליות וכו '). מתוך קורסים בכימיה אורגנית ובביולוגיה כללית, אתה יודע שנוכחותו של קשר מימן מסביר את המבנה המשני של חלבונים, את מבנה הסליל הכפול של ה- DNA, כלומר את תופעת ההשלמה.
מאמרים דומים:
כרטיס 10 תרכובות של קומפוזיציה מורכבת בהן ניתן להבחין בין אטום מרכזי (חומר מורכב) ומולקולות או יונים מחוברים ישירות (ליגנדים) נקראות תרכובות מורכבות. על פי תיאוריית התיאום של ורנר, כל מתחם מורכב נבדל ב ...
ניסוח החוק התקופתי של D. I. Mendeleev לאור התיאוריה של מבנה האטום. הקשר של החוק התקופתי והמערכת התקופתית עם מבנה האטומים. מבנה המערכת התקופתית D.I. Mendeleev.
האוניברסיטה הטכנולוגית הממלכתית במוסקבה "סטנקין" תקציר בכימיה "חיבור גופני" בביצוע: Fridland D.A.
מבנה אטום המימן במערכת התקופתית. מצב חמצון. שכיחות בטבע. מימן, כחומר פשוט שהמולקולות שלו מורכבות משני אטומים המקושרים זה לזה באמצעות קשר קוולנטי לא קוטבי. תכונות פיזיקו-כימיות.
צימוד אלקטרוסטטי: סוגי אינטראקציות. מאפיינים של קשרים קוולנטיים (אורך, קוטביות ואנרגיה). הערך הממוצע של רגעי הדיפול של קשרים וקבוצות פונקציונליות. מבנה המתאן. מבנה מולקולות עם n, o אטומים עם זוג אלקטרונים בודד.
רעיון מבנה המתאן (נוסחאות מולקולריות, אלקטרוניות ומבניות). תכונות פיזיקליות, בהיותן בטבען, סוג הקשר הכימי והמבנה המרחבי של מולקולה ואטום פחמן בשלושה מצבי valence, מושג ההכלאה.
ייצוגי השתתפות אטום המימן ביצירת שני קשרים כימיים. דוגמאות לתרכובות קשורות מימן. מבנה דימר מימן פלואוריד. אסוציאציות של מולקולות פלואוריד מימן. שיטות ספקטרוסקופיה מולקולריות. מטען חשמלי כולל.
תהליכי רדוקס הם בין התגובות הכימיות הנפוצות ביותר וחשיבות רבה בתאוריה ובפרקטיקה. הפחתת חמצון הוא אחד התהליכים החשובים ביותר של הטבע.
בנושא קשרי מתכת באריזה הדוקה של אלמנטים כימיים GG Filipenko Grodno ABSTRACT. בדרך כלל, בספרות, קשר מתכתי מתואר כממומש באמצעות החיברות של האלקטרונים החיצוניים של האטומים ואינו בעל רכוש כיווניות. למרות שיש פופ ...
כאשר נוצר קשר כימי מתרחשת חלוקה מחודשת בחלל של צפיפות אלקטרונים ששייכת במקור לאטומים שונים. מכיוון שאלקטרונים ברמה החיצונית פחות קשורים לגרעין, אלקטרונים אלה ממלאים תפקיד מרכזי ביצירת קשר כימי. מספר הקשרים הכימיים הנוצרים על ידי אטום נתון בתרכובת נקרא valency. האלקטרונים המעורבים ביצירת קשר כימי נקראים valence: עבור אלמנטים s- ו- p, אלה אלקטרונים חיצוניים, עבור אלמנטים d, אלקטרונים s חיצוניים (אחרונים) ואלקטרונים d שלפני אחרון. מנקודת המבט האנרגטית האטום היציב ביותר הוא זה ברמתו החיצונית שמכיל את המספר המרבי של אלקטרונים (2 ו -8 אלקטרונים). רמה זו נקראת הושלמה. הרמות שהושלמו הן עמידות מאוד ומאפיינות אטומי גז אצילי, ולכן בתנאים רגילים הם נמצאים בגז מונומטי אינרטי כימי.
לאטומים של אלמנטים אחרים רמות אנרגיה חיצוניות אינן שלמות. בתהליך של תגובה כימית, השלמת הרמות החיצוניות מתבצעת, המתבצעת באמצעות הצמדה או תרומה של אלקטרונים, וכן היווצרות של זוגות אלקטרונים משותפים. שיטות אלה מובילות ליצירת שני סוגים עיקריים של קשרים: קוולנטים ויוניים. לפיכך, במהלך היווצרות מולקולה, כל אטום נוטה לרכוש מעטפת אלקטרונים חיצונית יציבה: שני אלקטרון (דובלט) או שמונה אלקטרונים (אוקטט). סדירות זו עומדת בבסיס התיאוריה של היווצרות קשרים כימיים. היווצרות קשר כימי כתוצאה מהשלמת רמות חיצוניות באטומים היוצרים את הקשר מלווה בשחרור של כמות גדולה של אנרגיה, כלומר המראה של קשר כימי מתקדם תמיד בצורה אקסותרמית, מכיוון שהוא מוביל להופעת חלקיקים חדשים (מולקולות) יציבים יותר בתנאים רגילים, ולכן הם פחות אנרגיה מהמקור. אחד האינדיקטורים החיוניים שקובעים איזה קשר נוצר בין אטומים הוא אלקטרונגטיביות, כלומר היכולת של אטום למשוך לעצמו אלקטרונים מאטומים אחרים. החשיבות האלקטרונית של אטומי היסודות משתנה בהדרגה: בתקופות של המערכת התקופתית משמאל לימין, ערכה עולה ובקבוצות מלמעלה למטה הוא יורד.
קשר כימי עקב היווצרות של זוגות אלקטרונים נפוצים (קשורים) נקרא קוולנט .1) בואו ונבחן דוגמא להיווצרות קשר כימי בין אטומים עם אותה אלקטרונגטיביות, למשל, מולקולת מימן H2. היצירה של קשר כימי במולקולת מימן יכולה להיות מיוצגת כשתי נקודות: + -H -\u003e H: H או מקף המסמל זוג אלקטרונים: HH קשר קוולנטי הנוצר על ידי אטומים עם אותה אלקטרונגטיביות נקרא לא קוטבי. קשר כזה נוצר על ידי מולקולות דיאטומיות המורכבות מאטומים של יסוד כימי אחד: H 2, Cl 2 וכו '. 2) היווצרות של קשר קוולנטי בין אטומים, שהחשיבות האלקטרונית שלהם משתנה מעט. קשר קוולנטי הנוצר על ידי אטומים בעלי אלקטרונטיביות שונה נקרא קוטב. בהתקשרות קוטבית קוולנטית, צפיפות האלקטרונים מצמד האלקטרונים הכולל מועברת לאטום עם אלקטרונגטיביות רבה יותר. דוגמאות לכך הן מולקולות H2O, NH3, H2S, CH3Cl. הקשר הקוויליסטי (הקוטבי והלא פולוטרי) בדוגמאות שלנו נוצר בגלל אלקטרונים לא זוגיים של האטומים המחייבים. מנגנון כזה ליצירת קשרים קוולנטים נקרא חילופי דברים. מנגנון נוסף ליצירת קשרים קוולנטים הוא תורם-מקבל. במקרה זה הקשר מתעורר בגלל שני אלקטרונים מזוודים של אטום אחד (תורם) והמסלול החופשי של האטום השני (מקבל). דוגמה ידועה היא היווצרות יון אמוניום: H + +: NH 3 -\u003e [H: NH 3 | +<=====> NH 4 + תורם מקבל אלקטרונים אמוניום יון. במהלך היווצרות יון אמוניום, אדי החנקן האלקטרוני הופך נפוץ עבור אטומי N ו- H, כלומר נוצר קשר רביעי, שאינו שונה משלושת האחרים. הם מתוארים באותה צורה:
קשר יוני נוצר בין אטומים, שהחשמל האלקטרוניטיבי שלהם שונה באופן דרסטי. ניתן לייצג את התצורה האלקטרונית של אטומי נתרן וכלור: 11 Na ls2 2s2 2p 6 3s1; 17 Cl ls2 2p 6 Зs2 3р5 כמו אלה אטומים עם רמות אנרגיה לא שלמות. ברור, להשלמתם, קל יותר לתת אלקטרון אחד לאטום הנתרן מאשר לחבר שבעה, וקל יותר לחבר אלקטרון אחד לאטום הכלור מאשר לתת שבעה. בתגובה כימית, אטום נתרן מוותר לחלוטין על אלקטרון אחד, ואטום כלור לוקח אותו. באופן סכמטי אפשר לכתוב את זה באופן הבא: Na. - l e -\u003e Na + נתרן יון, מעטפת יציבה של שמונה אלקטרונים 1s2 2s2 2p6 עקב רמת האנרגיה השנייה. : Cl + 1е -\u003e .Cl - יון כלור, מעטפת יציבה של שמונה אלקטרונים. בין יוני Na + ו- Cl- מתעוררים כוחות משיכה אלקטרוסטטיים, וכתוצאה מכך מתחם.
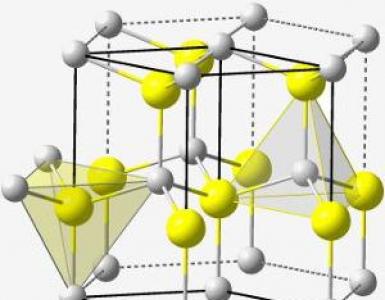
קשר כימי הנוצר על ידי משיכה אלקטרוסטטית בין יונים נקרא קשר יוני. תרכובות הנוצרות על ידי משיכה של יונים נקראות יוניות. תרכובות יוניות מורכבות ממולקולות בודדות במצב אדי בלבד. במצב המוצק (הגבישי), תרכובות יוניות מורכבות מיונים חיוביים ושליליים הממוקמים באופן טבעי. מולקולות במקרה זה נעדרות. תרכובות יוניות נוצרות שונות זו מזו בעוצמה של אלמנטים אלקטרוניים של תת-הקבוצות העיקריות של קבוצות I ו- II ושל תת-הקבוצות העיקריות של קבוצות VI ו- VII. יש מעט יחסית תרכובות יוניות. לדוגמא, מלחים אורגניים: NH4Cl (אמוניום יון NH4 + ויון כלור Cl-), כמו גם תרכובות אורגניות דמויי מלח: מלחי אלכוהולית של חומצות קרבוקסיליות, מלחי אמינים קשר לא-קוטבי לא קוטבי וקשר יוני הם שני מקרים מגבילים של חלוקת צפיפות אלקטרונים. קשר לא קוטבי מתאים לחלוקה אחידה של קלסר שני ענני אלקטרונים בין אטומים זהים. נהפוך הוא, במלכודת יונית, ענן האלקטרונים המחייב שייך כמעט לחלוטין לאחד האטומים. ברוב התרכובות, קשרים כימיים הם ביניים בין סוגים אלה של קשרים, כלומר, נוצר בהם קשר קוולנטי קוטבי.
קשר מתכתי קיים במתכות במוצק במצב נוזלי. בהתאם למצב במערכת התקופתית, לאטומי המתכת יש מספר קטן של אלקטרונים ערכיים (1-3 אלקטרונים) ואנרגיית יינון נמוכה (ניתוק אלקטרונים). לכן, אלקטרונים של עריכה מוחזקים חלש באטום, מתנתקים בקלות ויש להם יכולת לנוע לאורך הגביש. בצמתים של סריג הגביש של מתכות ישנם אטומים חופשיים, סוסים טעונים חיובית, וחלק מאלקטרונים הערכיים, הנעים באופן חופשי בנפח סריג הגביש, יוצר "גז אלקטרונים" המספק קשר בין אטומי המתכת. הקשר שאלקטרונים חופשיים יחסית נושאים בין יוני מתכת בסריג הגביש מכונה קשר מתכת. קשר מתכתי מתעורר עקב החיברות של אטומי אלקטרונים ערכיים. עם זאת, יש הבדל משמעותי בין סוגים אלה של תקשורת. אלקטרונים המבצעים קשרים קוולנטיים נמצאים בעיקר בסביבה הקרובה של שני אטומים מחוברים. במקרה של מליטה מתכתית, האלקטרונים המקשרים נעים דרך המתכת. זה קובע את הסימנים הכלליים של מתכות: ברק מתכתי, מוליכות טובה של חום וחשמל, משיכות, משיכות וכו '. התכונה הכימית הכללית של מתכות היא יכולת הפחתה הגבוהה יחסית שלהם.
קשרי מימן עשויים להיווצר בין אטום מימן הקשור לאטום של יסוד אלקטרונגטיבי לבין יסוד אלקטרונגטיבי שיש לו זוג אלקטרונים חופשי (O, F, N). קשר המימן נובע ממשיכה אלקטרוסטטית, המאפשרת את גודלו הקטן של אטום המימן, ובחלקו על ידי אינטראקציה בין תורם ומקבל. קשר המימן עשוי להיות בין-מולקולרי ואינטרמולולקולרי. לקשרים 0-H יש אופי קוטבי בולט: קשר המימן חלש בהרבה מהאיון או הקוויוולנטי, אך חזק יותר מהאינטראקציה הבין-מולקולרית. קשרי מימן גורמים לתכונות פיזיקליות של חומרים (למשל, נקודות רתיחה גבוהות). נפוצים במיוחד קשרי מימן במולקולות של חלבונים, חומצות גרעין ותרכובות חשובות מבחינה ביולוגית, ומספקים להם מבנה (ארגון) מרחבי מסוים.
קשר כימי נוצר עקב יחסי גומלין בין שדות חשמליים הנוצרים על ידי אלקטרונים וגרעינים אטומיים, כלומר קשרים כימיים הם חשמליים באופיים.
תחת קשר כימי להבין את התוצאה של אינטראקציה של 2 אטומים או יותר המובילים להיווצרות מערכת פוליאומית יציבה. תנאי להיווצרות קשר כימי הוא ירידה באנרגיה של האטומים המתקשרים, כלומר המצב המולקולרי של חומר חיובי אנרגטית מזה של האטום. בהיווצרות קשר כימי נוטים האטומים לקבל מעטפת אלקטרונית מלאה.
הבחינו בין קוולנטיים, יוניים, מתכתיים, מימן ואינטר-מולקולריים.
קשר קוולנטי - הסוג הנפוץ ביותר של קשר כימי הנובע מהסוציאליזציה של זוג אלקטרונים מנגנון החלפה -כאשר כל אחד מהאטומים האינטראקציה מספק אלקטרון אחד, או מנגנון מקבל תורםאם זוג אלקטרונים מועבר לשימוש כללי על ידי אטום אחד (תורם - N, O, Cl, F) לאטום אחר (acceptor - אטומי d-element).
מאפייני קשרים כימיים.
1 - ריבוי של קשרים - בין אטומים 1 רק קשר sigma 1 אפשרי, אך יחד איתו יכולים להיות קשרי pi ו- delta בין אותם אטומים, מה שמוביל להיווצרותם של קשרים מרובים. הריבוי נקבע על ידי מספר הזוגות האלקטרוניים הנפוצים.
2 - אורך קשר - המרחק הבין-גרעיני במולקולה, ככל שהריבוי גדול יותר, כך אורכו קטן יותר.
3 - חוזק הקשר - זו כמות האנרגיה הדרושה לשבירה
4 - רוויה של קשר קוולנטי באה לידי ביטוי בכך שמסלולית אטומית אחת יכולה לקחת חלק בהיווצרות c.c. מאפיין זה קובע את הסטואיציומטריה של תרכובות מולקולריות.
5 - כיווניות תלוי בצורתם ובכיוונם של ענני האלקטרונים בחלל, כאשר הם חופפים, יכולים להיווצר תרכובות עם צורה ליניארית וזוויתית של המולקולות.
קשר איוני – נוצר בין אטומים השונים מאוד ביחס ל אלקטרונגטיביות. אלה תרכובות של תת-הקבוצות העיקריות מקבוצות 1 ו -2 עם אלמנטים מתת-הקבוצות העיקריות של קבוצות 6 ו -7. היוני מכונה קשר כימי, המתבצע כתוצאה ממשיכה אלקטרוסטטית הדדית של יונים טעונים בניגוד.
מנגנון היווצרותם של קשרים יוניים: א) היווצרות של יונים של אטומים אינטראקציה; ב) היווצרות מולקולה עקב משיכת יונים.
ישירות וחוסר הרוויה של הקשר היוני
שדות הכוח של היונים מפוזרים בצורה אחידה לכל הכיוונים, ולכן כל יון יכול למשוך לעצמו יונים של הסימן ההפוך לכל כיוון שהוא. זו אי-ההכוונה של הקשר היוני. אינטראקציה של 2 יונים עם סימן הפוך אינה מובילה לפיצוי הדדי מוחלט של שדות הכוח שלהם. לכן הם שומרים על היכולת למשוך יונים לכיוונים אחרים, כלומר קשר יוני מאופיין באי-רוויה. לכן כל יון בתרכובת היונית מושך אליו כל כך הרבה יונים מהסימן ההפוך שנוצר סריג גביש מסוג יוני. אין גבולות מולקולות בגביש יוני. כל יון מוקף במספר מסוים של יונים של סימן שונה (מספר הקואורדינציה של היון).
קשר מתכת - כימיה. תקשורת במתכות. למתכות יש עודף של אורביטליות של ערכים וחוסר באלקטרונים. כאשר אטומים מתקרבים זה לזה, חופפים האורביטלים שלהם, וכתוצאה מכך האלקטרונים עוברים בחופשיות ממסלול אחד למשנהו, וקשרים בין כל אטומי המתכת מתממשים. הקשר שהאלקטרונים החופשיים יחסית מייצרים בין יוני מתכת בסריג הגביש מכונה קשר המתכת. הקשר ממוקד בחוזקה ואין לו כיווניות ורוויה, מכיוון אלקטרונים של עריכה מופצים באופן אחיד ברחבי הגביש. נוכחותם של אלקטרונים חופשיים קובעת את קיומם של תכונות משותפות של מתכות: אטימות, ברק מתכתי, מוליכות חשמלית ותרמית גבוהה, משיכות ודקיקות.
קשר מימן - הקשר בין אטום H לבין יסוד שלילי חזק (F, Cl, N, O, S). קשרי מימן יכולים להיות תוך-מולקולריים. השמש חלשה יותר מהקשר הקובלנטי. התרחשות השמש מוסברת על ידי פעולת כוחות אלקטרוסטטיים. לאטום H יש רדיוס קטן וכאשר הוא מעקר או מחזיר אלקטרון בודד, H רוכש מטען חיובי חזק, הפועל על אלקטרונגטיביות.















קשר קוולנטי - זהו קשר בין שני אטומים עקב היווצרות של זוג אלקטרונים משותף.
קשר לא-קוטבי קוולנטי– הקשר הזה בין אטומים שווה
אלקטרוניות.לדוגמא: H 2, O 2, N 2, Cl 2 וכו '. הרגע הדיפול של קשרים כאלה הוא אפס.
קשר קוטבי קוולנטי – הקשר הזה בין אטומים עם אלקטרונגטיביות שונה.אזור חופפי ענני האלקטרונים נע לעבר אטום אלקטרונגטיבי יותר.
לדוגמה, H - Cl (H b + → Cl b–).
לקישור קוולנטי יש את התכונות הבאות:
- רוויה - יכולתו של אטום ליצור את מספר הקשרים הכימיים התואמים את ערכיותו;
- כיווניות - חפיפה של עננים אלקטרוניים מתרחשת בכיוון המספק את הצפיפות המרבית של חפיפה.
קשר איוני– זהו קשר בין יונים טעונים בניגוד. זה יכול להיחשב כמקרה קיצוני של קשר קוטבי קוולנטי. קשר כזה מתעורר עם הבדל גדול ביחס האלקטרוניטיבי של האטומים,
יוצרים קשר כימי. לדוגמא, במולקולת NaF, ההבדל
אלקטרונטיביות היא 4.0 – 0.93 \u003d 3.07, מה שמוביל למעבר כמעט מוחלט של האלקטרון מנתרן לפלואור:
האינטראקציה של יונים עם הסימן ההפוך אינה תלויה בכיוון, וכוחות קולומב אינם בעלי תכונת הרוויה. מכוח זה, לקשר היוני אין כיווניות ורוויה.
קשר מתכת– זהו הקשר של יוני מתכת טעונים באופן חיובי עם אלקטרונים חופשיים.
לרוב המתכות מספר תכונות שהן כלליות באופיין ונבדלות מתכונותיהם של חומרים אחרים. תכונות כאלה הן נקודות התכה גבוהות יחסית, היכולת לשקף אור, מוליכות תרמית גבוהה וחשמלית. זו תוצאה של היווצרות סוג מיוחד של קשר - קשר מתכת - בין אטומי מתכת.
באטומי מתכת האלקטרונים של עריכה קשורים חלש לגרעינים שלהם וניתן בקלות לנתק אותם. כתוצאה מכך, יוני מתכת מטענים חיוביים ואלקטרונים "חופשיים" מופיעים בסריג הגביש של המתכת, אשר האינטראקציה האלקטרוסטטית שלהם מספקת קשר כימי.
קשר מימן– זהו קשר דרך אטום מימן הקשור לאלמנט אלקטרוני מאוד.
אטום המימן הקשור לאלמנט אלקטרונגטיבי ביותר (פלואור, חמצן, חנקן וכו '), מפטיר כמעט לחלוטין אלקטרון מהסלון הערבי. המסלול החופשי שנוצר יכול ליצור אינטראקציה עם זוג אלקטרונים בודד של אטום אלקטרונגטיבי אחר, וכתוצאה מכך קשר מימן. על הדוגמא של מולקולות מים וחומצה אצטית, הקשר המימני מוצג בקווים מנוקדים:
קשר זה חלש בהרבה מקשרים כימיים אחרים (האנרגיה של היווצרותו היא 10–40 kJ / mol). קשרי מימן יכולים להופיע הן בין מולקולות שונות והן בתוך מולקולה.
קשר המימן ממלא תפקיד חשוב ביותר בחומרים אנאורגניים כמו מים, חומצה הידרפלואורית, אמוניה וכו ', כמו גם במקרומולקולות ביולוגיות.
הסוגים העיקריים של קשרים כימיים.
אתה יודע שהאטומים יכולים להשתלב זה עם זה ליצירת חומרים פשוטים ומורכבים כאחד. במקרה זה נוצרים קשרים כימיים מסוגים שונים: יונים, קוולנטים (לא קוטביים וקוטביים), מתכת ומימן. אחד המאפיינים החיוניים ביותר של אטומי יסודות הקובעים אם נוצר קשר ביניהם - יוניים או קוולנטים, - זה אלקטרוניות, כלומר היכולת של האטומים בתרכובת למשוך אלקטרונים לעצמה.
הערכה כמותית מותנית של אלקטרונטיביות נותנת את קנה המידה של האלקטרוניטיביטי היחסי.
בתקופות נצפתה נטייה כללית לעלייה ברמת האלקטרונינגטיביות של האלמנטים, ובקבוצות ירידתם. אלמנטים על פי אלקטרונגטיוויות מסודרים בשורה, על בסיסם ניתן להשוות בין אלקטרונגטיביות של אלמנטים שנמצאים בתקופות שונות.
סוג הקשר הכימי תלוי בכמה גדול ההבדל בין האלקטרוניטיבים של האטומים המחברים של היסודות. ככל שהאטומים של היסודות היוצרים את הקשר נבדלים זה מזה ביחס האלקטרוניטיבי, כך הקישור הכימי קוטבי יותר. אי אפשר לשרטט גבול חד בין סוגי הקשרים הכימיים. ברוב התרכובות, סוג הקשר הכימי הוא בינוני; לדוגמה, קשר כימי קוולנטי קוטבי חזק הוא קרוב לקשר יוני. תלוי באילו מהמקרים המגבילים הקשר הכימי קרוב יותר לאופיו, הוא מוקצה לאיזון יוני או לקשר קוטבי קוולנטי.
קשר יונים.
קשר יוני נוצר על ידי אינטראקציה של אטומים, הנבדלים זה מזה בצורה חדה באלקטרונגטיביות.לדוגמא, מתכות טיפוסיות ליתיום (Li), נתרן (Na), אשלגן (K), סידן (Ca), סטרונציום (Sr), בריום (Ba) יוצרים קשר יוני עם טיפולים שאינם מתכות, בעיקר עם הלוגנים.
בנוסף להלידות מתכת אלקליות, נוצר קשר יוני גם בתרכובות כמו אלקליות ומלחים. לדוגמה, בסודיום הידרוקסיד (NaOH) ובנתרן סולפט (Na 2 SO 4) ) קשרים יוניים קיימים רק בין אטומי נתרן וחמצן (הקשרים הנותרים הם קוטביים קוולנטיים).
קשר לא-קוטבי קוולנטי.
כאשר אטומים עם אותה אלקטרונגטיביות מקיימים אינטראקציה, נוצרות מולקולות עם קשר קוולנטי לא קוטבי.קשר כזה קיים במולקולות של החומרים הפשוטים הבאים: H 2, F 2, Cl 2, O 2, N 2 . הקשרים הכימיים בגזים אלה נוצרים על ידי זוגות אלקטרונים נפוצים, כלומר כאשר ענני האלקטרונים המקבילים חופפים, בשל האינטראקציה האלקטרונית-גרעינית, המתרחשת כאשר האטומים מתקרבים זה לזה.
בעת עריכת נוסחאות אלקטרוניות של חומרים, יש לזכור כי כל זוג אלקטרונים משותף הוא תמונה מותנית לצפיפות האלקטרונים המוגברת הנובעת מחפיפה של ענני האלקטרונים המקבילים.
קשר קוטבי קוולנטי.
באינטראקציה של אטומים, שערך האלקטרוניטיביות שלהם שונה, אך לא בצורה חדה, יש מעבר של צמד האלקטרונים הכולל לאטום אלקטרונגטיבי יותר. זהו הסוג הנפוץ ביותר של קשר כימי המופיע בתרכובות אורגניות ואורגניות כאחד.
קשרים קוולנטיים כוללים במלואם את אותם קשרים הנוצרים על ידי מנגנון קבלת התורם, למשל ביונים הידרוקסוניום ואמוניה.
קשר מתכת.
הקשר, הנוצר כתוצאה מאינטראקציה של אלקטרונים חופשיים יחסית עם יוני מתכת, נקרא קשר המתכת.קשר מסוג זה מאפיין חומרים מתכתיים פשוטים.
מהות התהליך של היווצרות קשרים מתכתיים היא כדלקמן: אטומי מתכת מוותרים בקלות על אלקטרונים ערכיים והופכים ליונים טעונים חיוביים. אלקטרונים חופשיים יחסית, המנותקים מאטום, נעים בין יוני מתכת חיוביים. קשר מתכות נוצר ביניהם, כלומר נראה כי האלקטרונים מלטים יונים חיוביים של סריג הגביש של מתכות.
קשר מימן.
הקשר הנוצר בין אטומי המימן של מולקולה אחת לבין האטום של יסוד אלקטרונגטיבי חזק(O, N, F) מולקולה אחרת, הנקראת קשר מימן.
עלולה להתעורר השאלה: מדוע בדיוק נוצר מימן קשר כימי ספציפי כזה?
הסיבה לכך היא שהרדיוס האטומי של המימן הוא קטן מאוד. בנוסף, עם העקירה או השחרור המלא של האלקטרון היחיד שלה, מימן משיג מטען חיובי גבוה יחסית, שבגללו המימן של מולקולה אחת מתקיים אינטראקציה עם אטומים של יסודות אלקטרונגטיביים בעלי מטען שלילי חלקי, המהווה חלק ממולקולות אחרות (HF, H 2 O, NH 3 ).
בואו נסתכל על כמה דוגמאות. בדרך כלל אנו מתארים את הרכב המים עם הנוסחה הכימית H2
עם זאת, זה לא לגמרי מדויק. יהיה נכון יותר לציין את הרכב המים לפי הנוסחה (H2
O) n, כאשר n \u003d 2,3,4 וכו '. זה נובע מהעובדה שמולקולות מים אינדיבידואליות קשורות זו בזו באמצעות קשרי מימן.
קשר המימן נקרא בדרך כלל על ידי נקודות. הוא חלש בהרבה מהקשר היוני או הקוויאלי, אך חזק יותר מהאינטראקציה הבין-מולקולרית הרגילה.
נוכחותם של קשרי מימן מסבירה את העלייה בנפח המים עם הטמפרטורה יורדת. זה נובע מהעובדה שכאשר מורידים הטמפרטורה המולקולות מתחזקות ולכן צפיפות ה"אריזה "שלהם יורדת.
כשלמדו כימיה אורגנית, עלתה השאלה הבאה: מדוע נקודות הרתיחה של אלכוהולים גבוהים בהרבה מהפחמימנים המקבילים? זה מוסבר על ידי העובדה שקשרי מימן נוצרים גם בין מולקולות אלכוהול.
עלייה בנקודת הרתיחה של אלכוהולים מתרחשת גם בגלל הגדלת המולקולות שלהם.
קשירת מימן אופיינית גם לתרכובות אורגניות רבות אחרות (פנולים, חומצות קרבוקסיליות וכו '). מתוך קורסים בכימיה אורגנית ובביולוגיה כללית, אתה יודע שנוכחותו של קשר מימן מסביר את המבנה המשני של חלבונים, את מבנה הסליל הכפול של ה- DNA, כלומר את תופעת ההשלמה.