Конспект урока "ковалентная химическая связь". Природа химической связи. Ковалентная связь
Виды химических связей.
Типы кристаллических решеток
План
1.Сущность образования химической связи.
3. Ионная химическая связь.
4. Ковалентная химическая связь.
5.Металлическая химическая связь.
6. Агрегатные состояния веществ и водородная связь.
7.Виды кристаллических решеток
1.Сущность образования химической связи.
На внешнем энергетическом уровне может быть от одного до восьми электронов;
Если количество электронов на внешнем уровне максимальна – уровень завершённый (у инертных газов(He , Ne , Ar , Kr , Xe , Re ));
:: Ne ::
Внешние уровни других элементов не завершены и в процессе химического взаимодействия они завершаются с образованием химической связи.
H ∙ + ∙ H = H (:) H
Химическая связь осуществляется за счёт валентным электронов и не спаренных, но по разному.
Основной движущей силой приводящей к образованной химической связи является стремление атомов завершить энергетический уровень.
Образование химической связи сопровождаются выделением энергии.
Химическая связь – это взаимодействие двух или нескольких атомов приводящей к образованию устойчивой молекулы.
2.Понятие электроотрицательности (ЭО).
Электротрицательность(ЭО) – это способность атома одного элемента присоединять электроны от атомов других элементов.
В периоде (слева направо) ЭО увеличивается т. к. с увеличением заряда ядра атомов уменьшается атомный радиус.
В группах (сверху вниз) ЭО уменьшается т.к. увеличивается атомный радиус.
У металлов ЭО меньше чем у неметаллов.
3.Ионная химическая связь
Ионная связь образуется в результате полного переноса одного или нескольких электронов от одного атома к другому. Такой тип связи возможен только между атомами элементов, электроотрицательности которых значительно отличаются. При этом происходит переход электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Надо запомнить, что такой тип химической связи образуется между атомами металлов и неметаллов. Например, элементы первой и второй группы главных подгрупп периодической системы (типичные металлы) непосредственно соединяются с элементами шестой и седьмой группы главных подгрупп периодической системы (типичные неметаллы).
Рассмотрим механизм образования ионного связи в составе калий хлорид. Атом калия содержит один валентный электрон (определяем по номеру группы, в которой находится Калий). Атом хлора содержит семь валентных электронов (определяем по номеру группы, в которой находится хлор). При взаимодействии атомов калия с атомами хлора валентный электрон атома калия полностью переходит на внешний уровень атома хлора, достраивая его в восьмиелектроннои структуры. При этом атом калия, теряя электрон, приобретает положительный заряд +1 и превращается в катион K + , а атом хлора, присоединяя электрон, приобретает отрицательный заряд -1 и превращается в анион Cl - . Разноименно заряженные ионы притягиваются благодаря электростатическим силам и образуется соединение калий хлорид. Этот процесс можно изобразить схемой:
0 0 + -
K ∙ + ∙: Cl :: → K [:: Cl ::]
Химическая связь. Строение вещества.
Инертные газы (VIII гр. гл. подгр.) одноатомны
внешний электронный слой завершенный устойчивый
Другие изолированные атомы стремятся к ns 2 np 6 (или к Is 2). В результате образуется система связанных атомов и выделяется энергия.
Химическая связь (х. с.) - это совокупность сил, удерживающих атомы друг около друга.
Физическая природа х. с. едина - это ядерно-электронное взаимодействие.
Деление х. с. на виды условно и связано с природой химических элементов.
![]()
1. X. с. между типичными М и типичными Нем (большая разница в размерах атомов и ЭО) - ионная (связь между катионами и анионами за счет электростатического притяжения):

Примеры других веществ: CaO, LiF, K 3 N, NaH, ВаСl 2 , CsF (ионность связи 89 %) - твердые, тугоплавкие, растворы и расплавы электропроводны (NaCl = Na + + Сl -), многие растворимы в Н 2 О.
2. X. с. между Нем (или М и Нем с небольшой разницей в размерах атомов и ЭО) - ковалентная (с помощью общих пар ē):
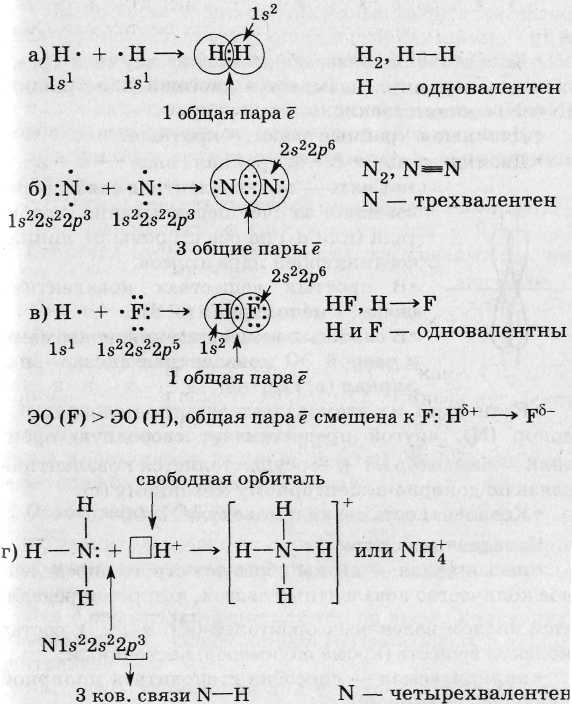
При образовании ковалентной связи перекрываются орбитали внешнего слоя, имеющие неспаренные ē с противоположными спинами.
Ковалентная связь, образованная одной общей парой ē, называется одинарной (Н - Н, Н - Сl). Одинарная связь - всегда α-связь.
α-Связь - это ковалентная связь, образованная за счет перекрывания орбиталей по линии, соединяющей ядра атомов:
Ковалентная связь, образованная двумя и тремя общими парами ē, называется двойной или тройной
(N ≡ N) соответственно.
Двойные и тройные связи - кратные.
Двойная связь → σ + π ; тройная связь → σ + 2π.

π-Связь - это ковалентная связь, образованная за счет перекрывания р-орбитали (или d-) по обе
стороны от линии, соединяющей ядра атомов.
В простых веществах ковалентная связь - неполярная (а, б).
В сложных веществах между атомами с разной ЭО ковалентная связь - полярная (в, г).
Если один из атомов дает электронную пару - донор (N), другой предоставляет свободную орбиталь - акцептор (Н +), =» осуществляется ковалентная связь по донорно-акцепторному механизму (г).
Ковалентность связи в молекуле Н 2 90% .
Ковалентная связь:
Насыщаемая - атомы образуют строго определенное количество
ковалентных связей, которое определяется числом валентных
орбиталей ![]() состав
молекул веществ (кроме полимеров) постоянный;
состав
молекул веществ (кроме полимеров) постоянный;
Поляризуемая - способна становиться полярной или более полярной;
Направленная - области перекрывания орбиталей располагаются определенным образом по отношению к взаимодействующим атомам, что влияет на пространственное строение (геометрию) многоатомных молекул и других частиц.
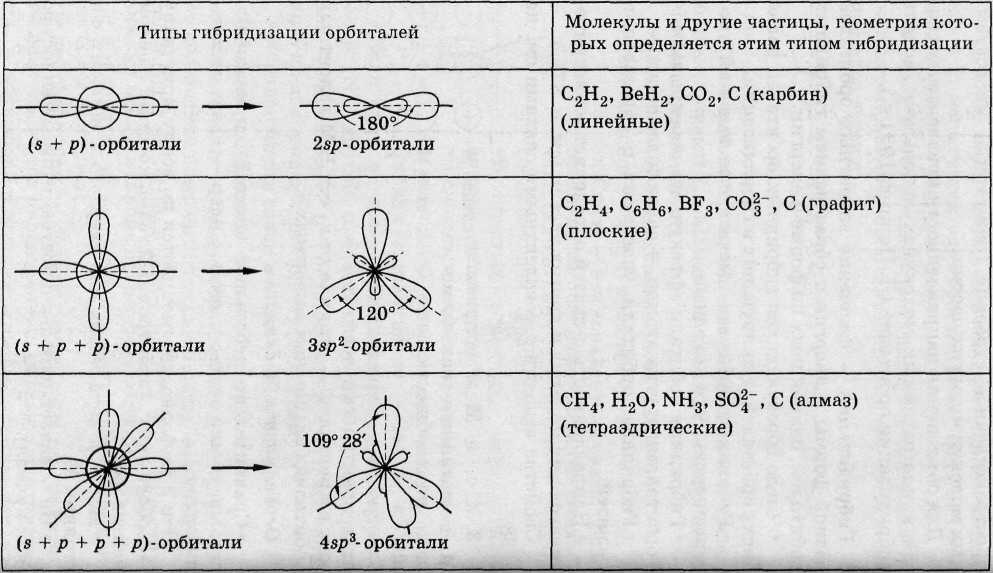
Для объяснения направленности ковалентных связей в многоатомных молекулах используют модель гибридизации орбиталей (Л. Полинг, 1931 г.).
Гибридизация - смешение валентных орбиталей разной формы и энергии с образованием гибридных орбиталей, одинаковых по форме и энергии.
Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
Гибридные орбитали имеют более высокий уровень энергии, чем исходные.
Гибридные орбитали эффективнее перекрываются с орбиталями других атомов, => связи более прочные.
Гибридные орбитали участвуют в образовании σ-связей.
Направленность σ-связей определяет геометрическую форму молекул и других частиц.
Свойства веществ с ковалентными связями.
3. X. с. в М и сплавах. М - металлическая (основана на обобществлении - как в к. с. - валентных электронов, принадлежащих практически всем атомам в кристалле - отличие от к. с). В М валентных орбиталей больше, чем валентных ē.

Особенности М связи:
Сравнительно небольшое число ё одновременно связывает множество атомных ядер - связь делокализована.
Эти ē свободно перемещаются по всему кристаллу («свободные ё», «электронный газ»), который в целом нейтрален.
М связь характерна для твердого и жидкого состояний М.
Не обладает направленностью и насыщенностью (как ионная).
Вещества с ковалентными связями (кристаллы).

Общие физические свойства М: твердость (кром е Hg), металлический блеск, непрозрачность, тепло- и
электропроводность ( ↓ с t), пластичность, прочность, нерастворимость в Н 2 О (М Щ и М ЩЗ с ней взаимодействуют) и др.
4. Водородная связь - связь между молекулами или частями больших молекул.
Механизм образования:
1) электростатическое притяжение между атомом Н (δ +) одной молекулы (или ее части) и сильно ЭО атомом F, О, N (δ -) другой молекулы (или ее части);
2) донорно-акцепторное взаимодействие маленького атома Н δ+ , способного близко подходить к другим атомам с неподеленной парой ē, таким, как F, О, N (реже Сl и S).
Межмолекулярные: NH 3 , H 2 O, HF, спирты, карбоновые кислоты; амины и др.
Внутримолекулярные: полипептиды, нуклеиновые кислоты и др.
Влияние на свойства: увеличение плотности, t ПЛ, t КИП, растворимость в Н 2 О.
Ассоциация молекул за счет водородных связей (...)

Энергия связи Е (мера ее прочности) - энергия, необходимая для разрыва данной х. с. в 1 моль вещества (кДж/моль):
Длина связи - межъядерное расстояние (1 нм = = 10 -9 м, 1пм = 10 -12 м).
План – конспект урока.
Предмет: Химия
Класс: 8
Учебник: Тема урока: Виды химической связи
Тип урока: Урок изучения и закрепления нового материала
Цели урока:
Научить определять виды химической связи и составлять схемы образования ионной связи.
Продолжить формирование убежденности в познаваемости мира веществ и взаимосвязи противоположностей;
Продолжить развитие умений анализировать, систематизировать, делать выводы.
Задачи урока :
1. Образовательные :
Продолжить развитие представлений о строении вещества;
- продолжать формировать понятие о строении атома, понятия химическая связь;
- обобщить знания о химической связи и ее видах;
- способствовать развитию умений составлять электронные и структурные формулы соединений и объяснять механизм образования различных видов химической связи.
- продолжить формирование интереса к изучению химии;
2. Развивающие :
Продолжить формирование умений и навыков работы с ПСХЭ Д.И.Менделеева;
Способствовать развитию коммуникативных навыков, логического мышления, совершенствовать основные мыслительных операций (анализ, синтез, сравнение, обобщение);
Развивать познавательную активность учащихся к предмету через ИКТ, умения обобщать и делать выводы при изучении и закреплении материала
3. Воспитательные:
Способствовать формированию навыков культуры межличностного общения на примере умения слушать друг друга, анализировать ответы товарищей;
Продолжить развивать химическую речь, обогащать ее словарный запас при устных ответах и грамотное выполнение при самостоятельных заданиях;
Прививать аккуратность при оформлении заданий в тетради.
Основные понятия: Металлы; неметаллы; ионная связь; ион, катион, анион. Электронная формула, структурная формула.
Планируемые результаты обучения :
Учащиеся должны знать:понятия «ион», «заряд иона», «ионная связь»,
Учащиеся должны уметь:
Составлять схемы образования ионной;
Форма учебной деятельности : фронтальная работа, работа в группе, индивидуальная, работа с алгоритмом, самостоятельная работа, тестирование.
Оборудование и реактивы :
Периодическая система химических элементов Д.И.Менделеева,
Мультимедиа проектор, презентация,
Алгоритм составления схемы видов химической связи,
Карточки с заданиями.
Структура урока :
1. Организационно-подготовительный этап.
2. Актуализация знаний
3. Изучение нового материала
4. Самостоятельная работа
5. Рефлексия
6. Домашнее задание
Ход урока
Каково настроение на начало урока?
Хочу, чтобы вы поприветствовали меня по - химически, т.е.: я называю каждому из вас химический элемент, а вы выходите к доске и записываете его символ . (Калий, барий, фосфор, сера, натрий, хлор, кислород, углерод, водород)
Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой учащихся. Создание спокойной, деловой обстановки.
2. Актуализация знаний
- Скажите, пожалуйста, чаще всего химические элементы существуют в каком виде?
А если есть соединение, значит между атомами элементов в этом соединении существует какая-то связь. Существует?
Анализ эпиграфа урока, взаимосвязь с темой урока. (Слайд 1).
«Вопрос о природе химической связи – сердце всей химии» (Брайк Кроунфорд-мл.).
- «Сегодня на уроке мы повторим и обобщим имеющиеся знания о строение атома и рассмотрим химическую связь и ее типы (запись числа и темы в тетради, слайд 1)
Сообщаю задачи нашего урока: (Слайд 2)
1) понятие химическая связь
изучить механизм образования ионной химической связи
Научиться составлять электронную формулу ионов;
актуализировать знания о различных видах химической связи
2) повторить схемы образования веществ с разным видом связи
3) продолжить формирование умения записывать их на примерах
4) сравнить разные виды связи ,
закрепим полученные знания на практике
Работать сегодня будем по следующему плану (на доске):
3 . Повторение и обобщение изученного материала.
Повторение основных понятий темы:
Мы начинаем - по нашему плану – разминка, в ходе которой вспомним основные понятия и определения, которые необходимы для понимания темы. На слайдах будут появляться вопросы, на которые необходимо ответить, (Слайд 5)
– Атом, какого химического элемента имеет заряд ядра +11
– Записать схему электронного строения атома натрия
– Внешний слой завершен?
–
– Атом, какого химического элемента имеет заряд ядра +17
– Записать схему электронного строения атома хлора
– Внешний слой завершен?
– Как добиться завершения заполнения электронного слоя?
3. Изучение нового материала
Подвожу итоги фронтального опроса.
Ионной, называется химическая связь, образующуюся между ионами.
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного. элемента. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.
При отдаче электронов образуется положительно заряженный ион- катион , при присоединении-отрицательный- анион.
2. Предлагаю учащимся объяснить алгоритм определения вида химической связи различных веществ. (Слайд6-10)
Типы химических связей
неметаллы+ неметаллыметаллы + неметаллы
металлическая
ковалентная неполярная
ковалентная
полярная
ионная
Физкультминутка:
«Химическая гимнастика»
Учитель называет:
1. Химический элемент – вращение плечами назад,
вещество - вращение плечами вперёд;
кислород, озон, углерод, алмаз, кремний, горный хрусталь, сера, железо, магний, вода, мел, сахар.
13. Формулу простого вещества – поворот головы к правому плечу,
формулу сложного вещества – поворот головы к левому плечу
O3, CO2, N2, NH3, S8, FeS, P4, P2O5
4.Систематизация знаний: самостоятельная работа.
Для закрепления данного алгоритма, предлагаю сформировать 3 группы сменного состава. Каждой группе выдается памятка с программой деятельности по определению видов химической связи и каждому учащемуся персональная карточка определенного цвета с разными формулами веществ. В каждой группе есть консультант (из числа мотивированных учащихся).
Каждый ученик работает индивидуально, но в случае затруднения может обратиться за помощью к консультанту своей группы или учителю.
После выполнения задания, учащиеся собираются в группу с одинаковым цветом карточки (одинаковые формулы веществ). Организуют обсуждение результатов и подводятся итоги.
Один учащийся из группы рассказывает, как определить вид связи и записать схему образования для данного вида связи. Остальные выслушивают и записывают в свою тетрадь остальные виды связи.
5.Рефлексия.
Проведение самоконтроля.
игра «Крестики- нолики» .
6. Домашнее задание.
1. П. 12, упр. 3,
2. Задание по выбору: определить вид химической связи по формуле вещества: Ca Вг2; НС l ; К; H 2 SO 3; BaO ;
SO2; LiN О 3; S2; C2H2; Na; HC О O К .
7. Подведение итогов.
Сегодня вы работали индивидуально, в группе, все вместе, помогали друг другу. Так и в жизни, для того чтобы решить сложную проблему, нужна взаимопомощь. Поэтому оценки сегодня у вас у всех хорошие.
А теперь закончим предложения и наш урок
Сегодня на уроке я узнал…
Вызвало затруднение…..
Было необычным ….
Теперь я могу …
Мне это пригодится….

Поиграйте в «крестики- нолики».
I вариант II вариант
NH 3Ca S
MgCl 2
H 2 O
KCl
O 2
Na 2 O
SO 2
BaF 2
CuS
H 2 S
Na 2 S
BaO
Na 3 N
CO 2
PH 3
3 вариант 4 вариант
CaI 2
H 2 O
O 2
Cl 2
HBr
CaCl 2
CaO
NaF
MgO
NO 2
CO 2
Na 2 O
O 2
HCl
CuCl 2
Br 2
N 2
5 вариант 6 вариант
SCl 2H 2
MgO
NaCl
HBr
SO 3
Cl 2
NH 3
Br 2
O 2
CO 2
Na 2 O
NaCl
N 2
CaO
H 2 O
7 вариант 8 вариант
NH 3Ca S
MgCl 2
H 2 O
KCl
O 2
Na 2 O
SO 2
BaF 2
CuS
H 2 S
Na 2 S
BaO
Na 3 N
CO 2
PH 3
1. Организационный момент (1 мин)
– Здравствуйте! Присаживайтесь!
2. Актуализация знаний (10 мин)
На прошлом уроке мы изучали тему «Ионная химическая связь»
Давайте вспомним этот материал:
Назовите максимальное количество электронов на внешнем энергетическом электронном уровне у неметаллов.
Какие типы химической связи вы еще помните?
Ковалентная, металлическая, водородная
Что такое ион?
Ион- электрически заряженная неэлементарная частица (атом, молекула, свободный радикал), получаемая в процессе ионизации. Имеет положительный или отрицательный заряд, кратный заряду электрона.
4. Какую связь называют ионной?
Химическую связь, возникающую между ионами, называют ионной.
5. Записать схему образования ионной связи оксида натрия

3. Изучение нового материала (25 мин)
Сегодня мы продолжаем изучение типов химической связи. Тема называется « Взаимодействие атомов элементов-неметаллов между собой».
Мы уже рассмотрели, как взаимодействуют атомы элементов-металлов с атомами элементов-неметаллов: одни отдают свои внешние электроны и превращаются при этом в положительные ионы, другие принимают электроны и превращаются при этом в отрицательные ионы. Ионы притягиваются друг к другу, образуя ионные соединения.
А как осуществляется связь между атомами элементов-неметаллов, которые имеют сходную тенденцию к присоединению электронов? Рассмотрим вначале, как осуществляется связь между атомами одного и того же химического элемента, например в веществах, имеющих двухатомные молекулы: азота - N2, водорода - Н2, хлора - СL2.
Обратите внимание, что для отражения состава этих веществ с помощью химических знаков также пользуются индексами.
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом: обобществив свои внешние электроны, то есть сделав их общими для обоих атомов.
Рассмотрим, например, образование молекулы фтора F2.
Атомы фтора - элемента главной подгруппы VII группы - имеют на внешнем электронном уровне семь электронов, и каждому атому не хватает до его завершения лишь одного электрона. Внешние электроны атома фтора образуют три электронные пары и один непарный электрон:
Если сближаются два атома и у каждого из них есть но одному внешнему неспаренному электрону, то эти электроны «объединяются» и становятся общими для обоих атомов, у которых тем самым сформируется завершенный внешний восьми электронный уровень.
Химическую связь, возникающую в результате образования общих электронных пар, называют атомной или ковалентной .
Образование молекулы фтора изображено на схеме:

Если обозначить общую электронную пару черточкой, то запись называют структурной формулой, например структурная формула фтора F-F.
Аналогично молекуле фтора образуется и двухатомния молекула водорода Н2.

следует учесть только, что завершенным для атома водорода будет двухэлектронный уровень, подобный завершенному уровню атома гелия.
Структурная формула молекулы водорода Н-Н.
Попытаемся уточнить наши представления об образовании ковалентной связи на примере возникновения молекулы водорода, используя понятие электронного облака (см. §8). При сближении двух атомов водорода, имеющих по одному электронному облаку сферической формы, происходит перекрывание электронных облаков. При этом возникает область (место), где плотность отрицательного заряда наиболее высока и поэтому обладает повышенным отрицательным зарядом. Положительно заряженные ядра притягиваются к ней (это известно из курса физики), и образуется молекула. Таким образом, химическая связь- результат действия электрических сил.

Нужно отметить, что в основе образования ковалентной связи так же, как и при возникновении ионной связи, лежит взаимодействие противоположных зарядов.
Следует подчеркнуть, что формальное понятие электронной пары при более точном рассмотрении природы ковалентной связи заменяется понятием - перекрывание электронных облаков, которое приобретает определенный физический смысл.
В заключение рассмотрим алгоритмы рассуждений, необходимых для того, чтобы записать схему образования ковалентной связи, например для молекулы азота N3.
1.Азот - это элемент главной подгруппы V группы. Его атомы имеют по пять электронов на внешнем уровне. Чтобы определить число неспяренных электронов, воспользуемся формулой:
8 - N = число неспарепных электронов.
где N - номер группы химического элемента.
Следовательно, атомы азота будут иметь (8-5 = 3) три неспаренных электронов.
2. Запишем знаки химических элементов с обозначением внешних электронов так, чтобы неспаренные электроны были обращены к соседнему знаку:
![]()

Если атомы связаны между собой одной общей электронной парой, то такую ковалентную связь называют одинарной, если двумя - двойной, если тремя - тройной.
Чем больше общих электронных пар у атомов в молекуле, тем прочнее, неразрывнее связаны они друг с другом и тем меньше расстояние между ядрами атомов, которое называется длиной связи. В молекулах фтора связь одинарная, и длина связи между ядрами атомов составляет 1,42 нанометра. В молекулах азота связь тройная, и длиннее составляет 0.11 нм.
Чтобы разделить молекулу азота на отдельные атомы, необходимо затратить примерно н семь раз больше энергии, чем для разрыва одинарных связей молекулы фтора.
4.ПОДВЕДЕНИЕ ИТОГОВ.
Расстояние между ядрами соседних атомов называется длиной связи: чем больше общих электронных пар, тем прочнее связь.
Выполняют задания у доски, объясняют механизм образования связи:
Одинарная связь: Н - Н,F - F
Двойная связь: О=О, S=S
Тройная связь: N=N, P=P
Запишем домашнее задание: параграф 10, стр. 59 – 62
Урок окончен. Всем спасибо за работу. До свидания!
Конспект уроков химии по теме "Типы химической связи"
Дата публикации: 27.12.2015
Краткое описание:
предварительный просмотр материала
Конспекты уроков по теме: «Типы химической связи».
11 класс, МБОУ ССШ № 7 городского округа - город Камышин Волгоградской области.
Учитель химии Золотарева Татьяна Генриховна.
Пояснительная записка.
Данный блок уроков рассчитан на учащихся 11-ых классов, обучающихся по программе О.С. Габриеляна, профильного уровня. При разработке данного блока уроков использовалась педагогическая технология «Прогрессирующая кооперация». Суть этой технологии в том, что от урока к уроку учащиеся накапливают знания по заданной теме. Процесс завершается контрольным тестированием. Учитель использует различные интерактивные формы и методики развивающего характера для успешного усвоения знаний учащимися. Выполнение домашних заданий требует от учащихся самостоятельности, творчества, использования различных источников информации, консультации друг с другом и учителем. Совместная деятельность учителя и учащихся в конечном итоге направлена на успешную сдачу ЕГЭ.
Цель: углубить, закрепить, обобщить и проконтролировать уровень знании учащихся о типах химической связи, структуре кристаллической решетки и характерных свойствах веществ.
Мотивация: успешная сдача ЕГЭ по химии.
Опираясь на знания ковалентной, ионной и металлической связи сделать вывод о единой природе химической связи;
В ходе тестирования закрепить умения определять тип химической связи и вид кристаллической решетки для конкретных химических веществ;
Способствовать формированию представления учащихся о том, что деление на типы связей носит условный характер.
Оборудование: мультимедийная система, компьютер.
Блок уроков по теме «Типы химических связей»:
Урок углубления и закрепления знаний учащихся по типам химических связей и видам кристаллических решеток. Ребята должны проследить взаимосвязь между строением и свойствами веществ. Проводится с использованием технологии проблемного обучения.
Урок закрепления и обобщения знаний учащихся по заданной теме с использованием групповой технологии (интерактивные группы учащихся) и мультимедийных презентаций по темам «Ионная связь», «Металлическая связь», «Ковалентная связь», «Водородная связь»(индивидуальная работа учащихся).
Контрольное тестирование по заданной теме. Тесты составлены с использованием сборников тестов ФИПИ «ЕГЭ химия 2015».
Конспект урока № 1 «Типы химической связи».
Цель урока : повторить, закрепить и углубить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Задачи урока :
1. Повторить, углубить и закрепить важнейшие сведения о химической связи и строении вещества
Оборудование
Ход урока:
Здравствуйте ребята! Мне хотелось бы начать урок со слов Нансена, известного педагога-психолога «Жизненные позиции заразительны … А ваша может кого то увлечь?». Свою жизненную позицию я вижу в том, чтобы помочь вам овладеть компетенциями, которые в дальнейшем помогут вам успешно сдать ЕГЭ по химии, что позволит вам поступить в выбранные вами учебные заведения.
Тема нашего урока «Типы химических связей», цель урока - повторить, закрепить и углубить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Задачи урока смотри выше.
Объяснение нового материала :
1. Актуализация опорных понятий и навыков.
Учитель. Учение о химической связи составляет основу всей теоретической химии.
Что мы понимаем под химической связью?
Возможный вариант ответа: под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Образование между частицами химических связей приводит к уменьшению общего запаса энергии системы по сравнению с суммой энергий несвязанных атомов.
Какие частицы могут принимать участие в образовании химической связи?
Возможный вариант ответа: В образовании химических связей могут принимать участие
Неспаренные валентные электроны
Пара валентных электронов, находящихся на одной орбитали
Вакантная орбиталь.
Различают четыре типа химической связи. Какие?
Возможный вариант ответа: ионная, ковалентная, металлическая и водородная.
Давайте выполним следующее задание: разделите вещества по типу химической связи на три группы. Формулы и названия веществ записаны на доске. Это медь, кислород, углекислый газ, угарный газ, гидроксид натрия, хлорид калия, карбонат кальция, железо, водород, азот, вода, аммиак, гидроксид бария, хлорид магния, карбид кальция, хлорид аммония. При выполнении задания, вы можете использовать схему № 1
Ребята, посмотрите внимательно на вещества и скажите, в каких из них может быть несколько типов химической связи.
Возможный вариант ответа: гидроксид натрия, карбонат кальция, гидроксид бария, карбид кальция.
Какие в этих веществах типы химической связи?
Анализируем по схеме «Типы химических связей» и делаем выводы.
2. Углубленное изучение материала, через постановку проблемы.
Постановка проблемы: ребята, что вы можете сказать о веществе, которое состоит из химических элементов, номера которых в периодической системе 1 и 34.
Возможный вариант ответа: это водородное соединение селена, формула H2Se.
А можем ли мы сказать, какое строение имеет это вещество, и какими свойствами оно обладает?
Чтобы ответить на этот вопрос я предлагаю вам составить таблицу «Типы химической связи».
ческая связь
Соединяющиеся частицы
Механизм возникнове
Силы, удерживающие частицы
Примеры веществ
Характерные свойства
Начинаем работать.
Химическая связь, образовавшаяся за счет электростатического притяжения катионов к анионам между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью называется ионной. Приводим примеры веществ с ионной связью и отмечаем характерные свойства веществ ионного строения - твердость, тугоплавкость, способность проводить электрических ток в расплавленном виде и в виде водного раствора(при условии, что вещество растворимо в воде).
Ребята составьте схему образования связи в хлориде натрия и уравнение диссоциации этого вещества.
Ученик работает у доски.
Связь в металлах и сплавах между атом-ионами металлов, расположенных в узлах кристаллической решетки, которая осуществляется обобществлением валентных электронов называется металлической. Приводим примеры веществ с металлической связью и характерные свойства: металлический блеск, электропроводность, теплопроводность, ковкость, пластичность.
Ребята составьте схему образования химической связи для алюминия.
Ученик работает у доски.
Связь, возникающая между атомами за счет образования общих пар электронов называется ковалентной. С какими видами ковалентной связи вы знакомы?
Возможный вариант ответа: ковалентная полярная и ковалентная неполярная связь.
Какую связь мы называем ковалентной неполярной?
Возможный вариант ответа: ковалентная химическая связь между атомами с одинаковой электроотрицательностью, называют неполярной.
Какую связь мы называем ковалентной полярной?
Возможный вариант ответа: ковалентная химическая связь между атомами, разность электроотрицательностей которых меньше 1,7 называется полярной.
Ребята, какое свойство атома мы называем электроотрицательностью?
Возможный вариант ответа: свойство атома оттягивать к себе валентные электроны от других атомов называется электроотрицательностью.
Какие кристаллические решетки образуют вещества с ковалентной связью в твердом состоянии?
Возможный вариант ответа: молекулярные и атомные.
Приводим примеры веществ с ковалентной полярной и ковалентной неполярной химической связью, молекулярного и атомного строения и характерные свойства веществ: молекулярного строения - газообразные вещества, легкокипящие жидкости, твердые легкоплавкие вещества, неэлектролиты(исключения сильные кислоты и растворимые в воде соли), атомного строения - прочная кристаллическая решетка, твердые, плохо растворимы в воде вещества, неэлектролиты.
Ребята составьте схемы образования связи в молекулах водорода, кислорода, азота.
У доски работают 3 ученика.
Какие типы ковалентной связи по способу перекрывания орбиталей вам известны?
(работаем по схеме «Виды и формы электронных орбиталей)
Возможный вариант ответа: по способу перекрывания электронных орбиталей различают сигма и пи ковалентные связи. В первом случае орбитали перекрываются по линии соединяющей ядра атомов, во втором случае - боковое перекрывание орбиталей.
Ребята у доски закончили работу.
Какие типы ковалентной связи по числу общих электронных пар, связывающих атомы, то есть по кратности, вы знаете? (работа с учебником стр.50). Анализируем работу учащихся у доски.
Возможные варианты ответов:
Одинарные, пример на доске водород. Пример органических веществ - предельные углеводороды.
Двойные, пример на доске кислород. Пример органических веществ - алкены.
Тройные, пример на доске азот. Пример органических веществ - алкины.
Ребята необходимо отметить, что механизмы образования ковалентной связи различны (работа с учебником стр.47-48):
1. Обменный механизм - атомы образуют общие электронные пары за счет объединения неспаренных электронов.
2. Донорно-акцепторный - один из атомов донор предоставляет пару электронов для образования связи, другой атом акцептор - свободную орбиталь.
Приведем примеры.
Возможный вариант ответа: связи в молекуле хлороводорода, хлора. Связь в ионе аммония.
Какими свойствами обладает ковалентная связь?
Возможный вариант ответа: насыщаемость, поляризуемость, направленность.
На что влияет направленность ковалентной связи?
Возможный вариант ответа: на геометрию молекулы, то есть на форму молекул, их размеры, межатомные расстояния, валентный угол.
С какими типами гибридизации мы познакомились при изучении органических веществ? (работаем с использованием схемы «Гибридные орбитали»)
Возможный вариант ответа: sp3, sp2, и sp гибридизация.
Какие углы связи характерны для данных видов гибридизации?
Возможный вариант ответа: 109 градусов 28 минут, 120 градусов, 180 градусов соответственно.
Какую форму имеют молекулы с соответствующим типом гибридизации орбиталей?
Возможный вариант ответа: тетраэдрическую, плоскую треугольную, линейную соответственно.
Приводим примеры. В случае затруднений обратиться к учебнику стр.61-63.
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары другой молекулы (или ее части), называют водородной)
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
Приведите примеры веществ с данным типом связи.
Возможный вариант ответа: вода, спирты, аммиак, фтороводород - межмолекулярная водородная связь; белки и нуклеиновые кислоты - внутримолекулярная водородная связь.
Какие свойства характерны для этих веществ?
Возможный вариант ответа: более высокие температуры кипения, в сравнении со сходными веществами, между молекулами которых отсутствуют водородные связи. Например - вода и углекислый газ.
Решение проблемы . Ребята, мы закончили заполнять таблицу «Типы химической связи» (смотри приложения). Вернемся к началу урока. Что вы можете сказать о свойствах селеноводорода?
Возможный вариант ответа: Селеноводород - вещество с ковалентным полярным типом химической связи, молекулярного строения, слабый электролит, при нормальных условиях является газом, с неприятным запахом, водный раствор является кислотой. Записываем уравнение диссоциации селеноводорода. Ученик работает у доски.
Итоги урока.
Ребята, какие выводы мы можем сделать?
Возможный вариант ответа: чтобы определиться со свойствами вещества, необходимо знать тип химической связи и особенности его строения и наоборот.
Обратите внимание на четвертый столбец нашей таблицы. Что вы можете сказать о природе химической связи.
Возможный вариант ответа: физическая природа химической связи едина.
Выставление отметок за урок .
Конспект урока № 2 «Типы химической связи».
Цель урока : закрепить, углубить и обобщить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Задачи урока :
1. Углубить, закрепить и обобщить важнейшие сведения о химической связи и строении вещества
Уметь определять вид химической связи в простых и сложных веществах, составлять схемы образования веществ с различными видами связи
Уметь составлять причинно-следственную связь при рассмотрении вопроса: тип связи - тип кристаллической решетки - свойства вещества.
Оборудование: компьютер, мультимедийная система.
Ход урока:
Организационно-мотивационный блок.
Здравствуйте ребята, я рада нашей новой встрече. Сегодня мы продолжим изучать тему «Типы химической связи», которую мы начали изучать на прошлом уроке. «О сколько нам открытий чудных готовит просвещенья дух, и опыт сын ошибок трудных и гений - парадоксов друг…» - писал А.С. Пушкин. Не перестаю удивляться актуальности этих строк в наше время и гениальности великого русского поэта. Казалось бы, мы с вами уже все знаем о типах химической связи, а заглянешь в книгу, прочтешь и вдруг осознаешь, что есть что-то новое. То на, что ранее не обратил своего внимания. Человек учится всю жизнь. Давайте же и мы начнем…
Какова же цель нашего урока?
Цель урока - закрепить, углубить и обобщить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Какие задачи вы ребята определяете для себя? (смотри выше)
Деление на группы . Ребята, я предлагаю вам разделиться на группы. Те, кто лучше разбирается в ионной связи - группа № 1, кому по душе металлическая связь - группа № 2, знатоки ковалентной связи - группа № 3, поклонники водородной связи - группа № 4.
Углубление, закрепление и обобщение знаний, умений и навыков :
Правила работы в группах : сначала вы прослушаете презентацию «Ионная химическая связь», которую подготовил … . Затем представители других групп задают вопросы ребятам из первой группы, а они отвечают на поставленные вопросы. Если группа не сможет дать ответ на вопрос, то помочь им могут ребята из других групп или учитель. Если важные вопросы не будут освещены, учитель вправе сам задать вопрос. Далее - презентация «Металлическая химическая связь», ее подготовил … . И обсуждение в группах. Далее презентация «Ковалентная химическая связь» , представит ее … . Обсуждение в группах. По окончании презентация «Водородная химическая связь», которую подготовил … . И обсуждение ее в группах. Старшие групп - ребята, подготовившие презентации оценят вклад каждого участника группы. По итогам работы каждый получит отметку. Если нет вопросов, то начинаем работу.
Работа в группах по углублению, закреплению, обобщению и систематизации знаний.
Презентация «Ионная химическая связь». (Прилагается)
Вопросы для обсуждения:
Какую связь называют ионной?
Как атомы превращаются в ионы?
Что представляет собой процесс восстановления?
Что представляет собой процесс окисления?
Какие вы знаете ионы?
Между какими атомами возникает ионная химическая связь?
Каков механизм ионной связи?
Какие силы возникают между катионами и анионами?
В каких веществах ионный тип химической связи?
Какой тип кристаллической решетки характерен для этих веществ?
Какими свойствами обладают вещества с ионным типом химической связи?
Обладает ли ионная связь направленностью?
Презентация «Металлическая химическая связь». (Прилагается)
Вопросы для обсуждения
Какую связь мы называем металлической?
Является ли металличекая связь направленной и насыщенной?
Каков механизм образования металлической связи?
Какие силы действуют между электронами и катионами металлов?
Какими свойствами обладают вещества с металлическим типом связи?
Какие кристаллические решетки образуют металлы?
Какой тип химической связи у металлов в парообразном состоянии?
Что такое полиморфизм металлов?
Какие вещества называют интерметаллидами?
Презентация «Ковалентная химическая связь». (Прилагается)
Вопросы для обсуждения:
Какую связь мы называем ковалентной?
Каковы механизмы образования ковалентной связи?
Какие виды ковалентной связи по способу перекрывания электронных орбиталей вы знаете?
Какие виды ковалентной связи по числу общих электронных пар вам известны?
Какие виды ковалентной связи по степени смещенности общих электронных пар вам известны?
Какое свойство атома мы называем электроотрицательностью?
Объясните, почему молекула углекислого газа не является полярной, а молекула воды - полярна?
Что мы понимаем под насыщаемостью ковалентной связи?
Что такое поляризуемость и направленность ковалентной связи?
Что такое гибридизация атомных орбиталей?
С какими видами гибридизации вы знакомы?
Каковы углы связи в разных типах гибридизации атомных орбиталей?
Какие формы имеют молекулы веществ с разными типами гибридизации?
Что такое длина связи, и в каких единицах она изменяется?
Какие силы удерживают электроны и ядра атомов?
Какие вы знаете вещества с ковалентным типом связи?
Какие типы кристаллов образуют эти вещества в твердом состоянии?
Какие свойства характерны для этих веществ?
Презентация «Водородная химическая связь. Межмолекулярные взаимодействия». (Прилагается)
Вопросы для обсуждения:
Какую связь мы называем водородной?
Каков механизм водородной связи?
Между молекулами, каких веществ возникает водородная химическая связь? Как ее называют?
В молекулах, каких веществ встречается водородная химическая связь? Как ее называют?
Как влияет водородная связь на температуру кипения вещества?
Как называют силы межмолекулярного взаимодействия?
Какие виды межмолекулярных взаимодействий вам знакомы?
Что мы понимаем под ориентационным, индукционным и дисперсионным взаимодействием?
Какова природа химической связи?
При каких условиях возможен переход из одного вида связи в другой? Приведите примеры.
По окончании работы учеников у доски подводятся итоги урока.
Итоги урока .
Ребята, сегодня на уроке вы узнали много о химической связи, мы углубили и обобщили знания о типах химической связи, узнали о механизмах образования связи, привели примеры веществ с различными типами связи и отметили характерные свойства этих веществ. Наконец сделали вывод о единой природе химической связи. Скажите, что же нового вы узнали на уроке, того, на что не обратили внимание ранее? Ответы учеников.
Выставление отметок.
Работа ребят оценивается не только учителем, но и лидерами и участниками групп. Каждый ученик получает отметку за свою работу на уроке.
Домашнее задание :
Подготовиться к контрольному тестированию по теме «Типы химической связи»: параграф 6 и 7, письменно выполнить задания 4 и 5 после параграфа 6, записи в тетради.
Конспект урока № 3 «Типы химической связи».
Цель урока : контроль знаний, умений и навыков по заданной теме.
Задачи урока :
1. Повторить, закрепить и проконтролировать знания о типах химической связи и строении вещества
2. Уметь определять вид химической связи в простых и сложных веществах, составлять схемы образования веществ с различными видами связи
Сформировать умения работы с тестами.
Оборудование : компьютер, мультимедийная система.
Ход урока :
Организационно-мотивационный блок.
Здравствуйте ребята, я рада снова видеть вас на уроке химии. Есть хорошее выражение - «всему свое время», «есть время разбрасывать камни, а есть время собирать их». Выражаясь этим языком, пришло время собирать камни. На прошлом уроке мы изучили тему «Типы химической связи» и сегодня мы узнаем, насколько хорошо разобрались с пройденным материалом. Я предлагаю вам тесты, которые составлены с помощью сборников тестов ФИПИ «ЕГЭ химия 2010». Выполнение этих заданий поможет вам успешно сдать экзамен по химии по окончании 11 класса.
Повторение, закрепление и контроль знаний, умений и навыков
Фронтальная беседа по вопросам предыдущего урока
Проверка домашнего задания
Тестирование по теме «Типы химической связи»
Два варианта тестов прилагаются.
Итоги урока
Ребята, давайте вспомним, какие задачи мы ставили перед собой, когда начинали изучать данную тему. Скажите, мы выполнили поставленные задачи.
Ответы учеников.
Домашнее задание :
Письменно ответить на вопросы после параграфа 7.
Вариант 1.
Какой тип химической связи в сероуглероде
металлическая
ковалентная полярная
ковалентная неполярная
Атом является структурной частицей в кристаллической решетке
водорода
кислорода
Вещества с ионной связью приведены в ряду
1. хлор, аммиак, хлороводород
2. бромоводород, бром, вода
3. сероводород, вода, сера
4. йодоводород, вода, аммиак
4.Кристаллическая решетка железа
2. молекулярная
3. атомная
4. металлическая
5. Какой тип химической связи в хлориде бария
2. ковалентная
3. водородная
4. металлическая
2. оксид натрия
3. углекислый газ
4. белый фосфор
1. вода и сероводород
2. бромид калия и азот
3. аммиак и водород
4. кислород и хлор
8. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1. молекулярную
2. атомную
4. металлическую
2. этилового спирта
3. этилена
4. ацетилена
10. Какой тип химической связи в бромиде лития
1. ковалентная полярная
2. ковалентная неполярная
11. В каком ряду все вещества имеют ковалентную полярную связь
1. хлороводород, хлорид натрия, хлор 3. Хлорид бария, водород, азот
2. кислород, вода, углекислый газ 4. вода, аммиак, метан
12. Ковалентная неполярная связь реализуется в соединении
1. оксид кальция
2. углекислый газ
3. сернистый газ
13. В молекуле хлора химическая связь:
1. ковалентная полярная
2. ковалентная неполярная
4. водородная.
14. Химическая связь в молекуле фтороводорода:
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
15. В йодиде калия химическая связь:
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
16. В сероуглероде химическая связь:
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
17.Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
18. Ковалентная полярная связь характерна для
1. хлорида калия
2. бромоводорода
3. белого фосфора
4. хлорида кальция
19 Ковалентная неполярная связь характерна для
А) цинк 1) ионная
Б) азот 2) металлическая
В) аммиак 3) ковалентная неполярная
Г) хлорид кальция 4) ковалентная полярная
Тестирование по теме «Типы химической связи».
Вариант 2.
Какой тип химической связи в аммиаке
2. металлическая
3. ковалентная полярная
4. ковалентная неполярная
2. Атом является структурной частицей в кристаллической решетке
2. водорода
3. кислорода
4. кремнезема
3. Вещества с ионной связью приведены в ряду
1. хлор, аммиак, хлороводород
2. бромоводород, бром, вода
3. хлорид натрия, оксид бария, гидроксид калия
4. йодоводород, вода, аммиак
4. Кристаллическая решетка серебра
2. молекулярная
3. атомная
4. металлическая
5. Какой тип химической связи в хлориде натрия
2. ковалентная
3. водородная
4. металлическая
6. Кристаллическую структуру, подобную структуре алмаза имеет
2. оксид натрия
3. углекислый газ
4. белый фосфор
7. Соединениями с ковалентной неполярной связью являются
1. вода и сероуглерод
2. бромид калия и азот
3. аммиак и водород
4. кислород и хлор
8. Вещества, обладающие хрупкостью и легкоплавкостью, как правило, имеют кристаллическую решетку
1. молекулярную
2. атомную
4. металлическую
9. Водородная связь образуется между молекулами
2. уксусной кислоты
3. этилена
4. ацетилена
10.Наиболее прочная химическая связь в молекуле
11. Ионный характер связи наиболее выражен в соединении:
1. хлорид углерода
2. оксид кремния
3. бромид кальция
12. В аммиаке тип химической связи
1. ковалентная полярная 3. ионная
2. ковалентная неполярная 4. металлическая
13. Соединение с ковалентной неполярной связью:
1. хлороводород 3. хлорид кальция
2. кислород 4. вода
14. Водородная связь образуется между молекулами
2. этилового спирта
3. диэтилового эфира
4. метилацетата
15. Путем соединения атомов одного и того же химического элемента образуется связь:
1. ковалентная полярная
2. ковалентная неполярная
4. водородная
16. В аммиаке и хлориде бария химическая связь соответственно
1. ковалентная полярная и ионная
2. ковалентная неполярная и ионная
3. ионная и металлическая
4. металлическая и ковалентная полярная
17. Соединениями с ковалентной полярной и неполярной связью являются соответственно
1. вода и сероводород
2. бромид калия и азот
3. аммиак и водород
4. кислород и метан
18. Атомы химических элементов второго периода Периодической системы образуют соединение с ионной химической связью
1. сульфид бария
2.углекислый газ
3. оксид алюминия
4. фторид лития
19. В каком ряду записаны формулы веществ только с ковалентной полярной связью
1. хлор, аммиак, хлороводород
2. бромоводород, бром, вода
3. сероводород, вода, сера
4. йодоводород, вода, аммиак
20. Установите соответствие между веществом и типом связи атомов в этом веществе:
А) водород 1) ионная
Б) барий 2) металлическая
В) фтороводород 3) ковалентная неполярная
Г) фторид бария 4) ковалентная полярная
Если материал вам не подходит, воспользуйтесь поиском













