Качественное и количественное определение. §2. Химическая формула. Качественный анализ антрогликозидов
Й. Я. Берцелиус предложил обозначать химические элементы первой буквой их латинских названий. Так, символом кислорода стала первая буква его латинского названия: кислород - О (читается «о», так как латинское название этого элемента oxygenium). Соответственно, водород получил символ - Н (читается «аш», так как латинское название этого элемента hydrogenium), углерод - С (читается «цэ», так как латинское название этого элемента carboneum). Но латинские названия хрома (chromium), хлора (chlorum) и меди (cuprum), так же как и углерода, начинаются на букву «С». Как же быть? Й. Я. Берцелиус предложил гениальное решение: такие символы записывать не одной, а двумя буквами - первой и одной из последующих букв, чаще всего второй. Так, хром обозначается Сr (читается «хром»), хлор - С1 (читается «хлор»), медь - Сu (читается «купрум»).
Другой реакцией идентификации галогена является реакция с нитратом серебра. Для указания наличия галогена образуется белый или желтый галогенид галогенида серебра. Для идентификации каждого атома галогена полученный осадок обрабатывают раствором гидроксида аммония и производят следующие наблюдения.
Если осадок белый и слегка растворенный в гидроксиде аммония, вещество содержит хлор. Если осадок является бело-желтым и более растворяется в гидроксиде аммония, он содержит бром. Если осадок желтый и нерастворимый в гидроксиде аммония, он содержит йод.
Русские и латинские названия, знаки наиболее употребляемых в школе двадцати химических элементов и их произношение приведены в таблице 2.
Таблица 2
Названия и символы некоторых химических элементов
В нашей таблице уместилось всего 20 элементов. Чтобы увидеть все 110 известных на сегодняшний день элементов, нужно обратиться к таблице химических элементов Д. И. Менделеева.
Идентификация галогенов в составе органических веществ растений. Необходимые вещества: концентрированный ацидоазат; нитрат серебра, 2% раствор; сушеные листья сельдерея или папоротника. Опыт: Распространение сушеных листьев сельдерея или папоротника в тигле. С полученной золой выполняют водную экстракцию, отделяемую на фильтровальной бумаге. При необходимости повторите операцию фильтра на том же фильтре до получения прозрачной жидкости. Из отфильтрованной жидкости возьмите чистую пробирку объемом 1-2 мл и подкисьте несколькими каплями концентрированной азотной кислоты.
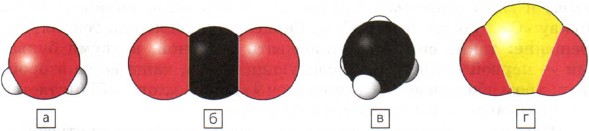
Чаще всего в состав веществ входят атомы нескольких химических элементов. Изобразить мельчайшую частицу вещества, например молекулу, можно с помощью моделей-шариков так, как вы это делали на предыдущем уроке. На рисунке 40 изображены объемные модели молекул воды (а), углекислого газа (б), метана (в) и сернистого газа (г).
К смеси добавляют 3-4 капли 2% раствора нитрата серебра. Появление белого осадка хлорида серебра указывает на присутствие хлора в соответствии с реакцией. Органический химический анализ дает нам методы определения степени загрязнения и, следовательно, принятия защитных мер. Некоторые трудно поддающиеся биодеградации пестициды могут накапливаться в почве, откуда они могут проникать в растения, например, в картофель или морковь.
В кастрюле анализируемые вещества извлекаются из картофеля или моркови при обработке нормальным гексаном. Отделите раствор декантированием, добавьте несколько капель гидроксида калия, нормальный спиртовой раствор. Испариться на водяной бане до сухости. После гидролиза высушенный остаток повторно растворяют в нескольких каплях четыреххлористого углерода. Перемешать и встряхнуть с помощью 2 мл смеси азотной кислоты и серной кислоты.
Рис. 40.
Объемные модели молекул:
а - воды; б - углекислого газа; в - метана; г - сернистого газа
С помощью символов химических элементов и индексов записываются химические формулы веществ. Индекс показывает, сколько атомов данного элемента входит в состав молекулы вещества. Он записывается справа внизу от знака химического элемента. Например, формулы веществ, изображенных на рисунке 40, записывают так: а - Н 2 O; б - СO 2 ; в - СН 4 ; г - SO 2 .
Элементарный количественный анализ
В качестве подсказки появляется зеленый цвет. Элементарный количественный анализ определяет процентное содержание различных компонентов органического вещества. Элементы, полученные путем дезагрегации вещества, могут быть объемными или гравиметрическими, дозирование которых является предметом элементарных методов количественного анализа.
Определение галогенов требует разложения органического вещества с целью подачи ионного галогена, а затем его дозирования гравиметрическим или объемным нитратом серебра. В этом отношении существует несколько методов определения. В случае летучих органических соединений определение галогенов осуществляется методом Кариуса. Простейшим и простым методом для определения галогенов является метод Степанова. Прямая идентификация галогенов из органических веществ методом Степанова заключается в следующем.
Химическая формула - основная знаковая модель в нашей науке. Она несет очень важную информацию. Химическая формула показывает:
качественный состав вещества, т. е. атомы каких элементов входят в состав данного вещества;
количественный состав , т. е. сколько атомов каждого элемента входит в состав молекулы вещества.
По формуле вещества можно определить также, является оно простым или сложным.
Например, водород Н 2 , железо Fe, кислород O 2 - простые вещества, а вода Н 2 O, углекислый газ СO 2 и серная кислота H 2 SO 4 - сложные.
Вопросы и задания
- Знаки каких химических элементов содержат заглавную букву С? Запишите их и произнесите.
- Из таблицы 2 выпишите отдельно знаки элементов-металлов и знаки элементов-неметаллов. Произнесите их названия.
- Что такое химическая формула? Напишите формулы следующих веществ:
- а) серной кислоты, если известно, что в состав ее молекулы входят два атома водорода, один атом серы и четыре атома кислорода;
- б) сероводорода, молекула которого состоит из двух атомов водорода и одного атома серы;
- в) сернистого газа, молекула которого содержит один атом серы и два атома кислорода.
Что объединяет все эти вещества?
- Изготовьте из пластилина объемные модели молекул следующих веществ:
- а) аммиака, молекула которого содержит один атом азота и три атома водорода, расположив атомы водорода по отношению к атому азота под углом 110°;
- б) хлороводорода, молекула которого состоит из одного атома водорода и одного атома хлора;
- в) хлора, молекула которого состоит из двух атомов хлора.
Напишите формулы этих веществ и прочитайте их.
- На рисунке 40 изображены модели молекул четырех химических веществ. Сколько химических элементов образуют эти вещества? Назовите их, запишите символы этих элементов и произнесите их.
- Возьмите пластилин четырех цветов. Скатайте самые маленькие шарики белого цвета - это модели атомов водорода, красные шарики побольше - модели атомов кислорода, черные шарики - модели атомов углерода и, наконец, самые большие шарики желтого цвета - в качестве моделей атомов серы. Изготовьте объемные модели молекул, изображенных на рисунке 40.
РОСЖЕЛДОР Государственное образовательное учреждение
высшего профессионального образования «Ростовский государственный университет путей сообщения»
ОБЩАЯ ХИМИЯ
Учебное пособие для самостоятельной
работы студентов
Утверждено методическим советом университета
Ростов-на-Дону
УДК 541(07) + 06
Общая химия: учебное пособие для самостоятельной работы студентов / Ю.Ф. Мигаль, С.Б. Булгаревич, В.Н. Доронькин [и др.] ; Рост. гос. ун-т путей сообщения. – Ростов н/Д, 2010. – 191 с. Библиогр. : 11 назв.
Содержатся сведения по основным разделам курса общей химии: классы неорганических соединений, химическая термодинамика, скорость химических реакций, химическое равновесие, строение вещества, растворы, окислительно-восстановительные реакции, электрохимия, полимеры. Приводятся примеры решения типичных задач, задачи прикладного характера по железнодорожной тематике, схемы, показывающие логическую связь химических понятий, и рекомендуемая литература.
Учебное пособие одобрено к изданию кафедрой химии РГУПС и предназначено студентам 1-го курса всех специальностей.
Рецензенты: д-р хим. наук, проф. А.Г. Бережная (ЮФУ); канд. техн. наук, доц. Г.Н. Соколова (РГУПС)
© Ростовский государственный университет путей сообщения, 2010
ВВЕДЕНИЕ: ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Теоретическую основу современной химии составляет атомномолекулярное учение.
Атом – это наименьшая, химически неделимая частица химического элемента. Нейтральный атом состоит из положительно заряженного ядра и соответствующего этому заряду числа электронов. В нейтральном атоме число протонов в ядре равно числу электронов, движущихся вокруг ядра.
Химический элемент – вид атомов с одинаковым зарядом ядра.
Атомы химических элементов могут соединяться друг с другом, образуя простые , состоящие из одинаковых атомов (О 2 , Н 2 , Р 4 , C и другие), илисложные , состоящие из атомов различных химических элементов,вещества (H2 SO4 , C12 H22 O11 , NaOH) . Сложные вещества называютхимическими соединениями . Для многих химических соединений справедлив
закон постоянства состава вещества (Ж.Л. Пруст, 1808 г.) – любое ве-
щество молекулярного строения имеет постоянный качественный и количественный состав независимо от способа его получения.
Молекула – наименьшая частица вещества, сохраняющая его состав и основные химические свойства.
Ионы – электрически заряженные частицы, образующиеся из атомов (или групп атомов) в результате присоединения или потери определенного числа электронов.Катионы – положительно заряженные ионы,анионы – отрицательно заряженные ионы.
Уравнение процесса |
||
Na+ – катион | Na0 – 1ē = Na+ |
|
S2– – анион | S0 + 2ē = S2– |
|
Химическая формула – символическая запись состава и простейшего численного соотношения атомов различных элементов, которые образуют химическое соединение. Качественный состав вещества обозначается символами химических элементов, количественный состав – нижними индексами у символов химических элементов, которые показывают число атомов данного элемента в соединении; если в соединение входит один атом элемента, то индекс «единица» не записывают. Например, в состав
молекулы серной кислоты H2 SO4 входят 2 атома водорода (H2 индекс 2 ), 1 атом серы (S1 не пишется ) и 4 атома кислорода (O4 ).
Химические явления, или химические реакции, – это явления, при
которых одни вещества переходят в другие, отличающиеся от исходных веществ своими свойствами; элементный состав вещества при этом не изменяется.
Закон сохранения массы (М.В. Ломоносов, 1748 г.) – масса ве-
ществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Абсолютная масса атома или молекулы выражается в граммах,
килограммах или атомных единицах массы. Например,
m (H) = 1,674 10–24 г = 1,674 10–27 кг = 1 а.е.м.
Атомная единица массы (1 а.е.м.) равна 1/12 части массы атома изотопа углерода 12 C.
1 а.е.м. = 1/12 m (12 С) ≈ 1,66 10–24 г ≈ 1,66·10–27 кг.
Относительная атомная масса элемента (A r )равна отношению средней массы, приходящейся на атом в природной смеси изотопов, к 1/12 части массы изотопа углерода 12 С. Относительная атомная масса – безраз-
мерная величина, A r (Cl) = 35,453;A r (O) = 15,9994;A r (S) = 32,0660.
Относительная молекулярная масса (M r )равна отношению сред-
ней массы, соответствующей химической формуле вещества, найденной с учетом состава природной смеси изотопов химических элементов, к 1/12 массы атома изотопа 12 C, то есть к 1 а.е.м. Следовательно, относительная молекулярная масса равна сумме относительных атомных масс всех элементов, входящих в состав химического соединения. Для химических расчетов значенияA r иM r часто округляют до целых чисел, за исключением некоторых случаев, например хлора (35,5). Например,M r (H2 SO4 ) = 1∙2 + 32∙1 + 16∙4 = 98.
Моль – количество вещества (n ,), содержащее столько же частиц вещества (атомов, молекул, ионов, электронов …), сколько содержится атомов в 0,012 кг изотопа углерода12 С.
Постоянная Авогадро (NA ≈ 6,02 1023 моль-1 ) – число структурных единиц в одном моле любого вещества.
Молярная масса – масса одного моля вещества. Единица измерения
– г/моль; кг/кмоль; мг/ммоль.
Количество вещества n («число молей») можно определить по массе или по количеству структурных единиц:
где m – масса вещества,M – молярная масса вещества,N – число структурных единиц,N A – число Авогадро.
Закон Авогадро – в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Первое следствие из закона Авогадро – один моль любого газа при одинаковых условиях занимает одинаковый объем.
При нормальных условиях (н.у.): T = 273,15 K (t = 0 ˚C) иP = 101 325 Па (1 атм = 760 мм ртутного столба) 1 моль идеального газа занимает объем 22,4 л. Мольные объемы реальных газов при нормальных условиях очень близки к этой величине.
Количество газообразного вещества n газ находится по формуле
n газV V газ ,
где V газ – объем газа;V M – мольный объем газа (V M = 22,4 л/моль при н.у.).
Уравнение Клапейрона – Менделеева:
PV M m RT,
где P – давление газа,V – объем газа,m – масса газа,M – молярная масса газа,R – универсальная газовая постоянная,R = 8,314 Дж/(моль К).
Валентность – способность атома химического элемента образовывать определенное количество химических связей с атомами других химических элементов.
Электролиты – вещества, водные растворы или расплавы которых проводят электрический ток; к электролитам относятся кислоты, основания, соли.
Неэлектролиты – вещества, растворы или расплавы которых не проводят электрический ток.
Электролитическая диссоциация – распад электролита на ионы при растворении или плавлении. Диссоциация – обратимый процесс; обратный процесс называется ассоциацией.
Кислота – электролит, при диссоциации которого образуются только катионы водорода H+ и анионы кислотного остатка.
НСl H+ + Cl–
Многоосновные кислоты – кислоты, в состав которых входят несколько атомов водорода; многоосновные кислоты диссоциируют ступенчато:
H2 SO4 | H+ + HSO4 – | (1-я ступень); |
HSO4 – H+ + SO4 2– | (2-я ступень); |
|
H2 SO4 | 2H+ + SO4 2– | |
Диссоциация многоосновных кислот преимущественно протекает по первой ступени.
Основание – электролит, при диссоциации которого образуются только гидроксид-анионы OH– и катионы металла или аммония.
NaOH Na+ + OH–
Многокислотные основания – основания, в состав которых входит несколько гидроксид-анионов OH– , они диссоциируют ступенчато:
Al(OH)3 | Al(OH)2 + + OH– | (1-я ступень); |
Al(OH)2 + AlOH2+ + OH– | (2-я ступень); |
|
AlOH2+ Al3+ + OH– | (3-я ступень); |
|
Al(OH)3 | Al3+ + 3OH– | (суммарное уравнение диссоциации). |
Диссоциация многокислотных оснований преимущественно протекает по первой ступени.
Средняя соль – электролит, при диссоциации которого образуется катион металла или аммония и анион кислотного остатка:
NH4 Cl NH4 + + Cl–
K2 SO4 2K+ + SO4 2– .
Кислая соль – электролит, при диссоциации которого образуются катион металла и анион кислотного остатка, содержащий атом водорода. Анион кислотного остатка участвует в процессе вторичной диссоциации:
NaHSO3 Na+ + HSO3 – HSO3 – H+ + SO3 2–
Оснόвная соль – электролит, при диссоциации образуются катион, состоящий из металла и гидроксогрупп, и анион кислотного остатка. Гидроксокатион металла также способен к диссоциации:
СaОHСl CaOH+ + Cl– CaOH+ Ca2+ + OH–
Оксиды – сложные вещества, состоящие из двух элементов, один из которых атом кислорода в степени окисления –2. Оксиды относятся к неэлектролитам и в растворах не диссоциируют.
Ионные уравнения
В растворах многие реакции протекают между ионами; реакции могут быть обратимыми и необратимыми.
Обратимая реакция
– в молекулярном виде:
NaCl + KNO3 NaNO3 + KCl;
– в ионном виде:
Na+ + Cl– + K+ + NO3 – Na+ + NO3 – + K+ + Cl– .
Набор ионов в левой и правой части приведенного уравнения одина-
Необратимо реакции протекают в том случае, если образуются нерастворимые (1), малодиссоциирующие (2) или газообразные (3) продукты, то есть происходит удаление некоторых продуктов реакции из сферы реакции.
2 в молекулярном виде 2NaOH+ H 2 SO4 = Na2 SO4 + 2H2 O
в полном ионном виде 2Na+ + 2OH– + 2H+ + SO4 2– =
2Na+ + SO4 2– + 2H2 O |
||
в сокращенном | H+ + OH– = H2 O |
|
3 в молекулярном виде | Na2 S + H2 SO4 = Na2 SO4 + H2 S |
|
в полном ионном виде | 2Na+ + S2– + 2H+ + SO4 2– = |
|
2Na+ + SO4 2– + H2 S |
||
в сокращенном | 2H+ + S2– = H2 S |
|
Основы номенклатуры неорганических соединений можно изложить следующим образом:
1 Атомы неметаллов в бинарных соединениях (кроме соединений с водородом) называют, добавляя суффикс – ИД к латинскому названию
элемента, например: О–2 – оксид, Cl– – хлорид, I– – йодид, N–3 – нитрид, P–3
– фосфид, S–2 – сульфид и т. д.
2 Формулы большинства сложных неорганических веществ записывают в последовательности «от катиона к аниону» в солях, основаниях и кислотах, например, Na+ Cl– , H+ 2 S–2 , (NH4 )+ 2 SO4 –2 . В водородных соединениях элементов главных подгрупп IV и V групп на первом месте ставится этот элемент, а затем водород: CH4 – метан, SiH4 – силан, NH3 – аммиак, PH3 – фосфин, AsH3 – арсин и другие.

В России названия оксидов, оснований и солей часто составляют «от аниона к катиону», называя справа налево входящие в это соединение атомы или группы и указывая степень окисления главного (центрального) элемента, если она может иметь разные значения в различных веществах1 . Например: MgО – оксид магния, SO2 – оксид серы (IV), SO3 – оксид серы
(VI), FeCl2 – хлорид железа (II), FeCl3 – хлорид железа (III), Cu(OH)2 – гид-
роксид меди (II), (ZnOH)2 SO4 – сульфат гидроксоцинка (или гидроксосульфат цинка), (NH4 )2 HPO4 – гидрофосфат аммония.
Таблица 1
Названия некоторых неорганических веществ и анионов или катионов, входящих в их состав
Название | Формула кислотного |
|
соединения | соединения | остатка, аниона или |
катиона и их название |
||
HNO2 | азотистая кислота | NO2 – – нитрит |
HNO3 | NO3 – – нитрат |
|
NH4 + – аммоний |
||
H2 SiO3 | кремниевая (метакремние- | SiO3 2– – силикат |
вая) кислота | ||
HMnO4 | марганцевая кислота | MnO4 – – перманганат |
H2 SO3 | сернистая кислота | SO3 2– – сульфит |
H2 SO4 | серная кислота | SO4 2– – сульфат |
сероводородная кислота | S2– – сульфид |
|
H2 CO3 | угольная кислота | CO3 2– – карбонат |
HClO4 | хлорная кислота | ClO4 – – перхлорат |
HClO3 | хлорноватая кислота | ClO3 – – хлорат |
хлорноватистая кислота | ClO– – гипохлорит |
|
хлороводородная (соляная) | Cl– – хлорид |
|
Фтороводородная (плавико- | F– – фторид |
|
вая) кислота | ||
HPO3 | метафосфорная кислота | PO3 – – метафосфат |
H3 PO4 | ортофосфорная кислота | PO4 3– – ортофосфат (фос- |
H4 P2 O7 | пирофосфорная кислота | P2 O7 4– – пирофосфат |
гидроксид натрия | OH– – гидроксид |
1 Комиссия по номенклатуре IUPAC рекомендует строить названия начиная с катиона, например: NaCl – натрий хлорид, MgCl(OH) – магний гидроксид хлорид.

1 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ЭЛЕМЕНТЫ | ||
Типичные | Амфотерные | Типичные |
неметаллы |
||
Оснó вные | Амфотерные | Кислотные |
K2 O, CaO | ZnO, Al2 O3 | CO2 , SO3 |
(+ H2 O) | ||
ГИДРОКСИДЫ | ||
Основания | Амфотерные | |
основания | ||
KOH, Ca(OH)2 | Zn(OH)2 , Al(OH)3 | H2 CO2 , H2 SO4 |
Рис. 1.1. Основные классы неорганических соединений и их взаимосвязь
3 Кислородосодержащие кислоты, имеющие в своем составе атом неметалла или металла в высшей степени окисления, имеют суффикс – НАЯ (кислота), в предыдущей – -ИСТАЯ (кислота), например: HNO3 – азотная кислота и HNO2 – азотистая кислота, H2 SO4 – серная кислота и H2 SO3 – сернистая кислота.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления –2.
Оксиды классифицируются на солеобразующие (большинство) и несолеобразующие (CO, N2 O, NO).
Солеобразующие оксиды подразделяют на кислотные, амфотерные и оснόвные.
Общие способы получения оксидов
1 Окисление простых веществ (металлов и неметаллов) кислородом:
2Zn + O2 = 2ZnO S + O2 = SO2
2 Окисление (горение) сложных веществ (органических и неорганических):
СH4 + O2 = СO2 + 2H2 O 2H2 S + 3O2 = 2SO2 + 2H2 O 2CO + O2 = 2CO2
3 Превращения сложных веществ:
а) разложение (без изменения степени окисления) кислородсодержащих кислот, оснований и некоторых солей:
H2 SO3 = SO2 + H2 O Cu(OH)2 = CuO + H2 O CaCO3 = CaO + CO2
б) окислительно-восстановительные реакции: 2Al + Fe2 O3 = 2Fe + Al2 O3
Cu + 4HNO3(конц.) = Cu(NO3 )2 + 2NO2 + 2H2 O 4CuO = 2Cu2 O + O2
Кислотные оксиды – оксиды неметаллов (CO2 , SO3 , SiO2 , P2 O5 ) и оксиды переходных металлов, обычно в степени окисления +5, +6, +7 (V2 O5 , CrO3 , Mn2 O7 ).
Химические свойства кислотных оксидов:
1 Взаимодействие с водой (кроме SiO2 ): SO3 + H2 O = H2 SO4
CrO3 + H2 O = H2 CrO4













