Типы химических связей в веществе. Таирова А.Р., Кузнецов А.И. Общая химия. Теоретические основы. Решение типовых задач - файл n1.doc
Ковалентная связь . Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками. Из квантовой химии следует, что система из положительно заряженного ядра и отрицательно заряженных электронных оболочек имеет минимальную энергию в том случае, когда электронные оболочки заполнены полностью. Поэтому атомы с наполовину заполненными электронными оболочками обмениваются электронами. При этом образуются пары электронов с противоположно направленными спиновыми магнитными моментами, причем эти пары принадлежат обоим соседним атомам (рисунок 1). Таким образом, ковалентной связью называется связь, образуемая путем объединения пар валентных электронов.
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу.
Увеличение порядкового номера элемента ведет к росту количества электронных оболочек, экранирующих взаимодействие положительно заряженных ядер с валентными электронами, что вызывает снижение силы взаимного притяжения. В результате, с ростом порядкового номера элемента падает температура плавления, растет коэффициент теплового расширения, уменьшается модуль упругости.
Рассмотренная на рисунке 1.1 ковалентная связь является неполярной , то есть все участвующие в образовании связи атомы являются одинаковыми с точки зрения потенциалов ионизации и пары электронов находятся точно посередине между ядрами атомов. В случае, если ковалентная связь образуется между атомами с разными потенциалами ионизации (рисунок 1.2), то пара обобществленных электронов сместится к атому с большим потенциалом ионизации и получившееся вещество будет полярным (дипольным), а связь будет называться ковалентной полярной .
Ионная связь . Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами, как это показано на рисунке 1.3. В результате образуются положительно и отрицательно заряженные ионы, взаимно притягивающиеся электростатическими силами.
Общие физические свойства веществ с ионной химической связью следующие: высокая твердость, низкая пластичность и коэффициент линейного расширения, высокая температура плавления. С увеличением размера иона данные свойства увеличиваются.
Металлическая связь (рисунок 1.4) образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки заполнены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ). Каждый из положительно заряженных ионов притягивается к свободным электронам, и, тем самым, ионы притягиваются друг к другу.
 Рисунок 1.5 - Остаточная связь
Рисунок 1.5 - Остаточная связь
|
Остаточная связь, или связь Ван-дер-Ваальса. Образуется при сближении молекул или атомов инертных газов за счет взаимодействия и деформации их электронных оболочек. Атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек. Это ослабляет связь валентных электронов с ядром, что позволяет проще деформировать оболочку. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.
Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Важно иметь в виду, что в одном и том же материале одновременно могут реализовываться несколько типов химических связей. Так, внутри молекулы полиэтилена связь ковалентная, а между молекулами остаточная. В алмазе атомы углерода связаны ковалентной связью, а у графита три электрона образуют ковалентную связь, один электрон идет на образование металлической связи, и образующиеся плоские молекулы связаны остаточной связью.
(Документ)
n1.doc
Глава 4. Химическая связь и строение молекул4.1. Определение химической связи. Свойства веществ зависят от их состава, строения, от типа химической связи между атомами в веществе. Химическая связь имеет электрическую природу. Под химической связью понимают вид взаимодействия между частицами в веществе (или характер распределения электронной плотности).
Современная теория химической связи была предложена в 1916 г. американским ученым Льюисом и одновременно с "ним немецким ученым Косселем. В дальнейшем эти теории были дополнены, углублены, но являются основополагающими.
В образовании химических связей участвуют не все электроны атома, а только электроны внешнего уровня (у s- и p-элементов, т.е. у элементов главных подгрупп периодической системы) или электроны внешнего и недостроенного предвнешнего уровня (у d-элементов, т.е. у элементов побочных подгрупп). Электроны, способные к образованию химических связей, называются валентными. В зависимости от того, сколько электронов приняло участие в образовании химических связей, элемент может находиться в том или ином валентном состоянии (т.е. проявить определенную валентность).
Прежде валентностью элемента называли его способность присоединять или замещать определенное число атомов других элементов. В настоящее время понятие валентности связывают с определенным типом химической связи в веществе.
Соединение атомов в молекулы – энергетически выгодный процесс и всегда сопровождается выделением энергии, величина которой соответствует прочности (энергии) возникшей химической связи:
H+H=H 2 +103 ккал/моль
Cl+Cl=Cl 2 +58 ккал/моль
Теория строения атома объяснила причину объединения атомов в молекулы как стремление к устойчивой двух- или восьмиэлектронной внешней оболочке. Образование устойчивой электронной конфигурации может достигаться различными способами: отдачей, присоединением, обобществлением электронов. Таким образом, под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. К основным чертам химической связи можно отнести:
А) снижение общей энергии двух- или многоатомной системы по
сравнению с суммарной энергией изолированных частиц, из которых
эта система образована;
Б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Существует несколько типов химической связи, из которых важнейшими являются ионная, ковалентная, металлическая связь.
4.2. Ионная связь.
При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молекул состоит в том, что между атомами в молекуле действуют электростатические силы. Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Если на внешнем уровне содержится максимальное число электронов, которое атом может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Такие уровни имеют атомы инертных газов. Это и служит причиной того, что инертные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы других элементов имеют незавершенные энергетические уровни. В процессе химического взаимодействия они их завершают, т. е. приобретают структуру инертных газов.
Ионный тип связи возможен только у элементов, атомы которых резко отличаются по относительной электроотрицательности (см. раздел 3.3.), т.е. способности атомовсмещатьэлектронную плотность в молекуле к себе.
Рассмотрим электронное строение атомов некоторых металлов. неметаллов и инертного газа неона.
Электронная формула атома
Натрия Is 2 2s 2 2p 6 3s 1 или 3s 1
Кальция Is 2 2s 2 2p 6 3s 2 3p 6 4s 2 или 4s 2
Хлора Is 2 2s 2 2p 6 3s 2 3p 5 или Зs 2 3p 5
Кислорода Is 2 2s 2 p 4 или 2s 2 2p 4
Неона Is 2 s 2 p 6
Как видно из электронного строения, атом неона имеет завершенный внешний энергетический уровень, состоящий из восьми электронов, а атомы металлов (натрия и кальция) и неметаллов (хлора и кислорода) - незавершенные энергетические уровни. В процессе химических реакций они стремятся завершить их, т. е. принять конфигурацию инертных газов.
Для завершения энергетических уровней атомам натрия и кальция легче отдать один и два электрона, а атомам хлора и кислорода легче принять один или два электрона. Это и происходит при образовании молекул.
Образование молекул хлорида натрия (NaCI) и оксида кальция (СаО) происходит по схеме:
Na – ē ? Na +
Cl + ē ?Cl –
Атом натрия теряет электрон и превращается в ион натрия, который приобретает конфигурацию инертного газа (Ne), а атом хлора присоединяет электрон, превращается в ион хлора, приобретая конфигурацию инертного газа аргона (Аг).
Аналогично происходит и образование молекулы оксида кальция
Ca – 2ē ? Ca 2+
O + 2ē ? O 2–
Ионы, вследствие сил электростатического притяжения, образуют молекулы. Соединения, которые образовались путем притяжения ионов, называются ионными.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионных соединений сравнительно немного. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь - крайний случай ковалентной связи.
Таким образом, нет принципиального различия в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей. Они различаются лишь степенью поляризации молекулярного электронного облака. Природа химической связи едина.
Для соединений с ионной связью характерны высокая температура кипения и плавления, электропроводностью обладают только в расплавленном состоянии, в воде легко диссоциируют на ионы.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Ненаправленность ионной связи . Ионы можно представить как заряженные шары, силовые поля которых равномерно распределены во всех направлениях в пространстве. Поэтому каждый ион может притянуть к себе ионы противоположного знака в любом направлении (рис. 5).
Ненасыщаемость ионной связи . Взаимодействие двух ионов противоположного знака друг с другом не может привести к полной взаимной компенсации их силовых полей. В силу этого, у них сохраняется способность притягивать ноны противоположного знака и по другим направлениям (рис. 6).


Рис.5 Ненаправленность ионной связи Рис.6 Ненасыщаемость ионной связи
4.3.
Ковалентная связь.
Химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов, называется ковалентной связью.
4.3.1. Неполярная ковалентная связь.
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода.
- Образование молекулы Н 2 . Ядро свободного атома водорода окружено сферически симметричным электронным облаком. При сближении атомов до определенного расстояния происходит перекрывание их электронных облаков с образованием молекулярного облака, обладающего максимальной электронной плотностью в пространстве между ядрами. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания (образования молекулы Н 2) это расстояние сокращается до 0,074 нм (рис. 7). Увеличение плотности отрицательно заряженного электронного облака между положительно заряженными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
Таким образом, ковалентная связь обеспечивается силами электростатического притяжения между сосредоточенной электронной плотностью в межъядерном пространстве, возникшей в результате перекрывания электронных облаков, и положительными зарядами ядер. Ковалентная связь тем прочнее, чем вше степень перекрывания электронных облаков. В результате возникновения связи между атомами водорода каждый атом достигает электронной
конфигурации инертного элемента гелия:
Н ∙ + ∙ Н? Н :
Н или Н 2
- Образование молекулы хлора С1 2 . В молекуле хлора ковалентная связь осуществляется с помощью двух общих электронов или электронной пары. Из семи валентных электронов каждый атом хлора имеет по одному неспаренному. Образование химической связи происходит за счет неспаренных электронов каждого атома. В результате образуется общая электронная пара, которая в равной мере принадлежит обоим атомам и, благодаря чему, каждый атом хлора завершает свой энергетический уровень, достигая конфигурации инертного элемента Рис. 7. Схема перекрывания электронных орбиталей аргона:
при образовании молекулы водорода.
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
: С1 ∙ + ∙ С1 ? : С1 : С1 : или С1 2
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
Или, с точки зрения строения атома, это можно представить так:
электронная формула атома хлора Is 2 2s 2 2p 6 3s 2 3Sp 5
При образовании молекулы происходит перекрывание р-орбиталей (рис. 8).
Рис. 8. Схема образования химической связи в молекуле хлора.
с точки зрения строения атома электронная формула атома азота выглядит так:
?? ? ? ?
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (?) -связь и две пи – связи (?).
Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (?) - связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
Наглядно это представлено на рисунке 9.

Рис. 9.Схема образования химической связи в молекуле азота.
Мы рассмотрели неполярную или гомеополярную ковалентную связь. При неполярной связи вероятность присутствия электронной плотности между ядрами одинакова. Центры тяжести положительных и отрицательных зарядов совпадают. Центром положительного заряда считают середину расстояния между ядрами. В молекулах простых газообразных веществ Н 2 , CI 2 , O 2 , N 2 - в газообразной фазе наблюдается гомеополярная (неполярная) связь.
Вещества с неполярной ковалентной связью обладают низкими температурами кипения и плавления, в воде не диссоциируют, не проводят электрический ток.
4.3.2. Полярная ковалентная связь. Образование молекулы из атомов различных элементов происходит при помощи гетерополярной (полярной) ковалентной связи. Простейший случай гетерополярной связи - это образование молекулы хлорводорода. Образование молекулы НС1 можно представить схемой: . . . .
Н ∙ + ∙ С1 : ? Н : С1:
∙ ∙ ∙ ∙
Здесь происходит перекрывание s-облака атома водорода и р-облака атома хлора (рис. 10).

Рис. 10. Схема образования химической связи в молекуле хлороводорода.
Но в данном случае хлор обладает большей относительной электроотрицательностью. Поэтому происходит оттягивание электронной плотности к атому хлора. В молекуле возникает положительный и отрицательный полюсы.Химическая связь, в которой электронная плотность смещена к одному из партнеров, называется гетерополярной или полярной ковалентной связью. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственно атом получает заряд, называемый эффективным зарядом атома? -. У второго атома повышается плотность положительного заряда? +. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) l д друг от друга. Мерой полярности связи служит электрический момент диполя равный произведению эффективного заряда на длину диполя l д
СВ = ? l д
Электрический момент диполя имеет единицу измерения кулон на
метр (Кл∙м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D
,
равную 3,3-10 –30 Кл∙м
Полярную ковалентную связь с?, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений? ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности. Степень ионности характеризуется эффективным зарядом атомов и возрастает с увеличением разности электроотрицательностей.
Рассмотренный выше механизм образования ковалентной связи (неполярной и полярной) называется обменным. Возможен и другой механизм образования ковалентной связи - донорно-акцепторной. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого. В качестве примера рассмотрим механизм образования иона аммония NH + :
NH 3 + H + ? +
В молекуле аммиакаазот имеет неподеленную пару электронов (двухэлектронное облако). Уиона водорода свободна ls-орбиталь. При сближении двухэлектронное облако азота становится общим как для атома азота, так и для атома водорода, т. е. оно превратилось в молекулярное электронное облако. А значит, возникла четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
H H
.. . . +
H: N : + H + ? H NH :
˙˙ ˙ ˙
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т. е. предоставляющий свободную орбиталь), называется акцептором. Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Таким образом, в катионе аммония четыре равноценные ковалентные связи: три образованные по обменному механизму и одна - по донорно-акцепторному.
Вещества с полярной ковалентной связью занимают по свойствам промежуточное положение между веществами с ионной связью и неполярной ковалентной связью. Ковалентному типу связи характерны атомные и молекулярные кристаллические решетки.
Провести границу между ионной и полярной ковалентными связями не всегда возможно. В соединениях, образованных тремя и более элементами, между атомами могут быть различные типы химической связи.
4.3.3. Свойства ковалентной связи.
Ковалентная связь обычно характеризуется длиной связи, энергией связи, насыщаемостью и направленностью.
Длиной связи называется межъядерное расстояние между химически связанными атомами, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Химическая связь тем прочнее, чем меньше ее длина. Однако количественной мерой прочности связи являетсяее энергия.
Энергия связи равна тойэнергии, которая необходима для разрыва имеющихся в молекулесвязей.Обычно она измеряется в килоджоулях, отнесенных к 1 моль вещества, т. е. к 6,02 10 23 связям. Так, согласно опытным данным, длины связи молекул водорода, хлора и азота соответственно составляют 0,074, 0,198 и 0,109нм(нанометра), а энергии связи соответственно равны 436, 242 и 946 кДж/моль. С увеличением кратности связи энергия связи увеличивается, а длина уменьшается.
Насыщаемость - это полное использование атомом валентных орбиталей. В результате он становится неспособным к установлению дополнительных связей. Например, нельзя присоединить еще атом водорода к молекулам Н 2 или СН 4 . В этих молекулах связи насыщены. Благодаря насыщаемости связей молекулы имеют определенный состав: Н 2 , Н 2 О, НСl и т. д.
Направленность ковалентной связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). Ковалентная связь возникает в направлении максимального перекрывания электронных облаков (орбиталей) вдоль линии соединения атомов. При образовании молекулы НС1 происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекула имеет линейную форму. Химические связи в молекуле воды направлены под углом 104,5°.
Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называются валентными.
4.4. Метод валентных связей (МВС, ВС). Для глубокого понимания сущности ковалентной связи, характера распределения электронной плотности в молекуле, принципов построения молекул простых и сложных веществ необходим метод валентных связей (ВС, МВС).
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
1. Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем нахождение каждого электрона в поле «своего» ядра.
Такая химическая связь является двухцентровой.
2. При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R 1 и R 2), тем прочнее химическая связь (рис. 11).
3. При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т.к. электроны с параллельными спинами отталкиваются, и связь не образуется).

Рис. 11. Перекрывание электронных облаков
4. В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов (иначе говоря – только одноэлектронные облака). Например, изобразим образование молекулы F 2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s 2 2s 2 2p 5):
2s 2 2p 5 2p 5 2s 2 2s 2 2p 6 2p 6 2s 2
?? ?? ?? ? + ? ?? ?? ?? ? ?? ?? ?? ?? ?? ?? ??
Неспаренные электроны 8ē 8ē
Общая (поделенная) пара электронов
Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях).
5. Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН 4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН 5 , СН 6 и т. д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
6. Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи – s-, р-, d- или f- электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают s- (сигма), p- (пи) и d (дельта)-связи.

Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра – это s-связь; если облака перекрываются вне этой линии, возникают p- и d-связи. Разновидности связи при комбинировании s-, р- и d-орбиталей показаны на рисунках:


-связь -связь
Если между атомами возникла одна общая электронная пара (обычно s-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.
Например, образование молекулы азота N 2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 90 0 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом).

Два атома азота, соединяясь в молекулу N 2 , могут образовать одну s-связь (перекрываются облака, ориентированные вдоль оси х) и две p-связи (перекрываются облака, ориентированные вдоль осей у и z).

Угловая конфигурация молекулы воды Н 2 O, определяющая ее высокую полярность и особенности свойств, связана с направлением в пространстве двух химических s-связей, в образовании которых участвовали два неспаренных р-электрона атома кислорода и по одному s-электрону атомов водорода.
1s 2 2s 2 2p 4
H 8 O ?? ?? ?? ? ?
Исходный угол в 90° между двумя р-орбиталями атома О увеличивается за счет взаимного отталкивания атомов Н, несущих избыток положительного заряда (вследствие смещения электронной плотности от Н к О).
Итак, структура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей.
Гибридизацией называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:

Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°

Из одной s-орбитали и двух р-орбиталей образуются три sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу:

sp 3 -гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp 3 -гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109° 28 ў

Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp 3 d 2 - гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
Примером sp 3 -типа гибридизации служит строение молекулы метана СН 4 . Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН 4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28ў. Следовательно, в молекуле СН 4 имеет место sp 3 -гибридизация.

Другие примеры гибридизации: BeH 2 (sp-), BF 3 (sp- 2), РСl 5 (sp 3 d-) и др.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp 3 -гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две – одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н 2 O в целом.
4.5. Метод молекулярных орбиталей (ММО, МО).
Хронологически метод МО появился позже метода ВС, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н 2 + одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны , т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
4.5.1. Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула - это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:
АО s, p, d, f
МО ?, ?, ?, ?
3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе МО ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).

Рис. 12. Энергетическая схема образования молекулы водорода Н 2
Рассмотрение химических связей в методе МО заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1-3, объясним образование молекулы H 2 с точки зрения метода МО. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E 1 .
Молекулярная орбиталь, энергия которой меньше энергии атомной орбитали изолированного атома, называется связывающей
(обозначается символом  св), а находящиеся на ней электроны-связывающими электронами.
св), а находящиеся на ней электроны-связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр), а находящиеся на ней электроны - разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую МО, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E 1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу МО образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe 2 , так как в ней два электрона находились бы на связывающей орбитали и два - на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода МО реакцию образования молекулы водорода из атомов записывают так:
2H = H 2 [(? CB 1s) 2 ],
Т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой МО заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:
N СВ - N разр
где: В – число связей;
N СВ, N разр – соответственно число связывающих и разрыхляющих электронов в молекуле.
В молекуле водорода В = (2-0) : 2=1, водород одновалентен. Молекула Н 2 диамагнитна (электроны спарены).
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н 2 + (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь св 1s. Уравнение процесса:
H + H + = H 2 + [(? св 1s) 1 ], ∆H = - 259,4 кДж

Рис. 13. Энергетическая схема образования Рис. 14. Энергетическая схема
молекулярного иона водорода H 2 образования дигелий-иона Hе 2
Число связей в ионе H 2 + равно Ѕ (связь одним электроном). Ион H 2 + - парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не 2 + (рис.14). Уравнение его образования
He + He + = He 2 + [(? CB 1s) 2 (? разр 1s) 1 ], ∆H = - 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2-1) : 2 = 1 / 2 . 
Рис. 15 . Энергетическая схема образования двухатомных гомонуклеарных молекул элементов второго периода
Ион- парамагнитен (имеет неспаренный электрон).
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода.
Рассмотренный принцип построения МО из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2р x -, 2р y -
и 2р z -орбиталей.
Участием внутренних электронов 1s-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2s-орбиталь одного атома взаимодействует только с 2s-орбиталью другого атома (должна быть близость значений энергий взаимодействующих орбиталей), образуя МО? 2 s св и? 2 s разр. При перекрывании (взаимодействии) 2р-орбиталей обоих атомов образуются МО: ? х св, ? х разр, ? у св, ? у разр, ? z св, ? z разр
( 
Рис. 16. Энергетическая схема образования молекулы Li 2
рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть МО – три связывающих и три разрыхляющих. МО, образующиеся из s
-
и р x -атомных орбиталей, обозначаются буквой , а из р у - и р z - – буквой  . С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода МО.
. С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода МО.
Пример 1. Молекула лития Li 2 . Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K :
2Li = Li 2
Число связей равно 1.
Пример 2. Молекула бериллия Be 2 . Восемь электронов молекулы размещены на МО следующим образом:
Ве 2
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3.
Молекула азота N 2 (рис. 17). Распределение 14 электронов по МО записывается так:
N 2 [(? CB 1s) 2 (? разр 1s) 2 (? CB 2s) 2 (? разр 2s) 2 (? CB 2p y) 2 (? CB 2p z) 2 (? CB 2p x) 2 ]
или сокращенно:
N 2 [КК (? sCB) 2 (? sразр) 2 (? yCB) 2 (? zCB) 2 (? xCB) 2 ]
1 -1 +1 +1 +1=3
Рис. 17. Энергетическая схема образования молекулы N 2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O 2 (рис. 18). Электроны размещаются по МО в последовательности:
O 2 [КК (? sCB) 2 (? sразр) 2 (? yCB) 2 (? zCB) 2 (? xCB) 2 (? yразр) 1 (? zразр) 1 ]
1 -1 +1 +1 +1 - 1 / 2 - 1 / 2 =2

Рис. 18. Энергетическая схема образования молекулы O 2
В молекуле две валентные связи. Последние два электрона разместились на различных?-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования МО гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.

Рис. 19 . Энергетическая схема образования двух атомных гетеронуклеарных молекул элементов второго периода
Пример 5
.
Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s 2 2p 2 , а кислорода 2s 2 2p 4 . Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали? 2 s св, два – на орбитали? 2 s разр, четыре – на орбиталях? y CB и? z CB , а девятый и десятый – на? х св. Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:
СО[КК(? sCB) 2 (? s разр) 2 (? yCB) 2 (? zCB) 2 (? хCB) 2 ]
1 -1 +1 +1 +1=3
Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N 2). Молекула диамагнитна – все электроны спарены.
Пример 6. Молекула NO. На МО молекулы оксида азота (II) должны разместиться 11 электронов: пять азота – 2s 2 2p 3 и шесть кислорода – 2s 2 2p 4 . Десять изних размещаются так же, как и электроны молекулы оксида углерода (II) (пример 5), а одиннадцатый разместится на одной из разрыхляющих орбиталей – ? y разр или? Z разр (эти орбитали энергетически эквивалентны между собой). Тогда
NО[КК (? sCB) 2 (? s разр) 2 (? yCB) 2 (? zCB) 2 (? хCB) 2 (? yразр) 1 ]
1 -1 +1 +1 +1 - 1 / 2 =2 1 / 2
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая -677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.
Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение.
Распределение электронов внешнего энергетического уровня фосфора 3s 2 3р 3 (учитывая правило Хунда,  )
по квантовым ячейкам имеет вид:
)
по квантовым ячейкам имеет вид:
3 s 3 рx 3 py 3 pz
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:
3 s 3px 3py 3 pz 3dxy
Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном - пяти.
Пример 8 . Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВ n , если связь в них образуется за счет sp -, sp 2 -, sp 3 -гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Таблица 13.
Гибридизация орбиталей и пространственная конфигурация молекул
Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение.
Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О 2 ; большую прочность связей в молекулярных ионах F +
2 и О + 2 , чем, соответственно, в молекулах F 2 и O 2 ; наоборот, меньшую прочность связи в ионе N + 2 , чем в молекуле N 2 ; существование молекулярного иона Не 2 + и неустойчивость молекулы Не 2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи - метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей.
Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими.
Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
? CB 1s разр 1s CB 2s разр 2s CB 2p x CB 2p y =
CB 2p z разр 2p y =? разр 2p z
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрых
Порядок связи
в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s
-,
p
-,
d
-,
f-орбиталями молекулярные орбитали обозначаются греческими буквами  . Так, электронная конфигурация молекулы O 2 записывается следующим образом:
. Так, электронная конфигурация молекулы O 2 записывается следующим образом:
O 2 [КК (? sCB) 2 (? sразр) 2 (? pxCB) 2 (? pyCB) 2 ? pzразр? pyразр? pzразр ]
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
4.6. Металлическая связь
.
Само название говорит, что речь пойдет о внутренней структуре металлов. Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону содержат 16 элементов, по два - 56, по три - 4 элемента и ноль - только один Pd. В то же время на внешних уровнях атомов металлов много свободных орбиталей, что позволяет электронам близко подходить к положительным ядрам в любой части кристалла.
Из-за низкой энергии ионизации электроны в металле утрачивают связь с отдельными атомами, легко обобществляются, образуя электронный газ - совокупность свободных электронов. И самое главное состоит в том, что электроны в металле подвижны, легко перемещаются. Это подвижные, или нелокализованные, электроны.
Теперь можно представить металл как плотно упакованную структуру положительных ионов, связанных друг с другом электронным газом. При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов.
Химическая связь, образующаяся в результате электрического притяжения между ионами металла и обобществленными электронами (электронным газом), называется металлической связью. Она характерна для металлов, сплавов и интерметаллических соединений. Природа связи - электрическая.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобщении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической - пластичны; в последнем случае возможно взаимное смещение ионов без нарушения связи. Это говорит о нелокализованности (отсутствии направленности) металлической связи. Для повышения твердости металлов в них вводят такие элементы, которые благоприятствуют образованию направленных - ковалентных - связей.
Таким образом, металлическая связь-это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром.
Ею объясняются физические свойства металлов.
4.7. Водородная связь.
Водородная связь - это своеобразная химическая связь. Она возникает между молекулами, в состав которых входит водород и сильно электроотрицательный элемент. Такими элементами являются фтор, кислород, азот, хлор и др.
Природу водородной связи объясняли по-разному. Наибольшее распространение получило электростатическое взаимодействие.
Механизм водородной связи рассмотрим на примере молекулы воды. При образовании полярной ковалентной связи между атомами водорода и атомом кислорода электроны, первоначально принадлежащие атому водорода, сильно смещаются в сторону кислорода. В результате атом кислорода приобретает значительный эффективный отрицательный заряд, а ядро атома водорода с внешней по отношению к атому кислорода стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Процесс образования водородной связи на примере двух молекул воды может быть представлен следующей схемой (точками обозначается водородная связь, а знаками? + , ? – - эффективные заряды атомов):
. .
?+ . .
?–
: О – Н ∙ ∙ ∙ О – Н
Более правильным следует считать, что в образовании водородной связи принимает участие и донорно-акцепторное взаимодействие. Ведь для этой связи характерны направленность в пространстве и насыщаемость. На это впервые указал Н. Д. Соколов, разработавший квантово-механическую теорию водородной связи.
Согласно донорно-акцепторной теории, водородная связь начинается с электростатического взаимодействия, в результате которого электронная пара атомов водорода еще больше смещается в сторону кислорода, благодаря чему атом водорода как бы «оголяется», другими словами s-орбнталь атома водорода «высвобождается» и становится способной принять неподеленную электронную пару атома кислорода другой молекулы. Поле протона велико и притяжение им электронной пары атома кислорода весьма эффективно, в то время других своих электронов около протона нет, поэтому отталкивание другой молекулы воды в области атома водорода сильно понижается.
Этот механизм объясняет, почему только водород способен образовывать водородную связь. У всякого другого атома при освобождении орбитали ядро не «оголяется» и внутренние оболочки обеспечивают отталкивание от электронных оболочек второй молекулы.
Рассмотренный механизм образования водородной связи требует, чтобы атом элемента, соединяясь с водородом, обладал высокой относительной электроотрицательностью и имел в наличии неподеленную электронную пару. Только при этом условии электронное облако атома водорода достаточно сильно сместится в сторону атома партнера. Таким образом, х имическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы-А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностьюи очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Электростатическая модель образования водородных связей верна только в первом приближении, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома Н, так как атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования водородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента А?- - Н?+ , с другим атомом также электроотрицательного элемента В?- возникает трехцентровая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома В более выгодно, чем на атомной орбитали этого же атома.
Обычно водородную связь обозначают точками и этим указывают, что она слабее ковалентной связи (примерно в 15-20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров уксусной кислоты можно представить схемой агрегаций молекул за счет водородных связей:
1.Образование зигзагообразных цепей в жидком фтороводороде HF:

2. Образование гидрата аммиака NН 3 ∙ Н 2 О при растворении аммиака в воде:
Н – N ∙ ∙ ∙ H – O
4.8. Взаимодействия между молекулами.
При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состояния вещества. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
4.8.1. Вандерваальсовы силы.
В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционое и дисперсионное взаимодействия.
Д иполь-дипольное
взаимодействие.
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рис.3.1). Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным.
Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
иполь-дипольное
взаимодействие.
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рис.3.1). Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным.
Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи (рис.3.1). Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени. Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Величину поляризуемости выражают в единицах объема. Поляризуемость в однотипных молекулах растет с увеличением размера молекул (табл. 14). Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия (табл. 14).
Дисперсионное притяжение.
В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул (рис.3.1).
Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсионное взаимодействие является единственной составляющей вандерваальсовых сил (табл. 14).
Таблица 14
Вклад отдельных составляющих в энергию межмолекулярного
взаимодействия
| Вещество | Электрический момент диполя, D | Поляризуемость. м 3 ∙10 30 | Энергия взаимодействия, кДж/моль | Температура кипения, К |
|||
| ориентационная | индукционная | дисперсионная | суммарная |
||||
| H 2 | 0 | 0,8 | 0 | 0 | 0,17 | 0,17 | 20,2 |
Энергия вандерваальсова взаимодействия. Энергия всех видов вандерваальсова взаимодействия обратно пропорциональна расстоянию между центрами молекул в шестой степени.
При сильном сближении молекул проявляются силы отталкивания между ними, которые обратно пропорциональны расстоянию: между молекулами-в двенадцатой ступени. Поэтому зависимость результирующей энергии вандерваальсова взаимодействия Е в от расстояния между молекулами, I в, выражается уравнением
l 6 B l 12 B
Где: а и b - постоянные.
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4ч0,5 нм, т.е. существенно больше длины химической связи/
Как видно из табл. 14, сувеличением размера молекул в ряду Аr-Хе и НС1-HI растет их поляризуемость и энергия дисперсионного притяжения. Ориентационное взаимодействие вносит значительный вклад в вандерваальсовы силы лишь в случае молекул с большим электрическим моментом диполя. С увеличением суммарной энергии межмолекулярного взаимодействия возрастает температура кипения жидкостей, атакже теплота их испарения.
Суммарная энергия вандерваальсового взаимодействия молекул на 1-2 порядка ниже энергии химических связей.
Итак, между молекулами возникают относительно слабые вандерваальсовы взаимодействия, включающие дисперсионные силы, а для полярных молекул и диполь-дипольное притяжение и индукционные взаимодействия.
4.8.2. Донорно-акцепторное взаимодействие молекул. Комплексные соединения. Если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH 3 + BF 3 = NH 3 BF 3
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора - вакантная орбиталь.
При взаимодействии по донорно-акцепторному механизму атом азота отдает на связь пару электронов, а атом бора - вакантную орбиталь, в результате чего возникает ковалентная связь
H – N +ڤ B – F ? H – N – B – F
В полученном соединении суммарные валентности бора и азота равны четырем.
Комплексы. Аналогичным образом образуется соединение КРF 6 при взаимодействии KF и PF 5 , которое можно записать в виде К[РF 6 ].
При взаимодействии сульфата меди и аммиака образуется сложное соединение
CuSO 4 +4NH 3 =CuSO 4 4NН 3
которое выражается формулой [Сu(NН 3) 4 ]SO 4 . Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений. (см. главу 9).
























 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- Образовательная – вызвать объективную необходимость изучения нового материала, способствовать овладению знаниями по теме «Типы химической связи», познакомить учащихся с понятиями: “общая электронная связывающая пара”, “ковалентная химическая связь»; повторить и закрепить понятия: “электроотрицательность”, “устойчивое энергетическое состояние атома”, “завершенный внешний энергетический уровень атома”.
- Развивающая – формировать умение устанавливать причинно-следственные связи, систематизировать материал, делать выводы по теме; способствовать развитию мышления, познавательных и общетрудовых умений.
- Воспитательная – формировать добросовестное отношение к учебному труду, положительной мотивации к учению, коммуникативных умений; убеждать в необходимости привлечения средств науки химии к пониманию и описанию процессов, идущих в окружающем мире.
Методы: репродуктивный, частично-поисковый.
Форма организации занятий: словесный (лекция), наглядный, проблемное изложение, фронтальный опрос, самостоятельная работа.
Средства обучения:
- учебно-материальные: химические реактивы, компьютер, проектор, книги, ТСО;
- дидактико-методические: химический язык, химический эксперимент, дидактический материал;
- психолого-педагогические: познавательные задания (вопросы, тесты, алгоритмы).
Форма организации работы в классе: индивидуальная, фронтальная.
Хронометраж урока:
- Организационный этап – 1 мин.
- Актуализация знаний. Постановка цели и задач урока – 7 мин.
- Изучение нового материала. Усвоение новых знаний и способов действий – 23 мин.
- Закрепление изученного материала. Первичная проверка понимания – 8 мин.
- Рефлексия и подведение итогов – 4 мин.
- Домашнее задание – 2 мин.
Данный урок можно использовать для учащихся 8 классов при изучении темы «Химическая связь», для учащихся 9 классов в качестве повторения перед изучением темы «Электролитическая диссоциация», в 10 и 11 классах для углубления знаний по теме «Химическая связь». Для работы учащимся выдаются конспекты к уроку (приложение 1 ), которые необходимо заполнять в процессе урока, в конспекте указано домашнее задание. Заполненные конспекты с выполненным домашним заданием сдаются на следующем уроке и оцениваются.
Ход урока
I. Организационный этап .
II. Актуализация знаний. Постановка цели и задач урока.
На этапе актуализации знаний ученики вспоминают строение атома и строение электронной оболочки атома, изменение свойств атома по периодической системе элементов, понятие электроотрицательности.
По современным представлениям химическая связь между атомами имеет электростатическую природу . Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами. Поэтому особо важным представляется повторение понятия электроотрицательность. На втором слайде представлены вопросы, на которые следует ответить
- Что такое электроотрицательность?
- За единицу принята электроотрицательность какого элемента?
- Какой элемент имеет наибольшую электроотрицательность?
- Как по электроотрицательности отнести элементы к металлам и неметаллам?
- Как изменяется значение электроотрицательности по таблице элементов Д.И. Менделеева? (приложение 2 , ответы) .
На поставленные вопросы заслушиваем ответы учащихся .
I II . Изучение нового материала.
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Различают три основных типа химической связи: ковалентную, ионную, металлическую (слайд 3) .
- Ковалентная связь (атомная связь, гомеополярная связь) - химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Связь, возникающая между атомами элементов, электроотрицательности которых одинаковы или отличаются, но не очень сильно.
- Ионная связь – химическая связь между атомами элементов, электроотрицательности, которых резко отличаются и устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
- Металлическая связь - химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Ковалентная связь (слайд 4 ).
В слове "ковалентная" приставка "ко-" означает "совместное участие". А "валента" в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами. Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь , которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
- Ковалентная химическая связь может быть образована атомами одного и того же элемента (электроотрицательность атомов одинакова ) и тогда она неполярная (слайд 5 ) . Такая ковалентная связь наблюдается при образовании простых веществ – неметаллов: H 2 , Cl 2 , N 2 , O 2 и др.
- Ковалентная химическая связь , образованная атомами разных элементов, электроотрицательности которых, отличается незначительно, называется полярной (слайд 6) . Этот случай встречается наиболее часто при образовании молекул: H 2 O , HCl , CH 4 , NH 3 и др.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода (слайд 7 , рис.1) .

Рис. 1. Возникновение ковалентной связи при образовании молекулы водорода из двух атомов водорода. Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона "обслуживают" ядра независимо от того, "свое" это ядро или "чужое".
Когда электронные оболочки двух атомов водорода сближаются и образуют новую, теперь уже молекулярную электронную оболочку (рис.1), эта новая оболочка подобна завершенной электронной оболочке атома благородного газа гелия (1s 2 ). В образовавшейся системе из двух водородных атомов каждое ядро обслуживается двумя электронами. В новой (молекулярной) оболочке уже невозможно различить, какой из электронов ранее принадлежал тому или другому атому. Принято говорить, что электроны обобществлены .
Поскольку оба ядра претендуют на пару электронов в равной степени, электронная плотность сосредоточена как вокруг ядер, так и в пространстве между атомами (это показано на рис.2). Именно эту область повышенной электронной плотности между ядрами и называют ковалентной связью .

Рис. 2. Другой способ изображения атомных и молекулярной орбиталей: густота точек отражает "электронную плотность", то есть вероятность нахождения электрона в какой-либо точке пространства около ядер атомов водорода. Видно, что значительная электронная плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода.
На рисунках 1 и 2 вы видите очень детальное изображение ковалентной связи. На практике используют более простые способы. Например, американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:
Структурная формула
Оказалось, что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электронов позволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией. Формулы с черточками между атомами называются структурными формулами.
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
Рассмотрим связывание двух атомов хлора 17 Cl (слайд 8) (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем электронную формулу для атома хлора и конфигурацию его внешней электронной оболочки:
ответ учащегося
Учитель : Число электронов на внешнем уровне?
Ученик : На внешнем электронном уровне хлора содержится 2s + 5p = 7 электронов.
Учитель: Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего , третьего уровня . Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:

При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора. Последнее изображение – структурная формула, в которой поделенная пара электронов обозначена черточкой.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой (связывающей) . Остальные пары электронов называют неподеленными парами . Они заполняют оболочки и не принимают участие в связывании.
Льюис не только предложил теорию ковалентной связи, но и первым сформулировал правило октета-дублета. Это правило применительно к химическим связям можно сформулировать так:
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных газов.
Два атома водорода, объединившись в молекулу, приобрели "завершенную” молекулярную оболочку , подобную завершенной электронной оболочке атома благородного газа гелия (1s 2) . Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную оболочку атома аргона (...3s 2 3p 6) .
Связь между атомами может осуществляться не обязательно одной, но и двумя и даже тремя поделенными парами, если этого требует правило октета. Такие связи называются двойными и тройными . Рассмотрим образование связи для молекулы кислорода и азота.
Приведите электронную конфигурацию для атома кислорода, распределение электронов по квантовым ячейкам, укажите сколько электронов на последнем электронном уровне, сколько неподеленных пар
ответ учащегос я 1s 2 2s 2 2p 4 +8 O
![]()
На внешнем электронном уровне 6 электронов, три неподеленные пары.
Учитель : таким образом, только что рассмотренный нами кислород может образовывать двухатомную молекулу с октетом электронов у каждого атома только тогда, когда между атомами помещаются две поделенные пары (слайд 9) :

И для атома азота приведите электронную конфигурацию, а главное распределение электронов по квантовым ячейкам
ответ учащегос я 1s 2 2s 2 2p 3 +7 N

Учитель: Атомы азота (...2s 2 2p 3 на последней оболочке) также связываются в двухатомную молекулу, но для организации октета электронов им требуется расположить между собой уже три поделенные пары (слайд 10):

Принято изображать электронные пары (то есть химические связи) между атомами черточками . Каждая черточка – это поделенная пара электронов. В этом случае уже знакомые нам молекулы выглядят так:

Формулы с черточками между атомами называются структурными формулами . Структурные формулы очень хороши для изображения молекул: они четко показывают – как атомы связаны между собой, в каком порядке, какими связями.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна черточка в структурных формулах.
Двойные и тройные связи имеют общее название – кратные связи . О молекуле азота говорят, что она имеет порядок связи , равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
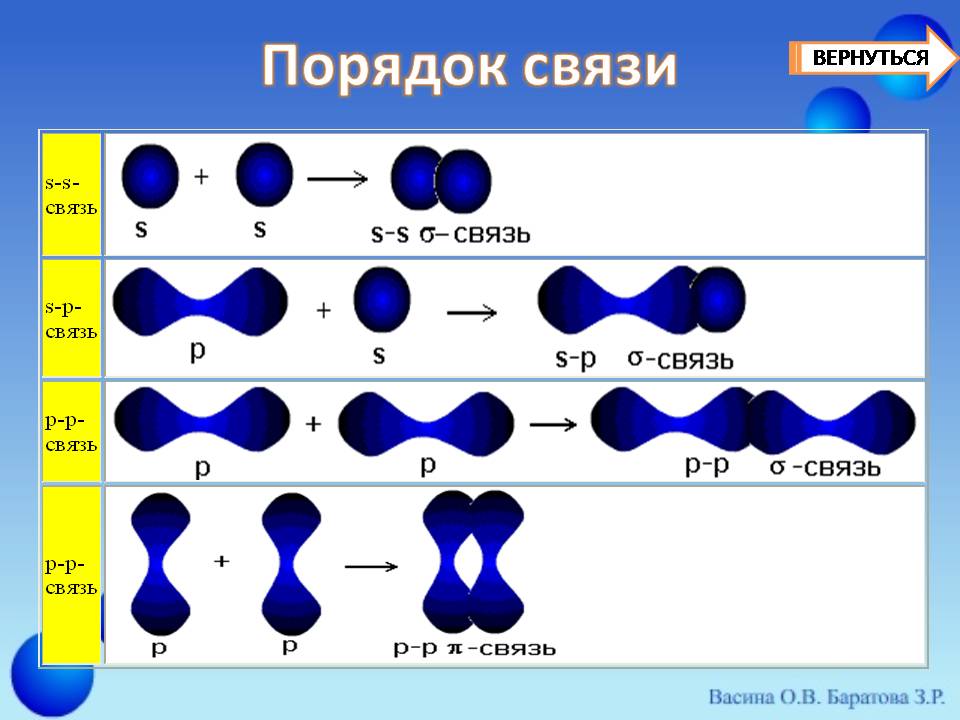
Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков (слайд 11) .
| s-s- связь |  |
| s-p- связь |  |
| p-p- связь | |
| p-p- связь |  |
у -связь значительно прочнее р -связи, причём р -связь может быть только у -связью. За счёт этой связи образуются двойные и тройные кратные связи.
Если электронные орбитали перекрываются по линии, соединяющей ядра атомов, то такая связь называется у -связью (сигма-связью). В случае образования р – р -связей (двойная или тройная) из-за взаимно перпендикулярного расположения в атомах р-электронных орбиталей только одна из связей может быть у -связью. Остальные р-электронные орбитали перекрываются по обе стороны от линии, соединяющей ядра атомов. Такая связь называется р -связью (пи-связью).
Молекулы многих соединений состоят из атомов разного вида и поэтому содержат полярные ковалентные связи . Например, полярные ковалентные связи присутствуют в соединениях:

Полярные ковалентные связи образуются между атомами с разной электроотрицательностью. Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью .
Рассмотрим образование молекулы хлороводорода (слайд 12)

За счёт смещения электронов от водорода к хлору атом хлора заряжается частично отрицательно, водорода – частично положительно.
В образовании молекулы H 2 S участвуют два атома Н (1s 1) и S (…3s 2 3p 4). Электронная формула молекулы Н: S : H , cтруктурная формула Н – S – H (слайд 13).
Образование молекулы воды.
Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s 1) и кислорода (...2s 2 2p 4). Затем записываем электронные формулы, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в молекуле воды (слайд 14):

Оказывается, для этого необходимо взять именно два атома водорода на один атом кислорода. Однако природа такова, что акцепторные свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть позже). Поэтому связывающие электронные пары для воды слегка смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды.
Для примера рассмотрим диоксид серы SO 2 . Кислород и сера имеют похожие валентные оболочки (...2s 2 2p 4) и (...3s 2 3p 4), но внешние электроны серы находятся дальше от ядра и притягиваются к ядру слабее, чем у кислорода. Из-за этого поделенные электронные пары в молекуле SO 2 смещены вдоль химических связей в сторону атомов кислорода, которые приобретают частичный отрицательный заряд. Такой частичный заряд обозначают греческой буквой "дельта". Атом серы приобретает частичный положительный заряд, а атомы кислорода – частичный отрицательный заряд.

В образовании молекулы NH3 принимают участие три атома водорода (1s 1) и атом азота (...2s 2 2p 3). Структурная формула
 , у атома азота остается одна неподеленная электронная пара (слайд 15).
, у атома азота остается одна неподеленная электронная пара (слайд 15).
Соединения с ковалентными неполярными и полярными связями в обычных условиях часто являются газами или жидкостями. Если это твердые вещества, то плавятся они достаточно легко, хотя есть и исключения. Растворы таких веществ далеко не всегда проводят электрический ток, потому что при растворении они могут и не распадаться на ионы. Типичные соединения с полярными ковалентными связями: хлороводород HCl, углекислый газ СО 2 , вода Н 2 О, песок SiO 2 , многочисленные органические соединения.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма , когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму , если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (слайд 16) .

Донорно-акцепторная связь координационная связь, термин, обозначающий один из способов образования химической ковалентной связи. Обычная ковалентная связь между двумя атомами обусловлена взаимодействием двух электронов - по одному от каждого атома. Донорно-акцепторная связь осуществляется за счёт пары электронов одного атома (донора) и свободной (незаполненной) орбитали другого (акцептора) (слайд 17, 18) . Схематически это различие можно выразить так:
В обоих случаях электроны становятся общими для двух атомов.
Типичным примером является образование иона аммония при реакции аммиака с ионом водорода (протоном) (слайд19):

В молекуле аммиака азот имеет неподелённую пару электронов, у иона водорода 1s-орбиталь свободна. При достаточном сближении молекулы NH 3 и иона Н + двухэлектронное облако азота попадает в сферу притяжения иона водорода и становится общим и для атома азота, и для атома водорода, т. е. возникает четвёртая ковалентная связь N - Н. Все связи N - Н в этом ионе становятся равноценными и неразличимыми. Ещё один важный пример - образование иона оксония (слайд 20):

В данном случае молекула воды - донор, протон - акцептор.
Этот способ образования ковалентной связи играет большую роль в химии комплексных соединений
I V. Закрепление изученного материала .
(слайд 21), (приложение 3 , ответы).
- Исходя из строения атомов 6 C, 1 H и правила октета, составьте электронную формулу для соединения этих двух элементов, в составе которого 1 атом углерода. Нарисуйте для него структурную формулу.
- Исходя из электронного строения атомов и правила октета, составьте электронные формулы для соединений, состоящих: а) из одного атома 6 C и двух атомов 8 О; б) из двух атомов 6 C и двух атомов 1 H. Каковы кратности связей между атомами углерода в этих двух соединениях? Нарисуйте их структурные формулы.
- По структурной формуле составьте электронную формулу с указанием всех неподеленных электронных пар: H – C ≡ N
- Напишите структурные формулы для соединений: H 2 S, I 2 , ICl. Найдите здесь соединение с ковалентной связью.
- Напишите электронную формулу валентной оболочки элемента 34 Se. Сколько поделенных и сколько неподеленных электронных пар в соединении H 2 Se? Нарисуйте его структурную формулу.
- Напишите электронную формулу и нарисуйте структурную формулу для соединения SF 6 . Сколько поделенных и сколько неподеленных электронных пар в этом соединении? Примечание: фтор – сильнейший акцептор электронов, поэтому электронные пары химических связей сдвинуты от атома серы к атомам фтора.
V. Рефлексия .
Учащимся заданы вопросы (слайд 22 ):
- Достигли ли вы цели урока? В какой степени?
- Какие вопросы вызвали наибольшее затруднение?
VI. Домашнее задание .
- §41 (по учебнику Г.Е.Рудзитис, Ф.Г.Фельдман Химия 8 класс – М.: «Просвещение», 2009.), № 25 – 28 по конспекту – для 8 класса.
- Конспект, №25-28 по конспекту – для 9, 10 классов.
- §4 (по учебнику О.С.Габриелян и др. Химия – 11 класс. Базовый уровень – М.: Дрофа, 2009.), № 25 – 28 по конспекту – для 11 класса.
Литература :
- Г.Е. Рудзитис, Ф.Г. Фельдман Химия 8 класс – М.: «Просвещение», 2009.
- Учебник «Общая химия» itchem.ru/
- Начальный курс химии alhimik.ru/teleclass/konspect/konsp3-01.shtm
- А.В. Мануйлов, В.И. Родионов Электронный учебник www.hemi.nsu.ru/index.htm
- Общая химия www.chemel.ru/2008-05-24-19-19-34.html
- В.В. Загорский Химическая связь и строение молекул en.edu.ru/publications/general/3869?catalogueId=3
- С.Т. Жуков Химия - 8-9 класс www.chem.msu.su/rus/school/zhukov1/welcome.html
- О.С. Габриелян и др. Химия – 11 класс. Базовый уровень – М.: Дрофа, 2009.













