Из чего состоит вещество? Атом и молекула. Чистые вещества и смеси. Молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов
Атомы – очень маленькие частицы, их размер лежит в пределах от одного до пяти ангстрем (обозначается – Аo .). Один ангстрем – это 10–10 метра. Размер кристаллика сахара приблизительно 1 мм, такой кристаллик больше любого из входящих в его состав атомов примерно в 10 миллионов раз. Чтобы лучше представить себе, насколько маленькими частичками являются атомы, рассмотрим такой пример: если яблоко увеличить до размеров земного шара, то атом, увеличенный во столько же раз, станет размером со среднее яблоко.
Несмотря на столь малые размеры, атомы представляют собой довольно сложные частицы. Со строением атомов вы познакомитесь в этом году, а пока скажем только, что любой атом состоит из атомного ядра и связанной с ним электронной оболочки , то есть тоже представляет собой систему.
В настоящее время известно чуть более ста видов атомов. Из них устойчиво около восьмидесяти. И из этих восьмидесяти видов атомов построены все окружающие нас объекты во всем их бесконечном многообразии.
Одной из важнейших особенностей атомов является их склонность соединяться друг с другом. Чаще всего при этом образуются молекулы .
Молекула может содержать от двух до нескольких сотен тысяч атомов. При этом маленькие молекулы (двухатомные, трехатомные...) могут состоять и из одинаковых атомов, а большие, как правило, состоят из разных атомов. Так как молекула состоит из нескольких атомов и эти атомы связаны, молекула представляет собой систему.В твердых и жидких телах молекулы связаны друг с другом, а в газах – не связаны.
Связи между атомами называются химическими связями , а связи между молекулами – межмолекулярными связями .
Связанные между собой молекулы образуют вещества .
Вещества, состоящие из молекул, называются молекулярными веществами . Так, вода состоит из молекул воды, сахар – из молекул сахарозы, а полиэтилен – из молекул полиэтилена.
Кроме этого,многие вещества состоят непосредственно из атомов или других частиц и не содержат в своем составе молекул. Например, не содержат молекул алюминий, железо, алмаз, стекло, поваренная соль. Такие вещества называются немолекулярными .
В немолекулярных веществах атомы и другие химические частицы, как и в молекулах, связаны между собой химическими связями.Деление веществ на молекулярные и немолекулярные – это классификация веществ по типу строения .
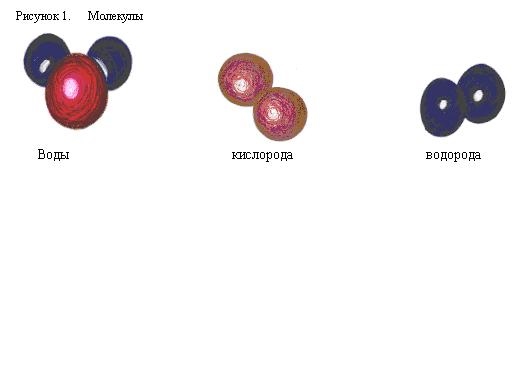
Принимая, что связанные между собой атомы сохраняют шарообразную форму, можно построить объемные модели молекул и немолекулярных кристаллов. Примеры таких моделей приведены на рис. 1.1.
Большинство веществ обычно находится в одномиз трех агрегатных состояний : твердом, жидком или газообразном. При нагревании или охлаждении молекулярные вещества могут переходить из одного агрегатного состояния в другое. Такие переходы схематически показаны на рис. 1.2.
Переход немолекулярного вещества из одного агрегатного состояния в другое может сопровождаться изменением типа строения. Чаще всего это явление происходит при испарении немолекулярных веществ.

При плавлении,кипении,конденсации и тому подобных явлениях, происходящих с молекулярными веществами, молекулы веществ не разрушаются и не образуются. Рвутся или образуются только межмолекулярные связи. Например, лед при плавлении превращается в воду, а вода при кипении – в водяной пар. Молекулы воды при этом не разрушаются, и, следовательно, как вещество вода остается неизменной. Таким образом, во всех трех агрегатных состояниях это одно и то же вещество – вода.
Но далеко не все молекулярные вещества могут существовать во всех трех агрегатных состояниях. Многие из них при нагревании разлагаются , то есть превращаются в другие вещества, при этом разрушаются их молекулы. Например, целлюлоза (основная составная часть древесины и бумаги) при нагревании не плавится, а разлагается. Ее молекулы разрушаются, а из "осколков" образуются совсем другие молекулы.
Итак,молекулярное вещество остается самим собой, то есть химически неизменным, до тех пор, пока сохраняются неизменными его молекулы.
Но вы знаете, что молекулы находятся в постоянном движении. И атомы, из которых состоят молекулы, тоже движутся (колеблются). При повышении температуры колебания атомов в молекулах усиливаются. Можем ли мы сказать, что молекулы остаются полностью неизменными? Конечно, нет! Что же тогда остается неизменным? Ответ на этот вопрос – в одном из следующих параграфов.
Вода. Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 /4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название. Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь в 9-м классе. |
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения. В виде чугуна, стали и других сплавов железо используется буквально во всех отраслях техники. Его ценные магнитные свойства используются в генераторах электрического тока и электромоторах. Железо является жизненно необходимым элементом для человека и животных, так как оно входит в состав гемоглобина крови. При его недостатке клетки тканей получают недостаточно кислорода, что ведет к очень тяжелым последствиям. |
Как вы уже знаете, атомы бывают одинаковые и разные. Чем разные атомы отличаются друг от друга по строению, вы скоро узнаете, а пока скажем только, что разные атомы отличаются химическим поведением , то есть своей способностью соединяться друг с другом, образуя молекулы (или немолекулярные вещества).
Иными словами, химические элементы – это те самые виды атомов, которые упоминались в предыдущем параграфе.
Каждый химический элемент имеет свое название, например: водород, углерод, железо и так далее. Кроме того, каждому элементу присвоен еще и свой символ . Эти символы вы видите, например, в " Таблице химических элементов" в школьном кабинете химии.
Химический элемент – абстрактная совокупность. Так называют любое число атомов данного вида, причем атомы эти могут находиться где угодно, например: один – на Земле, а другой – на Венере. Химический элемент нельзя ни увидеть, ни пощупать руками. Атомы, образующие химический элемент, могут быть как связаны, так и не связаны друг с другом. Следовательно, химический элемент не является ни веществом, ни материальной системой.
Молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов.
Вещество (например, сахар) можно размолоть на самой тонкой мельнице и все равно каждая крупинка будет состоять из огромного количества одинаковых молекул сахара и сохранит все известные нам свойства этого вещества. Даже если раздробить вещество на отдельные молекулы, как это происходит при растворении сахара в воде, то вещество продолжает существовать и проявлять свои свойства (в этом легко убедиться, попробовав раствор на вкус). Значит, самостоятельно существующая молекула сахара - это еще вещество под названием "сахар" (пусть даже очень маленькое количество этого вещества). Но если продолжить дробление дальше, то придется разрушить молекулы. А разрушив молекулы или даже отняв у них по паре атомов (из трех десятков, составляющих молекулу сахара!), мы уже разрушаем само вещество. Конечно, атомы никуда не исчезают - они начинают входить в состав каких-то других молекул. Но сахар как вещество при этом перестает существовать - он превращается в какие-то другие вещества.
Вещества не вечны, потому что не вечны их молекулы. Зато атомы практически вечны. В каждом из нас найдутся атомы, существовавшие еще во времена динозавров. Или участвовавших в походах Александра Македонского, или в плавании Колумба, или побывавших при дворе Ивана Грозного.
Несмотря на то, что молекулы очень малы, их устройство можно выяснить различными физическими и химическими методами. Чистое вещество состоит из молекул одного вида. Если физическое тело содержит молекулы нескольких видов, то мы имеем дело со смесью веществ. Понятия "чистый" в химии и в быту неодинаковы. Например, когда мы говорим: - "Какой чистый воздух!" - то на самом деле вдыхаем сложную смесь нескольких газообразных веществ. Химик скажет о лесном воздухе: "Нужно серьезно поработать, чтобы выделить из этой смеси чистые вещества". Интересно, что в атмосфере любого из них по отдельности человек существовать бы не смог. В таблице 1-1 приведено соотношение этих газообразных веществ в свежем лесном воздухе.
Таблица 1-1. Состав атмосферного воздуха в сосновом лесу.
В таблице 1-1 азот, кислород, аргон и т.д. - это отдельные вещества. Вещество азот состоит из молекул азота, всем известное вещество вода - измолекул воды, терпинеол состоит из молекул терпинеола. Молекулы этих веществ могут быть очень разными - от простейших, состоящих из двух-трех атомов (азот, кислород, озон, углекислый газ) - до молекул, состоящих из многих атомов (такие молекулы встречаются в живых организмах). Например, терпинеол, который образуется в хвойных деревьях и придает воздуху запах свежести.
Это означает, что веществ, как и видов молекул, может быть бесконечное множество. Никто не может назвать точное число веществ, известных людям сегодня. Можно лишь ориентировочно сказать, что таких веществ - более семи миллионов.
Атомы в молекулах разных веществ связаны друг с другом в строго определенном порядке, установление которого - одно из самых интересных занятий в работе химика. Устройство и состав молекул можно описывать разными способами, например так, как это сделано на рис. 1-1, где атомы имеют вид шариков. Размеры шариков имеют физический смысл и примерно соответствуют относительным размерам атомов. Те же самые вещества могут быть изображены иначе - с помощью химических символов. Издавна за каждым видом атомов в химии закреплен символ из латинских букв. В таблице 1-2 приведены символические записи веществ, изображенных на рис. 1-1. Такие символические записи называются химическими формулами .
Таблица 1-2. Химические формулы веществ из рис. 1-1. Цифра ниже символа показывает, сколько атомов данного вида содержится в молекуле. Эта цифра называется индексом. По традиции индекс "1" никогда не пишут. Например, вместо С 1 О 2 пишут просто: СО 2 .
Рис. 1-1. Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 - азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон (образуется из кислорода при грозовых разрядах), 7 - терпинеол (выделяется хвойными деревьями).
Существует условное деление веществ на простые и сложные. Молекулы простых веществ состоят из атомов одного вида. Примеры: азот, кислород, аргон, озон. Молекулы сложных веществ составлены из атомов двух и более видов: углекислый газ, вода, терпинеол.
Часто физическое тело состоит из молекул нескольких разных веществ. Такое физическое тело называется смесью. Например, воздух - смесь нескольких простых и сложных веществ. Не нужно путать сложное вещество со смесью. Сложное вещество, если оно состоит из молекл только одного вида, смесью не является.
Атомы и молекулы. Атомно – молекулярное учение. Вещества молекулярного и немолекулярного строения
I. Новый материал
Эта лекция будет посвящена следующим понятиям: "атом", "молекула", "вещества молекулярного и немолекулярного строения", "атомно-молекулярное учение".
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово "атом” в переводе означает "неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в состав которых входят элементы (атомы). Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых элементов (атомов). Учение об атомах получило дальнейшее развитие в трудах известного английского ученого Джона Дальтона (1766 – 1844 гг.).
МОЛЕКУЛЫ И АТОМЫ
Можно ли опытным путем доказать, что молекулы состоят из атомов?
То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. Это кислород. В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. Это водород.
Схема аппарата для разложения воды (аппарат Гофмана)
Объяснить это явление можно так. Мельчайшая частица воды – молекула состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы – атомы кислорода и водорода. Затем атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная молекула кислорода и две водорода.
Некоторые представления об атомах и молекулах, высказанные М. В. Ломоносовым за полвека до Д. Дальтона, оказались более достоверными и научными. Например, английский ученый категорически отрицал возможность существования молекул, состоящих из одинаковых атомов. Его взгляды отрицательно сказались на развитие химии.Учение о молекулах и атомах окончательно было принято только в 1860 г. на Всемирном съезде химиков в Карлеруэ.
Итак, что такое молекулы и атомы?
Молекулы – мельчайшие частицы вещества, состав которых и химические свойства такие же, как у данного вещества. Молекулы – предельный результат механического дробления вещества.
Атомы – это мельчайшие химически неделимые частицы, из которых состоят молекулы. Молекулы, в отличие от атомов, являются химически делимыми частицами.
Молекулярные вещества
Молекулярные вещества - это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы - наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Например: Вода - жидкость, tпл=0°С; tкип=100°С
Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3/4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название.
Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 oС, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь позже.
Немолекулярные вещества
Немолекулярные вещества - это вещества, мельчайшими структурными частицами которых являются атомы или ионы .
Ион - это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Например: Na+, Cl-.
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например: Поваренная соль - твердое вещество, tпл=801°С; tкип=1465°С; Железо
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения.

В виде чугуна, стали и других сплавов железо используется буквально во всех отраслях техники. Его ценные магнитные свойства используются в генераторах электрического тока и электромоторах. Железо является жизненно необходимым элементом для человека и животных, так как оно входит в состав гемоглобина крови. При его недостатке клетки тканей получают недостаточно кислорода, что ведет к очень тяжелым последствиям.
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы - молекулы и атомы - находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ - из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества - из «сложных атомов» (в современном понимании - молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом - наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом - это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
Основные положения атомно-молекулярного учения можно сформулировать так:
- Существуют вещества с молекулярным и немолекулярным строением.
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей - в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
II. Закрепление
1. Дайте ответы на следующие вопросы:
2. Назовите имя древнегреческого философа, который высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов.
3. Назовите имя великого русского учёного, основоположника учения о молекулах и атомах.
4. Дайте определение молекуле.
5. Дайте определение атому.
6. Какие вещества относят к веществам молекулярного строения? Приведите примеры веществ.
7. Какие вещества относят к веществам немолекулярного строения? Приведите примеры веществ.
8. Какими свойствами характеризуются веществамолекулярного строения?
9. Какими свойствами характеризуются веществанемолекулярного строения?
10. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
Все вещест-ва могут быть твёрдыми, жидкими и газооб-разными. Вода, лёд, водяной пар — всё это разные состояния одного и того же вещест-ва — воды. Что же происходит с водой, когда мы её охлаждаем или нагреваем? Почему так меняются её свойства?
Все вещества состоят из множества мельчайших частиц — молекул и ещё более мелких частичек — атомов. От их взаимодействия и зависят все свойства веществ. Атомы и молекулы называют частицами вещества .
Их можно обнаружить только с помощью сложных приборов. По своим свойствам они очень разнообразны. Сахар состоит из одних час-тиц, соль — из других, вода — из третьих. В каждом веществе огромное количество моле-кул, а атомов ещё больше.
Вещества бывают разные. В природе мы встре-чаем не только чистые вещества, которые состо-ят из одинаковых частиц вещества (вода, соль, сахар). Попробуем смешать воду и чернила.
Какое получилось вещество? Эту жидкость нель-зя назвать ни водой, ни чернилами. Это смесь.
Вещество в природе очень часто бывает в состоянии смеси. Например, почва. Она состо-ит из мельчайших комочков глины и из более крупных песчинок и камней. А ещё в неё входят перегнившие остатки растений. Поч-ва — смесь веществ.
Обычный воздух — тоже смесь: в нём много разных газов. Там есть кислород, которым ды-шат все живые организмы. Есть углекислый газ, который поглощают растения для образования питательных веществ. Есть в воздухе и пыль.
Почему же твёрдые тела, жидкости и газы так не похожи друг на друга? Может, их час-тицы ведут себя по-разному? Ведь именно от взаимоотношений мельчайших атомов и моле-кул должны зависеть свойства веществ.
В твёрдых телах все частицы крепко при-жаты друг к другу. Такое расположение напо-минает физкультурников на параде.
В жидкостях частицы свободно перемещают-ся относительно друг друга, как люди на ули-це. Поэтому жидкости текут, ведь можно ска-зать, что и толпа «течёт» по улице.
В газах частицы очень далеки друг от дру-га, как редкие прохожие ранним утром. По-этому газы легко сжимаются, уплотняются. Материал с сайта
В твёрдых телах частички как бы держатся друг за друга. Чтобы их расцепить и превра-тить твёрдое тело в жидкость, нужно его на-греть, то есть добавить тепла. А если тепла добавить ещё больше, то частички начнут бы-стро двигаться и разбегаться в разные сторо-ны. В результате жидкость превратится в газ. Вспомни, что происходит, когда люди забыва-ют снять с плиты кипящий чайник. Вся вода в нём выкипает — превращается в газ и мель-чайшие капельки воды.
А что происходит, когда мы охлаждаем воду в холодильнике? Лишённые тепла, частички начинают соединяться друг с другом — уплот-няться, и вода превращается в твёрдый лёд.
На этой странице материал по темам:
Реферат тела и вещества
Что из чего состоит. тела, атомы, молекулы, вещества
Из чего состоят вещества и как ведут себя частицы
-













