היווצרות ותכונות של קשרים כימיים. מולקולות פוליאטומיות. כדוגמה, לשקול את המולקולות CH4, NH3, CO2
כוחות ואן דר ואלס
כוחות ואן דר ואלס (Van der Waals, מדען הולנדי, 1873) קובעים את האינטראקציה בין המולקולות. הם כוללים
דיפול, דיפול, אינדוקציה ופיזור אינטראקציות.
דיפול דיפולמתרחשת אינטראקציה בין הקטבים המנוגדים של הדיפולות הקבועות. אינדוקציהאינטראקציה מתרחשת בין dipoles ומולקולות שאינן קוטביות. דיפול פועל על מולקולה לא קוטבית שהופך אותו דיפול המושרה (המושרה). אטרקציה מתעוררת בין דיפולות קבועות המושרה, אשר האנרגיה שלהם פרופורציונלי המרחק בין מרכזי המולקולות. האנרגיה של האינטראקציה אינדוקציה מגביר עם הגדלת polarizability של מולקולות (היכולת של מולקולה כדי ליצור דיפול).
פיזוראינטראקציה מתרחשת בין דיפולות מיידיות של מולקולות שאינן קוטביות. בכל מולקולה, מופיעים תנודות של צפיפות החשמל, וכתוצאה מכך מופיעים דיבלים מיידיים, אשר בתורם מעוררים דיפולות מיידיות במולקולות השכנות.
האנרגיה של כל סוגי האינטראקציות הנחשבות היא ביחס הפוך למרחק בין מרכזי המולקולות בתואר השישי.
3.2. קשר מימן
הקשר מימן נובעת כתוצאה אינטראקציה של מימן מקוטב חיובי של מולקולה אחת ואטום מקוטב שלילית של מולקולה אחרת. לדוגמה, ... H + ─F - ... H + ─F - ... אם נוצר קשר מימן בתוך המולקולה, הוא נקרא intramolecular.
כאשר קשרי מימן להתרחש, dimers, trimmers או מבנים פולימר נוצרים. זה מוביל לעלייה צמיגות, קבוע דיאלקטרי, רותחים נקודות ההתכה, חום של התכה ואידוי.
תצורה מרחבית של מולקולות
המבנה המרחבי של המולקולות נקבע על ידי מספר האטומים במולקולה וכיוון הקשרים הכימיים.
מולקולות דיאטומיות (H 2), מולקולות טריאטומיות CaCl 2, C 2 H 2 יש מבנה ליניארי.
למולקולות הטריאטומיות יש מבנה זוויתי (H 2 S, H 2 O); פירמידה (NH 3); משולש שטוח (AlCl 3, BF 3).
מולקולות פוליאטומיות יש תצורות מורכבות יותר - tetrahedral (CH 4), octahedral (SF 6); מחזורית (C 4 H 8, C 6 H 6) ועוד.
פלואוריד מימן
מימן גופרתי
פלואוריד בורון
משימות בקרה
1. באיזה מולקולות הוא הקוטב של הקשר הכימי בטבע: F 2, CO, N 2, HBr?
2. לקבוע את הערכיות של פלואור וזרחן על הקרקע ועל מדינות נרגשות.
3. ציין את מנגנון היווצרות של קשרים כימיים ב מולקולות CO, מים, אמוניום הידרוקסיד, קטיון אמוניום.
4. מהו proazo, מגנזיום כלורי, אלומיניום ברומיד, מימן סלניד, אצטילן, pripen, פנטאן?
5. תן את התצורה האלקטרונית של מולקולות של חמצן, מימן כלורי, על פי שיטת MO.
6. באמצעות השיטה של MS, לקבוע אם היווצרות של יונים
+ 2, לא 2 +, O 2 -.
7. צייר את דיאגרמות האנרגיה של מולקולות חנקן ופלואור על פי שיטת MO.
8. אילו סוגים של כוחות Van der Waals נמצאים במולקולות של מי חמצן, מים, מימן ברומיד, אלכוהול אתילי, מתנאל?
9. אילו פרמטרים תלויים באורך הקשר הכימי?
10. איך האנרגיה האג"ח הכימי של מימן הלידה טווח מימן פלואוריד מימן יודיד?
11. איך האנרגיה של הקשר הכימי בין הפחמן בסדרה: יחיד, כפול, משולש, ארומטי?
7.11. המבנה של חומרים מלוכדים קוולנטית
חומרים שבהם קוולנטיים קיימים רק מכל סוגי הקשרים הכימיים נחלקים לשתי קבוצות לא שוות: מולקולריות (מאוד) ולא מולקולריות (הרבה פחות).
גבישים של חומרים מולקולריים מוצקים מורכבים מכוחות חלשים של אינטראקציה בין-מולקולארית של מולקולות. גבישים כאלה אין כוח גבוה וקשיות (זוכרים קרח או סוכר). נקודות ההיתוך וההרתיחה שלהן נמוכות גם כן (ראה לוח 22).
טבלה 22. התכה ונקודות רתיחה של חומרים מולקולריים מסוימים
חומר |
חומר |
||||
| H 2 | – 259 | – 253 | בר 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H 2 O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C 10 H 8 (נפטלין) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
בניגוד עמיתיהם המולקולריים שלהם, חומרים לא מולקולריים עם קשר קוולנטי טופס גבישים מוצקים מאוד. גבישי יהלומים (המוצק עצמו) שייכים לסוג זה.
בדגמי יהלום (איור 7.5), כל אטום פחמן מחובר לארבעה אטומי פחמן אחרים באמצעות קשרים קוולנטיים פשוטים (sp 3 hybridization). אטומי הפחמן יוצרים מסגרת תלת-ממדית. ביסודו של דבר, כל היהלום הוא מולקולה ענקית וחזקה.
גבישים סיליקון, בשימוש נרחב האלקטרוניקה והאלקטרוניקה, יש את אותו המבנה.
אם אתה מחליף מחצית של אטומי פחמן ביהלום עם אטומי סיליקון מבלי להפריע את מבנה המסגרת של הגביש, אתה מקבל גביש של סיליקון קרביד SiC - גם חומר מוצק מאוד המשמש חומר שוחקים. חול קוורץ רגילים (סיליקה) מתייחס גם זה סוג של חומר גבישי. קוורץ הוא חומר מוצק מאוד; תחת השם "אמרי" הוא משמש גם כחומר שוחקים. המבנה של קוורץ קל להגיע, אם בתוך גביש סיליקון בין כל שני אטומי סיליקון להוסיף אטומי חמצן. במקרה זה, כל אטום סיליקון יהיה מחויב לארבעה אטומי חמצן, וכל אטום חמצן - עם שני אטומי סיליקון.
קריסטלים של יהלום, סיליקון, קוורץ ודומה במבנה נקראים גבישים אטומיים.
גביש אטומי הוא גביש המורכב מאטומים של אלמנט אחד או יותר המקושרים על ידי קשרים כימיים.
הקשר הכימי בגביש אטומי יכול להיות קוולנטי או מתכתי.
כפי שאתה כבר יודע, כל קריסטל אטומי, כמו קריסטל יונית, היא ענקית supermolecule. לא ניתן לרשום את הנוסחה המבנית של "סופר-קולקולה" כזו - אפשר רק להראות את השבר שלה, למשל:

בניגוד לחומרים המולקולריים, חומרים המרכיבים גבישים אטומיים הם בין העקשן ביותר (ראה טבלה 23).
טבלה 23. נקודות התכה ורתיחה של חומרים לא מולקולרייםעם אג"ח קוולנטיות
נקודות התכה גבוהות כאלה מובנות למדי אם נזכור כי ההיתוך של חומרים אלה שובר לא intermolecular חלש, אבל קשרים כימיים חזקים. מאותה סיבה, חומרים רבים המייצרים גבישים אטומיים, כאשר מחומם, לא להמיס, אבל להתפרק או מיד להיכנס למצב אדי (סובלימציה), למשל, גרפיט סובלימטס ב 3700 o C.
| סיליקון - Si. גבישי סיליקון קשיחים וקשים מאוד דומים במראהם למתכתיים, אך הם אינם מתכת. לפי סוג המוליכות החשמלית, החומר הזה שייך למחשבים מוליכים למחצה, הקובעים את ערכו העצום בעולם המודרני. הסיליקון הוא חומר המוליכים למחצה החשוב ביותר. מקלטי רדיו, טלוויזיות, מחשבים, טלפונים מודרניים, שעונים אלקטרוניים, סוללות סולאריות, מכשירים ביתיים ותעשייתיים רבים אחרים מכילים טרנזיסטורים, שבבים ותאי צילום עשויים גבישי סיליקון בעלי טוהר גבוהה, כמו היסודות המבניים החשובים ביותר. סיליקון טכני משמש בייצור של פלדה ב מטלורגיה אל ברזליות. על ידי תכונות כימיות, סיליקון הוא חומר אינרטי למדי, הוא מגיב רק בטמפרטורה גבוהה. דו תחמוצת הסיליקון - SiO 2. שם נוסף עבור חומר זה הוא סיליקה. דו תחמוצת הסיליקון נמצא בטבע בשתי צורות: גבישי ו אמורפי. אבנים יקרות חצי יקרות רבים הם סוגים שונים של דו תחמוצת סיליקון גבישי (קוורץ): סלע רוק, ג 'ספר, chalcedony, אגת. ו אופל הוא צורה אמורפי של סיליקה. קוורץ הוא נפוץ מאוד בטבע, אחרי הכל, דיונות חול במדבריות, גדות חול של נהרות וים - כל זה הוא חול קוורץ. קוורץ הוא חומר גבישי חסר צבע וחומר רפרקטורי. על ידי קשיות הוא נחות יהלום קורונדום, אבל, בכל זאת, הוא משמש באופן נרחב כמו חומר שוחקים. חול קוורץ נעשה שימוש נרחב בענף הבנייה חומרי בניין. זכוכית קוורץ משמש לייצור זכוכית מעבדה ומכשירים מדעיים, כפי שהוא לא סדק עם שינוי פתאומי בטמפרטורה. על פי התכונות הכימיות שלו, דו תחמוצת הסיליקון הוא תחמוצת חומצה, אך הוא מגיב עם אלקליס רק במהלך היתוך. בטמפרטורות גבוהות, סיליקון קרביד - carborundum - מתקבל דו תחמוצת סיליקון גרפיט. Carborundum הוא חומר קשה השני לאחר היהלום, הוא משמש גם לייצור גלגלים שחיקה נייר "emery". |
7.12. הקוטביות של הקשרים הקובליים. Electronegativity
נזכיר כי אטומים מבודדים של אלמנטים שונים יש נטייה שונה הן לתרום ולקבל אלקטרונים. הבדלים אלה נמשכים לאחר היווצרות קשר קוולנטי. כלומר, האטומים של כמה אלמנטים נוטים למשוך לעצמם את זוג האלקטרונים של קשרים קוולנטיים חזק יותר מאשר האטומים של גורמים אחרים.
חשבו על מולקולה HCl.
בדוגמה זו, נראה כיצד להעריך את עקירה של ענן האג"ח אלקטרונים באמצעות אנרגיות יינון טוחנת ואת האמצעים האלקטרון. 1312 kJ / mol, ו 1251 kJ / mol - ההבדל הוא משמעותי, על 5%. 73 kJ / mol, ו 349 kJ / mol - כאן ההבדל הוא הרבה יותר גדול: האנרגיה של זיקה אלקטרונים של אטום כלור הוא כמעט פי חמישה יותר מזה של אטום מימן. מכאן אנו יכולים להסיק כי זוג אלקטרונים של הקשר קוולנטי ב מולקולת מימן כלורי הוא השתנה במידה רבה לעבר אטום כלור. במילים אחרות, אלקטרונים מחייב לבלות יותר זמן ליד אטום כלור מאשר ליד אטום המימן. התפלגות לא אחידה של צפיפות האלקטרונים מובילה לחלוקה מחדש של המטענים החשמליים בתוך המולקולה. על אטום המימן - חיובי, ועל אטום כלור - שלילי.
במקרה זה, הוא אמר כי הקשר הוא מקוטב, ואת הקשר עצמו נקרא קשר קוולנטי קוטבי.
אם זוג האלקטרון של הקשר הקווולנטי אינו מועבר לאף אחד מהאטומים המחוברים, כלומר, האלקטרונים המחוברים שייכים באותה מידה לאטומים המחוברים, אז הקשר הזה נקרא קשר קוולנטי שאינו קוטבי.
המושג "תשלום פורמלי" במקרה של קשרים קוולנטיים חל גם. רק בהגדרה לא נדבר על יונים, אלא על אטומים. ככלל, ניתן לתת את ההגדרה הבאה.
במולקולות שקשרי הקשרים שלהם נוצרים רק על ידי מנגנון החליפין, ההאשמות הפורמליות של האטומים הן אפס. לפיכך, במולקולה HCl, את המטען הרשמי על האטומים של כלור ומימן הן אפס. כתוצאה מכך, במולקולה זו, החיובים האמיתיים (האפקטיביים) על אטומי הכלור והמימן שווים לחיובים החלקיים (העודפים).
זה רחוק מלהיות תמיד את הסימן של תשלום חלקי על אטום של אלמנט זה או אחר במולקולה נקבעת בקלות מן האנרגיות טוחנת של יינון זיקה אלקטרודה; בדרך כלל למטרות אלה הם משתמשים באנרגיה אחרת המאפיינת את האטום - electronegativity.
בשלב זה אין סימון יחיד, מקובל עבור electronegativity. זה יכול להיות מסומן על ידי האותיות E / O. כמו כן, אין שיטה אחת, מקובלת לחישוב electronegativity. באופן פשטני, זה יכול להיות מיוצג כחצי סכום של האנרגיות יינון טוחנת ואת זיקה האלקטרון - זה היה אחת הדרכים הראשונות לחשב את זה.
ערכים מוחלטים של electronegativities של אטומים של אלמנטים שונים משמשים לעתים רחוקות מאוד. לעתים קרובות להשתמש electronegativity יחסית, מסומן על ידי האות ג. בתחילה, ערך זה נקבע כיחס של electronegativity של אטום של אלמנט נתון electronegativity של אטום ליתיום. בעתיד, שיטות החישוב שלה השתנו במקצת.
Electronegativity יחסית היא כמות ללא מימדים. ערכיה מובאים בנספח 10.
מאחר שהאלקטרוניגטיביות היחסית תלויה בעיקר באנרגיית היינון של האטום (האנרגיה הזיקה של האלקטרונים היא תמיד הרבה פחות), במערכת של יסודות כימיים היא משתנה בערך כמו האנרגיה היוניזציה, כלומר, עולה באלכסון מ צסיום (0.86) (4.10). לערכים של electronegativity יחסית של הליום ניאון נתון בטבלה אין משמעות מעשית, שכן אלמנטים אלה לא יוצרים תרכובות.
באמצעות טבלה electronegativity, ניתן בקלות לקבוע אילו משני האטומים האלקטרונים המחברים אטומים אלה, וכתוצאה מכך, את הסימנים של החיובים החלקיים הנובעים על אטומים אלה הם עקורים.
| H 2 O | תקשורת פולארית | |||
| H 2 | האטומים זהים | H - H | תקשורת לא פולארית | |
| CO 2 | תקשורת פולארית | |||
| Cl 2 | האטומים זהים | Cl - Cl | תקשורת לא פולארית | |
| H 2 S | תקשורת פולארית |
לכן, במקרה של היווצרות קשר קוולנטי בין אטומים של אלמנטים שונים, קשר כזה יהיה תמיד קוטבי, ובמקרה של יצירת קשר קוולנטי בין אטומים של אלמנט אחד (בחומרים פשוטים) הקשר הוא ברוב המקרים שאינו קוטבי.
ככל שההפרש בין האלקטרונים של האטומים קשור יותר, כך הקוטב יותר הוא הקשר הקווולנטי בין אטומים אלה.
| מימן גופרתי H 2 S - גז חסר צבע עם ריח אופייני ביצים רקובות; רעיל זה יציב יציב, מתפרק כאשר מחומם. מימן גופרתי הוא מסיס במקצת במים, הפתרון המימי שלו נקרא חומצה מימן גופרתי. מימן גופרתי provokes (catalzes) קורוזיה מתכת, זה גז זה "אשם" של כסף כהה. בטבע, הוא נמצא במים מינרליים מסוימים. בתהליך החיים הוא נוצר על ידי כמה חיידקים. מימן גופרתי מזיק לכל היצורים החיים. שכבת המימן גופרתי נמצא במעמקי הים השחור ומעורר חששות למדענים: חיי החיים הימיים נמצאים תחת איום מתמיד. |
חיבור קוולרי של פולאר, חיבור לא קונבנציונאלי של נונולר, אחריות חשמלית מוחלטת, חשמליות יחסית.
1. ניסויים וחישובים לאחר מכן הראו כי החיוב האפקטיבי של סיליקון ב tetrafluoride סיליקון הוא +1.64 e, ו קסנון ב hexonluoride קסנון הוא 2.3 E. קביעת הערכים של חיובים חלקיים על אטומי פלואור אלה תרכובות. 2. כתוב את הנוסחאות המבניות של החומרים הבאים, תוך שימוש בסמלים "" ו- "", תאר את הקוטביות של הקשרים הקוולנטיים במולקולות של תרכובות אלה: א) CH 4, CCl 4, SiCl 4; ב) H 2 O, H 2 S, H 2 Se, H 2 Te; ג) NH 3, NF 3, NCl 3; ד) SO 2, Cl 2 O, OF 2.
3. שימוש בטבלה electronegativity, לציין באיזה מן התרכובות הקשר הוא יותר קוטבי: א) CCl 4 או SiCl 4; ב) H 2 S או H 2 O; ג) NF 3 או NCl 3; ד) Cl 2 O או OF 2.
7.13. מנגנון מקבל התורם ליצירת תקשורת
בפסקאות הקודמות, אתה הציג בפירוט שני סוגים של מליטה: יונית קוולנטית. נזכיר כי קשר יוני נוצר כאשר העברה מלאה של אלקטרון מאטום אחד למשנהו. Covalent - ב socialization של אלקטרונים unaired אטומים כבול.
בנוסף, יש מנגנון נוסף להיווצרות של תקשורת. שקול את זה על הדוגמה של האינטראקציה של מולקולת אמוניה עם מולקולת בורון trifluoride:


כתוצאה מכך, גם בין קוולנטים וקשרים יוניים בין אטומי חנקן לבין בורון. במקרה זה, אטום החנקן הוא התורםזוג אלקטרון ("נותן" את זה כדי ליצור קשר), וכן אטום בורון acceptor("מקבלת" את זה בהיווצרות של תקשורת). מכאן ואת השם של מנגנון היווצרות של תקשורת כזו - " התורם-המקבל ".
כאשר האג"ח נוצרת על ידי מנגנון התורם - acceptor, הקשר הקווולנטי והקשר היוני נוצרים בו זמנית.
כמובן, לאחר היווצרות של הקשר, בשל ההבדל electronegativity של האטומים מחויב, קיטוב של הקשר מתרחשת, חיובים חלקיים מופיעים, הפחתת חיובי (אמיתי) של אטומים.

שקול דוגמאות אחרות.
אם יש מולקולה חזקה של מימן כלוריד קוטבי ליד מולקולת האמוניה, שבה יש תשלום חלקי משמעותי על אטום המימן, אז אטום המימן ישמש כמו acceptor זוג אלקטרונים. 1 שלו s-AAO, אם כי לא לגמרי ריק, כמו אטום בורון בדוגמה הקודמת, אבל צפיפות האלקטרונים בענן של אורביטלים זה מופחת באופן משמעותי.

המבנה המרחבי של קטיון וכתוצאה מכך, יון אמוניום NH 4, כמו המבנה של מולקולת מתאן, כלומר, כל ארבעת N - H אג"ח זהים בדיוק.
היווצרות של קריסטלים אמוניום יוניים כלוריד של NH 4 Cl ניתן לראות על ידי ערבוב גז אמוניה עם מימן כלורי גזי:
NH 3 (g) + HCl (g) = NH 4 Cl (cr)
התורם של זוג אלקטרונים יכול להיות לא רק אטום חנקן. זה יכול להיות, למשל, אטום חמצן של מולקולת מים. מולקולת המים תהיה אינטראקציה עם אותו מימן כלורי כדלקמן:
Cation וכתוצאה מכך H 3 O נקרא יון אוקסיוםו, כפי שתגלה בקרוב, עושה הבדל עצום בכימיה.
לסיכום, אנו רואים את המבנה האלקטרוני של פחמן חד חמצני (חד תחמוצת הפחמן) CO:

בה, למעט שלושה קשרים קוולנטיים (קשר משולש), יש גם קשר יוני.
תנאים ליצירת תקשורת על ידי מנגנון התורם-מקבל:
1) נוכחות של אחד האטומים של זוג בודד של אלקטרונים valence;
2) נוכחות של אטום חופשי באטום השני על valence sublevel.
התורם - מנגנון הקבלה של יצירת קשרים הוא די נפוץ. במיוחד לעתים קרובות היא מתרחשת היווצרות של תרכובות דאלמנטים. אטומים של כמעט כולם דאלמנטים יש אורביטלים רבים valence חינם. לכן, הם מקבלים פעילים של זוגות אלקטרונים.
מנגנון מכניטור DONOR-MECANISM של פורמט BOND, יון אמוניום, אוקסוני יון, תנאי מכניזם מכני.
1. הפוך את המשוואות של התגובות ואת ערכת החינוך
א) אמוניום ברומיד NH 4 Br מאמוניה ומימן ברומיד;
ב) אמוניום גופרתי (NH 4) 2 SO 4 מאמוניה וחומצה גופרתית.
2. לחבר את משוואות התגובה ותוכניות האינטראקציה של א) מים עם מימן ברומיד; ב) מים עם חומצה גופרתית.
3. אילו אטומים בארבעת התגובות הקודמות הם תורמים של צמד האלקטרון, ואילו מקבלים? למה התשובה מוסברת על ידי דיאגרמות של sublevels valence.
4. נוסחה מבנית של חומצה חנקתית, הזוויות בין אג"ח O - N - O הן קרוב ל - 120 o. הגדר:
א) סוג הכלאה של אטום החנקן;
b) אשר AO של אטום חנקן לוקח חלק ביצירת אג"ח;
ג) אשר AO של אטום חנקן משתתף ביצירת אג"ח על ידי מנגנון התורם - acceptor.
מה לדעתך הזווית בין האג"ח H - O - N במולקולה זו שווה בערך ל? 5. לחבר את הנוסחה המבנית של יון CNan צ 'ינגד (תשלום שלילי - על אטום פחמן). זה ידוע כי ציאנידים (תרכובות המכילות יון כזה) ו פחמן חד חמצני CO הם רעלים חזקים, ואת הפעולה הביולוגית שלהם הוא קרוב מאוד. הצע את ההסבר שלך על הקרבה של הפעולה הביולוגית שלהם.
7.14. אג"ח מתכת. מתכות
קשר קוולנטי נוצר בין אטומים קרובים הנטייה שלהם נרתעת ואת ההתקשרות של אלקטרונים רק כאשר הגדלים של האטומים להיות מחויב הם קטנים. במקרה זה, צפיפות האלקטרונים באזור החפיפה של ענני האלקטרון היא משמעותית, והאטומים קשורים היטב, כמו למשל במולקולת HF. אם לפחות אחד האטומים מלוכדות יש רדיוס גדול, היווצרות הקשר קוולנטי הופך פחות מועיל, שכן צפיפות האלקטרונים באזור החפיפה של עננים אלקטרונים של אטומים גדולים הוא הרבה פחות מזה של קטנים. דוגמה למולקולה כזו עם קשר פחות חזק היא מולקולת ה- HI (באמצעות טבלה 21, השווה את האנרגיות של אטומיזציה של מולקולות HF ו- HI).
ובכל זאת בין אטומים גדולים ( ייצור o\u003e 1.1) נוצר קשר כימי, אבל במקרה זה הוא נוצר על ידי חיברות של כל (או חלק) של אלקטרונים הערכיות של כל האטומים הקשורים. לדוגמה, במקרה של אטומי נתרן, כל 3 s- אלקטרונים של אטומים אלה, ובכך יוצרים ענן אלקטרונים יחיד:

אטומים יוצרים גביש עם מתכת חיבור.
אז שני האטומים של אלמנט אחד, ואת האטומים של אלמנטים שונים יכולים לתקשר אחד עם השני. במקרה הראשון, חומרים פשוטים נוצרים, נקרא מתכות, ובחומר השני - מורכב, נקרא תרכובות intermetallic.
מכל החומרים עם קשר מתכתי בין אטומים בבית ספר, אתה רק לייצר מתכות. מהו המבנה המרחבי של מתכות? קריסטל מתכתי מורכב גרעיני גרעינישנותרו לאחר סוציאליזציה של אלקטרונים הערכיות, ואת ענן האלקטרון של אלקטרונים חברתיים. שלדים אטומיים בדרך כלל מהווים את האריזה הכי צפופה, וענן האלקטרון תופס את כל נפח חופשי הנותר של הגביש.
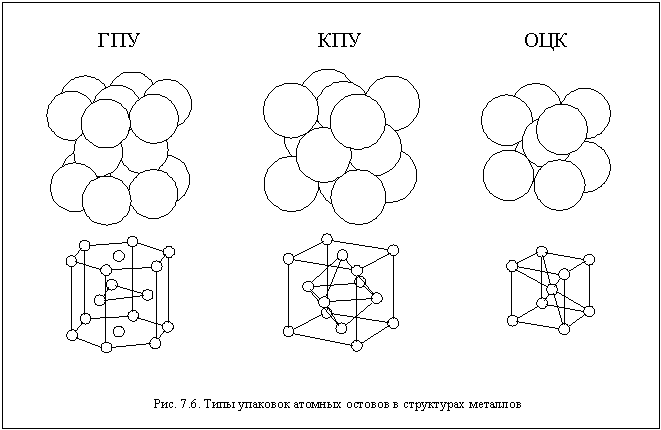
הסוגים העיקריים של חבילות הקרוב ביותר הם האריזה הקרובה ביותר (KPU) ו האריזה הקרובה ביותר(GPU). שמות החבילות הללו קשורים לסימטריה של הגבישים בהם הם מתממשים. כמה מתכות בצורת גבישים ארוזים ברפיון - גוף מעוקב מעוקב(עותק מוסתר). דגמים נפחיים ונושאי כדורים של חבילות אלה מוצגים באיור 7.6.
Cu, אל, Pb, Au וכמה אלמנטים אחרים בצורת מעוקב האריזה הקרובה ביותר. האריזה הקרובה ביותר - אטומים להיות, Zn, CD, Sc ועוד כמה. האריזה הממוקדת על הגוף של האטומים נמצאת בגבישים של מתכות אלקליות, אלמנטים של קבוצות VB ו- VIB. מתכות מסוימות בטמפרטורות שונות עשויות להיות מבנה שונה. הסיבות הבדלים כאלה תכונות מבניות של מתכות עדיין לא הבינו לחלוטין.
כאשר ההיתוך, גבישי מתכת הופכים נוזלים מתכתיים. סוג הקשר הכימי בין האטומים אינו משתנה.
קשר מתכתי אין כיוון כיווניות. מבחינה זו, הוא דומה לקשר היוני.
במקרה של תרכובות intermetallic, אפשר לדבר על polarizability של הקשר המתכתי.
מאפיינים פיזיים אופייניים של מתכות:
1) מוליכות חשמלית גבוהה;
2) מוליכות תרמית גבוהה;
3) משיכות גבוהה.
נקודות ההיתוך של מתכות שונות שונות מאוד זו מזו: נקודת ההיתוך הנמוכה ביותר עבור כספית (39 מעלות צלסיוס), והשנייה הגבוהה ביותר עבור טונגסטן (3410 o).
| בריליום - אפור בהיר הוא די קשה למדי, אבל בדרך כלל מתכת שבירה. נקודת התכה 1287 o C. באוויר, הוא מכוסה בסרט תחמוצת. בריליום הוא מתכת נדירה למדי, אורגניזמים חיים בתהליך האבולוציה שלהם כמעט לא בא במגע עם זה, ולכן אין זה מפתיע שזה רעיל בעולם החי. הוא משמש בטכנולוגיה גרעינית. Zn Zn הוא מתכת רכה, לבן עם גוון כחלחל. נקודת ההיתוך היא 420 o C. באוויר ובמים הוא מכוסה בסרט דק צפוף של תחמוצת אבץ, אשר מונע חמצון נוסף. בייצור זה משמש מגולוון של סדינים, צינורות, תיל, הגנה על ברזל מפני קורוזיה. Wolfram W. זהו עקשן ביותר של כל המתכות: נקודת ההתכה של טונגסטן הוא 3387 o C. בדרך כלל טונגסטן הוא שביר למדי, אבל לאחר ניקוי יסודי זה הופך פלסטיק, אשר מאפשר לך למשוך ממנו חוט דק, שממנו אתה עושה חוטים של נורות חשמליות. עם זאת, רוב טונגסטן וכתוצאה מכך הולך לייצר קשה ללבוש סגסוגות עמיד שיכול לשמור על תכונות אלה כאשר מחומם אפילו 1000 o C. |
מתכת, חיבור אינטרמטליות, חיבור מתכת, אריזה בצפיפות.
1. כדי לאפיין חבילות שונות, המושג "גורם מילוי של החלל" משמש, כלומר, היחס בין נפח האטומים לנפח של גביש
שם אשר aנפח אטום
Z הוא מספר האטומים בתא היחידה,
V- נפח תא היחידה.
אטומים במקרה זה מיוצגים על ידי כדורים קשים של רדיוס Rבמגע אחד עם השני. נפח בול אשר w = (4/3) R 3 .
קבע את גורם המילוי של המרחב עבור המעבד ו- BCC.
2. שימוש בערכים של רדיאלי מתכתי (נספח 9), לחשב את גודל התא היחידה של א) נחושת (KPU), ב) אלומיניום (KPU), ג) צסיום (BCC).
כאשר אטומים אינטראקציה, ערכי electronegativity אשר שונים, אבל לא באופן דרמטי, זוג אלקטרון משותף מועבר אטום electronegative יותר. זהו הסוג הנפוץ ביותר של קשר כימי, אשר נמצא בשני תרכובות אורגניות אורגניות. הקשרים קוולנטיים קשורים באופן מלא לאותם קשרים שנוצרו על ידי מנגנון התורם- acceptor. היווצרות של יון אמוניום על ידי התורם- acceptor מנגנון.
9 שיטה של אג"ח שוויון.
השיטה של קשרים שוויון שימש לראשונה בשנת 1927 על ידי המדענים הגרמנים V. גיטלר ו F. לונדון, שביצעו חישוב קוונטי מכני של אטום מימן. בשיטת BC יש להניח כי האטומים במולקולה שומרים על האינדיבידואליות שלהם. זוג האלקטרונים מאכלס את מסלולו של אטום אחד או אחר. Geitler ולונדון הראו שכאשר שני אטומי מימן מתקרבים זה לזה עם ספינים מקבילים, האנרגיה של המערכת יורדת, הנגרמת על ידי גידול בצפיפות האלקטרונים במרחב שבין גרעיני האטומים הפועלים. עם הגישה של אטומים עם ספינים מקבילים, האנרגיה של המערכת עולה והמולקולה במקרה זה לא נוצר. השיטה BC מבוסס על העקרונות הבסיסיים הבאים: 1) קשר כימי בין שני אטומים מתרחשת כתוצאה AO חופפים עם היווצרות של זוגות אלקטרונים. 2) אטומים נכנסים לחילופי אג"ח כימיים בין האלקטרונים בינם לבין עצמם, אשר יוצרים זוגות מחייב. רק אלקטרונים שאינם אטומים של אטומים יכולים להשתתף בהיווצרות זוגות אלקטרון נפוצים. האנרגיה של חילופי אלקטרונים בין האטומים עושה את התרומה העיקרית לאנרגיה האג"ח הכימי. כוחות קולומב של אינטראקציה של חלקיקים נותנים תרומה נוספת. 3) על פי העקרון פאולי, קשר כימי נוצר רק כאשר האלקטרונים אינטראקציה עם ספינים antiparallel. 4) מאפייני האג"ח הכימי נקבעים לפי סוג החפיפה של AO
התלות של האנרגיה המחייבת בין מולקולות על המרחק
10 Valence – את היכולת של האטום ליצור קשרים כימיים. מדד הערכיות הוא מספר הקשרים הכימיים. יכולות הערכיות של אטום נקבעות על ידי מספר האלקטרונים הלא מזוהים (valence) על השכבה החיצונית ומספר האג"ח שניתן ליצור באמצעות מנגנון התורם-המקבל. מצב חמצון - מטען מותנה של אטום במולקולה, מחושב על סמך ההנחה שכל הקשרים הם יוניים. משמעות הדבר היא כי אטום electronegative יותר, הרחקת זוג אלקטרון אחד לעצמו, רוכש תשלום -1, שני זוגות אלקטרון - תשלום -2. הקשר בין האטומים אותו אינו תורם למצב החמצון. לפיכך, הקשר בין אטומי C - C תואם את מידת האפס של החמצון שלהם. ב C-H הקשר, פחמן, כמו אטום electronegative יותר, מתאים תשלום של -1, ב C - O הקשר, את החיוב של פחמן (פחות electronegative) הוא 1. דרגת החמצון של אטום במולקולה מחושבת כסכום האלגברי של המטענים הנותנים את כל הקשרים של אטום נתון, ולכן במולקולה של 3 CH, שלוש איגרות C-H מעניקות טעינה כוללת על אטום C השווה ל -3, והקשר C-Cl הוא חיוב 1. לכן, מידת החמצון של אטום הפחמן במתחם זה שווה ל:
במצב הנרגש, העומס של האטומים גדל. זאת בשל התופעה של אידוי ו ( המעבר אל האורביטלים החופשיים) של השכבות החיצוניות.
11 .
קשר כימי - אינטראקציה interatomic עקב חפיפה של פגזי האלקטרונים החיצוניים של אטומים מלווה בירידה באנרגיה הכוללת של המערכת המתקבלת. קשר כימי יכול להיווצר על ידי מתן אחד או כמה אלקטרונים לא מזויפים מכל אטום (אג"ח מרובות) כדי ליצור זוגות אלקטרונים (קשר קוולנטי), או אם אחד האטום של זוג אלקטרונים שולט, ואת האטום השני יש חלל אלקטרונים ריק (הקשר התורם- acceptor). היווצרות הקשר הכימי כוללת רק את האלקטרונים של קליפת האלקטרון החיצונית, ורמות האלקטרון הפנימיות אינן מושפעות. כתוצאה מכך, כאשר נוצר קשר כימי, כל אטום יוצר קליפת אלקטרונים מלאה של רמת האלקטרון החיצונית, המורכבת משני אלקטרונים (כפול) או שמונה (octet). מליטה כימית מאופיינת באורך ובאנרגיה. אורך הקשר הכימי הוא המרחק בין גרעיני האטומים המחוברים. האנרגיה של קשר כימי מראה כמה יש צורך להוציא אנרגיה על דילול של שני אטומים, שביניהם יש קשר כימי, למרחק שבו נשבר הקשר הכימי הזה. הסוג העיקרי של קשרים כימיים הם קוולנטיים, יוניים, מימן, מתכתיים.
בונד הרוויהמספק הרכב קבוע של מולקולות ומגדיר את מושג הערכיות. אם לאטום יש אלקטרונים לא מסודרים, אז אטום זה יכול ליצור קשרים כימיים עם אטומים אחרים שיש להם אלקטרונים לא מזוהים. לכן, הערכיות של אלמנט שווה למספר אלקטרונים לא מזויפים באטום או מספר הקשרים קוולנטיים שנוצר. ההפרשה על רוויה נגזר העיקרון פאולי ופירוש הדבר כי כל אלקטרון יכול להשתתף בהקמה של קשר קוולנטי אחד בלבד. קוטביות של קשר כימי - המאפיין של קשר כימי, המראה את השינוי בהתפלגות צפיפות האלקטרונים בחלל סביב הגרעינים בהשוואה להפצת צפיפות האלקטרונים באטומים הנייטרליים המרכיבים את הקשר הנתון.
כמדד כמותי של הקוטביות של הקשר, מה שנקרא חיובי חיובי על האטומים משמשים.
המטען האפקטיבי מוגדר כהפרש בין המטען של אלקטרונים הממוקמים באזור מסוים של חלל ליד הגרעין לבין המטען של הגרעין. עם זאת, למדד זה יש רק משמעות מותנית ומשוערת, שכן אי אפשר לבודד באופן חד-משמעי אזור במולקולה המתייחסת אך ורק לאטום יחיד, ולכמה קשרים לאג"ח מסוים.
נוכחות של מטען יעיל יכולה להיות מסומנת על ידי סמלים תשלום של אטומים (למשל, H + δ - Cl - δ, כאשר δ הוא חלק מסוים של המטען היסודי).
12 קשר מימן.סוג זה של הקשר יכול רק להיות מותנה כימית, וזה נכון יותר להפנות אותו intermolecular ו intramolecular אינטראקציות. קשר מימן מתרחש בין אטום מימן כבול של מולקולה אחת לבין אטום אלקטרו-מכני של מולקולה אחרת. הקשר מימן הוא אלקטרוסטטי באופן חלקי, וגם חלק התורם- acceptor הטבע. דוגמה טובה ליישום קשר כזה היא שילוב של מספר מולקולות מים לאשכולות. במולקולה של מים, אטום חמצן מחליף את צפיפות האלקטרונים כשלעצמו רוכש מטען שלילי חלקי, ומימן, בהתאמה, חיובי באופן חלקי ויכול ליצור אינטראקציה עם זוג האלקטרונים הבודד של המולקולה השכנה. הקשר מימן יכול להתרחש לא רק בין מולקולות שונות, אלא גם בתוך המולקולה עצמה .. אינטראקציה ואן דר ואלס נובעת עקב המראה של רגעים דיפול המושרה. סוג זה של אינטראקציה יכול להתרחש הן בין מולקולות שונות ובתוך אותה מולקולה בין אטומים שכנים בשל התרחשות של רגע דיפול באטומים כמו אלקטרונים לזוז. אינטראקציה ואן דר ואלס יכול להיות אטרקטיבי ודוחה. אינטראקציה intermolecular יש את אופי המשיכה, אינטראקציה intramolecular - דחייה. האינטראמולארה ואן דר ואלס אינטראקציה תורמת תרומה משמעותית לגיאומטריה של המולקולה. היווצרות קשרי מימן בין-מולקולריים מובילה לשינוי משמעותי במאפייני החומרים: גידול צמיגות, קבוע דיאלקטרי, התכה ונקודות רתיחה, חום אידוי והיתוך. לדוגמה מים , מימן פלואוריד ואמוניה יש גבוה באופן חריג נקודות רותח ומסתך. תחת השפעת קשרי מימן, תכונות כימיות גם לשנות. מאז תרכובות רבות מכילים קוולנטיים קוולנטיים H - O ו- H - N אג"ח, קשרי מימן נפוצים מאוד. הם באים לידי ביטוי לא רק במים, אלא גם בחומרים גבישיים שונים, פולימרים, חלבונים, אורגניזמים חיים .. בשל ערכים נמוכים אנרגיה קשרי מימן נהרסים בקלות יחסית ומופיעים שוב. אנרגיה מימן הקשר עולה עם עלייה electronegativity (EO) וירידה בגודל של אטומים B. לכן, קשרי המימן החזק ביותר להתעורר כאשר F, O או N לפעול כמו אטומים B
13-14 תלוי המרחק בין החלקיקים המרכיבים את החומר, ועל הטבע והאנרגיה אינטראקציה בין-מולקולרית (IMB) ביניהן, חומר יכול להיות באחד משלושת המצבים המצטברים: במצב מוצק, נוזלי וגזי.
ב גז מצב האנרגיה של האינטראקציה של חלקיקים זה עם זה הרבה פחות מהאנרגיה הקינטית שלהם:
EIM<< Е кин .
לכן, מולקולות (אטומים) של הגז אינם מוחזקים יחד, אבל לנוע בחופשיות בנפח זה עולה בהרבה על נפח של חלקיקים עצמם. כוחות האינטראקציה הבין-מולקולארית מתרחשים כאשר המולקולות מתקרבות זו לזו במרחק קרוב מספיק. אינטראקציה חלשה בין intermolecular גורם צפיפות גז נמוכה, הרצון להתרחבות בלתי מוגבלת, את היכולת להפעיל לחץ על קירות כלי שימנע את השאיפה. מולקולות הגז נמצאות בתנועה כאוטית אקראית, ואין סדר בגז ביחס למיקום המולקולות.
מצב הגז מאופיין על ידי: טמפרטורה - T, לחץ - p ונפח - V. בלחצים נמוכים וטמפרטורות גבוהות, כל הגזים טיפוסי מתנהגים באותה מידה. אבל כבר בטמפרטורות רגילות, ובמיוחד בטמפרטורות נמוכות ובלחצים גבוהים, האינדיבידואליות של הגזים מתחילים להתבטא. עלייה בלחץ חיצוני וירידה בטמפרטורה מקרבים את חלקיקי הגז, כך שהאינטראקציה הבין-מולקולרית מתחילה להתבטא במידה רבה יותר. עבור גזים כאלה, המשוואה מנדלייב - Clpeyron כבר לא יכול להיות מיושם, אבל המשוואה Van der Waals צריך להיות מיושם:
![]()
כאשר a ו- b הם מונחים קבועים, תוך התחשבות בנוכחות כוחות אטרקטיביים בין מולקולות ונפח המולקולות שלהם בהתאמה, כאשר גזים דחוסים, כאשר יש עלייה משמעותית בצפיפות שלהם, הכוח IIM להיות מוחשי יותר, אשר מוביל ליצירת תנאים להיווצרות של שותפים שונים של מולקולות. מקורביו הם קבוצות לא יציבות יחסית של מולקולות. מאופי המרכיבים IIM מכאן עולה כי יחסי הגומלין האוניברסליים גדלים עם הגדלת גודל האטום (הקיטוב עולה באופן חד, ולכן החלקיקים הכבדים מאותו סוג (אטומים או מולקולות) חשובים, ככל שמידת הקשר שלהם בטמפרטורה נתונה, הטמפרטורות הנמוכות יותר, כגון חומר, עובר מגז לנוזל .
ב נוזלים כוחות IIM עולים בקנה אחד עם האנרגיה הקינטית של תנועה מולקולארית:
E EIM "E Kin.
לכן, נוזל יש את הנכס - יכולת זרימה לוקח את צורת כלי השיט שבו הוא ממוקם. הייחודיות של מבנה הנוזל היא זו אין הרבה, אבל יש סידור קצר טווח של מולקולות . הביטוי של סדר הטווח הקצר הוא שהמולקולות הנמצאות במרחב הראשון של הסביבה של מולקולה נתונה נשמרות סביבן יותר, ולכן קובעות סדר מסוים. עם זאת, בנוזלים אפילו סדר גדול יותר עם אלמנט לטווח ארוך יכול להופיע. זה קורה כאשר הכוחות האוניברסליים של ה- IIM מתווספים על ידי הכוחות הספציפיים של ה- IIM (קשר מימן)
עבור מוצק קובע כי יחס האנרגיות הוא הוגן:
E EIM\u003e E Kin.
מצב מוצק של החומר מתרחשת בעיקר בצורת גבישים. הגבישים מורכבים מחלקיקים (אטומים, מולקולות, יונים) של חומר, אשר מכוונים במיוחד ביחס זה לזה. טבעו של כיוון זה הוא כזה שהחומרים רחוקים מספיק מהחלקיק הנבחר נמצאים בעמדה מוגדרת לחלוטין ובמרחק קבוע. נכס זה נקרא שיש סדר ארוך בגבישים. צורות הגבישים עשויות להיות שונות.
15 תכונה אופיינית של המדינה הגבישית היא נוכחות של מערכות של חלקיקים מסודרים בקפידהאשר נקרא סריג קריסטל. את קריסטל הסריג ניתן להשיג על ידי תזוזה מסוימת (תרגום) בחלל של קבוצה קטנה של חלקיקים, הנקרא תא יחידה.
תכונות הגבישים הן: דרגה גבוהה של סדר (נוכחות של סדר קרוב ורחוק), סימטריה מסוימת של תאי היחידה שנוצרו על ידם, וכתוצאה מכך אנאיזוטרופיה (כלומר, תלות בכיוון).
תלוי איזה חלקיקים שוכבים באתרי הסריג, יש יוניים, אטומיים, מולקולרית, מתכת סריגים.
Ion סריג מורכב יונים של סימן הפוך, לסירוגין בצמתים. באותו הזמן, יונים יכול להיות פשוט (Na +, Cl - ..) ומורכב (NH 4 +, NO 3 - ...). בשל העובדה כי הקשר היוני אינו רווי ולא כיווני, הסריג היוני מאופיין גבוה מספרי תיאום (q.ch. = 6.8). מספר תיאום - מספר החלקיקים הקרובים ביותר הנבחרים . בשל חוזק גבוה של הקשר היוני, סריגי קריסטל יוניים חזקים, גבישים שלהם יש נקודות התכה גבוהה. דוגמאות של תרכובות עם סריגים קריסטל יוניים: NaCl, NH 4 NO 3, וכו '
סריג אטומי מורכב מאטומים המחוברים על ידי קשרים קוולנטיים, למשל, ביהלומים, גרפיט. מספרי הקואורדינציה כאן נקבעים על ידי מספר האג"ח של האטום המרכזי עם הסובבים אותו ואינם מגיעים לערכים גדולים (לעיתים קרובות בסביבות 4). בשל חוזק גבוה של הקשר קוולנטי, סריגים כאלה חזקים מאוד, החומרים מאופיינים נקודות ההתכה גבוהה. היהלום ידוע כחומר הטבעי הקשה ביותר.
סריג מולקולרית מכיל את הצמתים של מולקולות כי הם מחוברים עקב כוחות intermolecular. סריגים מולקולריים הם כוח נמוך, וחומרים עם סריגים כאלה (מוצק H 2, O 2, N 2, CO 2, H 2 O) בדרך כלל יש נקודות נמוכות נמוכות.
גריל מתכת זה יכול להיות מותנה מותנה כמו יונים טעונה חיובי ממוקם הצמתים, ואלקטרונים נעים בין interstices. מספר התיאום כאן מגיע לערכים גדולים (8-12). כוחו של הסריג מתכת משתנה באופן נרחב תלוי מאוד בנוכחות של זיהומים זרים. יש קשר כימי מתכות קרא אג"ח מתכת. באופן עקרוני הקשר המתכתי הוא סוג מיוחד של קשר קוולנטי. זה קורה כתוצאה של "המונית" חפיפה של עננים חיצוניים (valence) אלקטרונים של אטומי מתכת..
16
אחד המאפיינים החיוניים ביותר של האטומים של האלמנטים, אשר קובעים אם הקשר ביניהם הוא יונית או קוולנטית, הוא Electronegativity
כלומר היכולת של אטומים במתחם למשוך אלקטרונים לעצמו. הערכה כמותית מותנה של electronegativity נותן את קנה המידה של electronegativity יחסית. בתקופות יש מגמה כללית של צמיחה של electronegativity של אלמנטים, ובקבוצות - הנפילה שלהם. האלמנטים של electronegativity מסודרים בשורה, על בסיס אשר ניתן להשוות את electronegativity של רכיבים הממוקמים בתקופות שונות. סוג של קשר כימי תלוי כמה גדול ההבדל בין electronegativities של האטומים המחברים של האלמנטים הוא. ככל שלילית יותר של אטומים של היסודות המרכיבים את הקשר, הקוטב יותר הקשר הכימי. לעשות הבחנה חדה בין סוגים.
מליטה כימית היא בלתי אפשרית. ברוב התרכובות, סוג הקשר הכימי הוא ביניים; למשל, קוולנטית מאוד קוטבית
קשר כימי הוא קרוב ל קשר יוני. תלוי באיזה מן המקרים המגבילים הקשר הכימי קרוב יותר מטבעו, הוא מופנה גם ליוני או לקשר הקוטבנטי הקוולנטי. קשר יוני
הוא מקרה קיצוני של קשר קוולנטי מקוטב, שבו זוג האלקטרונים כולו שייך לחלוטין לאחד האטומים. במקרה זה, אחד האטומים מיושם חיוב חיובי לחלוטין, והשני - שלילי לחלוטין. סוג זה של הקשר הוא אופייני של מלחים. לדוגמה, נתרן כלורי - NaCl. כל אחד האטומים מספק אלקטרון אחד כדי ליצור זוג אלקטרונים משותף. עם זאת, Cl מוחקת לחלוטין את זוג האלקטרונים שנוצר לעצמו ובכך רוכשת מטען שלילי מלא, ולנא, שאין לו אלקטרון יחיד במקרה כזה, יש חיוב חיובי מלא. ההבדלים החשובים ביותר בין קשרים יוניים וסוגים אחרים של קשרים כימיים הם ללא כיווניות ו אי-נוחות. זו הסיבה גבישים נוצר על ידי מליטה יונית, על חבילות צפוף שונים של יונים המתאימים.
17 מבנה מרחבי של מולקולות תלוי באופי הקשר הכימי המתרחש בין האטומים, ולכן המבנה של קליפת האלקטרון שלהם. מאחר והאלקטרונים מסוג s, p -, d - ו - f יכולים להשתתף באגודה כימית על כל אחד מאטומי האינטראקציה, מבנה המולקולות תלוי בסוג ומספר האלקטרונים, וכן על האפשרות להיווצרות איגרות חוב היברידיות. לעתים קרובות קשרים כימיים נוצרים על ידי אלקטרונים הממוקמים על אורביטלים אטומיים שונים (לדוגמה, s - ו- p - אורביטלים). למרות זאת, החיבורים שקולים ומסודרים באופן סימטרי, אשר מובטחת הכלאה של אורביטלים אטומיים . הכלאה של אורביטלים היא שינוי בצורת אורביטלים מסוימים במהלך היווצרות קשר קוולנטי על מנת להשיג חפיפה יעילה יותר של אורביטלים, וכתוצאה מהכלאה מופיעים אורביטלים היברידיים חדשים המכוונים בחלל באופן שלאחר החפיפה עם האורביטלים של אטומים אחרים, זוגות האלקטרון המתקבלים רחוקים זה מזה. חבר זה ממזער את האנרגיה של דחייה של אלקטרונים במולקולה.ההכלאה אינה תהליך אמיתי. מושג זה הוא הציג לתאר את המבנה הגיאומטרי של המולקולה. צורתם של חלקיקים הנובעים מהיווצרות קשרים קוולנטיים המערבים אורביטלים אטומיים היברידיים תלויה במספר ובסוגים של אורביטלים אלה. במקרה זה, σ - אג"ח ליצור "שלד" נוקשה של חלקיק:
אורביטלים המעורבים בהכלאה. סוג הכלאה צורה מרחבית של המולקולה דוגמאות
S, P sp - הכלאה לינארית BeCl2
s, p, p sp 2 - הכלאה משולש (מישורי טריגונלי) AlCl 3
s, p, p, p sp 3 - הכלאה Tetrahedral CH 4
אם עננים אלקטרונים חופפים לאורך הקו המחבר את מרכזי האטומים, אז הקשר כזה קוולנטי נקרא סיגמא ( ) מחובר
קשר קוולנטי שנוצר על ידי חפיפה לרוחב עמ 'אורביטלים של אטומי פחמן סמוכים, הנקראים pi ( ) מחובר.













