סוגי קשרים של מולקולות של חומרים. סוגי המולקולות
משרד החקלאות והמדע של אוקראינית
דונצק - האוניברסיטה הטכנית הלאומית למכירות
קורס לייקסי
3 דיסציפלינות
"חומרים אלקטרוטכניים"
(לתלמידי התמחויות 6.090601 - "תחנות חשמל", 6.090602 "מערכות חשמליות ואמצעים", 6.090603 "מערכות חשמל"
הסתכלתי על מיקום המחלקות
תעשייה תעשייתית
ppdpriєmstv ta mest "
פרוטוקול מספר vіd
אושרה על ידי השגרירים
uchbovo-vidavnicho עבור DonNTU
פרוטוקול מספר vіd
דונייצק - DonNTU - 2006
UDC 621.38.002.3 (075.8)
S.V. פלופ הרצאות לקורס "חומרים אלקטרוטכניים". - דונייצק, דונייצק הלאומי האוניברסיטה הטכנית, 2006. - 96 עמ '.
במהלך ההרצאות מוצגות הארוחות העיקריות של המשמעת "חומרים אלקטרוטכניים". נווט לציבור על חשמל, provniki, napivrovitniki מגנטי. מתאר את שאר המדע והטכנולוגיה בחומרי ההנדסה החשמלית ובמדעי החומרים החשמליים, לדוגמה, הטמפרטורה מעל פני השטח, הדרכים החדשות ליצירת חומרים נפיסטקניים טהורים במיוחד
הרצאות המיוחסות לתלמידי התמחויות 6.090601 "תחנות חשמל", 6.090602 "מערכות חשמל ואמצעים", 6.090603 "מערכות חשמל".
Kladadach אגוד. S.V. פלופ
סוקר פרופ. M. בורקובסקי
מידע כללי על ETM
ETM נקראים חומרים בעלי מאפיינים ומאפיינים מסוימים ביחס לשדה האלקטרומגנטי ומשמשים בהנדסת חשמל עם מאפיינים ומאפיינים אלה שנלקחו בחשבון.
מדע החומרים או הטכנולוגיה המולקולרית היא מדע המבנה ותכונות החומרים.
במובן רחב, חומרים חשמליים הם חומרים המשמשים לייצור של מוצרים חשמליים. במובן הצר, חומרים חשמליים הם חומרים בעלי תכונות מיוחדות ביחס לפעולה של שדה אלקטרומגנטי.
חומרים בעלי תכונות עזר והם גם חלש משחק או אין שדה אלקטרומגנטי בכלל נקראים עזר או מבניים.
קריטריונים לשיטתיות של ETM:
1. היקף היישום.
2. הרכב כימי.
3. מצב מצטבר.
4. מבנה.
5. מוצא.
סוגי קשרים של מולקולות
רוב החומרים מכילים אטומים, יונים ומולקולות. הגרעין של אטום מורכב פרוטונים ונייטרונים ויש לו חיוב חיובי. אלקטרונים (ים) (ים) (מסלולית) s, שבו אלקטרונים או אלקטרונים מתגוררים (זה תלוי במספר הרצף של האלמנט הכימי בטבלה המחזורית של די מנדלייב) ממוקמים (הם) סביב הגרעין. גודל האטומים ממוצעים 0.1 ננומטר. אם האטום מאבד חלק מהאלקטרונים, גודלו פוחת והוא הופך ליון חיובי. אם אטום מצרף אלקטרונים לעצמו, הוא הופך ליון טעונה שלילית ומגדיל את גודל.
ישנם ארבעה סוגים של קשרים מולקולריים:
1. אג"ח קוולנטי.
2. יון תקשורת.
3. קשר מתכתי.
4. הקשר המולקולרי (intramolar קוולנטי, ואן דר Waals הקשר).
קשר קוולנטי שנוצרו על ידי סוציאליזציה של אלקטרונים על ידי שני אטומים שכנים. זה ניתן לראות תרכובות כאלה: O 2, H 2, Cl 2, CO (איור 1).
מולקולות שבהן מרכזי באותו גודל של חיובי חיובי ושלילי חופפים נקראים לא קוטבי או ניטרלי.
איור 1 - ייצוג סכמטי של מולקולה דיאטומית עם קשר קוולנטי
![]()

איור 2 - מבנה ואריזה צפופה של יונים כלוריום נתרן (א) ואריזות רופף של צזיום כלורי (ב)
מולקולות, שבהן מרכזי החיובים החיוביים והשליליים אינם חופפים וממוקמים במרחק מה זה מזה, נקראים קוטב או דיפול. הם מתאפיינים ברגע דיפול:
כאשר q הוא החיוב, C;
l - המרחק בין מרכזי החיובים החיוביים והשליליים.
מליטה קוולנטית יכולה להתרחש הן במולקולות (בשלוש מצבים מצטברים) ובין אטומים היוצרים את סריג הגבישים של גביש, למשל, ביהלומים, בגרמניום ובסיליקון. קשר קוולנטי יכול להחזיק לא רק את אותם האטומים.
ג l-C l, C C,
אלא גם שונים
קשר יוני בשל כוחות המשיכה בין יונים חיוביים ושליליים. מוצקים של המבנה היוני מאופיינים בנקודת התכה גבוהה וחוזק מכני מוגבר. אריזות צפופות של יונים יש סריג NaC l, רופף - CsC l (איור 2).
אג"ח מתכתמוביל להיווצרות של גופים גבישיים מוצקים. מתכות יכולות להיחשב כמערכות, באתרי הסריג שבהם יש יונים חיוביים (ליבות חיוביות), ובין האתרים יש אלקטרונים קולקטיביים חופשיים (גז אלקטרונים) (ראה איור 3). כוחות המשיכה בין ליבות חיוביות ואלקטרונים קובעים את מוצקות המתכת, את הערכים הגבוהים של חוזק מכני וטמפרטורת ההתכה. פליטת השכבות האינדיבידואליות של הליבות האטומיות מסבירה את משיכות הטוב של המתכת. הנוכחות של אלקטרונים במתכת מסביר את מוליכות חשמלית גבוהה מוליכות תרמית של המתכת, כמו גם הברק שלה.
קשר מולקולרי (intramolecular קוולנטיים) או אג"ח ואן דר ואלס.
סוג זה של הקשר הוא ציין בכמה חומרים בין מולקולות עם קשרים קוולנטיים intramolecular. במקרה זה, האטרקציה בין המולקולות מוסברת על ידי תנועה מתואמת של האלקטרונים הערכיות בהם. יתר על כן, אלקטרונים אלה הם תמיד רחוק ככל האפשר אחד מהשני קרוב ככל האפשר חיובי חיובי. לכן, כוח המשיכה בין גרעינים ואלקטרונים גדול מכוח הדחייה ההדדית בין האלקטרונים (איור 4). סוג זה של הקשר הוא שביר, יש, למשל, פרפין, אשר יש נקודת התכה נמוכה.
איור 3 - Scheme של המבנה של מתכת
מדריך לירי
איור 4 - סכמטי
תמונה של שני אינטראקציה
מולקולות (הקשר ואן דר ואלס)
טבעו של מליטה כימית.
כדי להבין את אופי הקשר הכימי שגורם להיווצרות של מולקולות מאטומים, כמו גם גבישים, יש צורך לשקול את המודל המכני הקוונטי של האטום לגבי תכונות הגל של אלקטרונים. האינטראקציה של החיובים הקלאסיים מתוארת במלואה על ידי חוק קולום. אינטראקציה חשמלית של אלקטרונים אמיתיים עם תכונות גל לא ניתן לצמצם את אחד קולומב הרגיל.
חשבו על מה שקורה כאשר אטומים מתקרבים זה לזה. ראשית, הוכח באופן ניסיוני כי הכוחות המחזיקים אטומים במולקולות נגרמים על ידי אינטראקציה של אלקטרונים חיצוניים. עם זאת, האלקטרונים של הקונכיות הפנימיות נשארים במצבם הקודם. שנית, פונקציות הגל של אלקטרונים חיצוניים די מהר, אבל בהדרגה ירידה עם המרחק מן הגרעין. כאשר האטומים מתקרבים זה לזה, עננים אלקטרונים מפוזרים של אלקטרונים חופפים חופפים, מה שמוביל סוג מיוחד של אינטראקציה. אינטראקציה זו אין שווה ערך בפיסיקה הקלאסית, עבור חיובים קלאסיים, הבעיה של חדירה הדדית של גופים אינו מתעורר כלל. זה בא לידי ביטוי באזור של חפיפה של עננים אלקטרונים של אטומים בודדים. במצב כזה, אנרגיה נוספת (בנוסף קולום) האנרגיה של האינטראקציה של אלקטרונים, "חילופי אנרגיה", מופיע. יתר על כן, אם ספינים אלקטרונים מקבילים, האנרגיה היא חיובית, ואת האלקטרונים להדוף אחד את השני, מניעת היווצרות של מולקולה. אם ספיני האלקטרון אינם מקבילים, אנרגיית ההחלפה היא שלילית, והאלקטרונים נמשכים ונוטים ליצור קליפה אחת המקיפה את שני הגרעינים. הגרעינים יתקיימו במרחק מסוים בשל כוחות הדחייה של קולומב.
באטומים של הליום, שני אלקטרונים מלאים כדי-שלס יש ספינים מנוגדים, כך שהם לא מתחברים אחד עם השני או עם אטומים אחרים. הליום הוא גז אינרטי. שני אטומי ליתיום יכולים ליצור מולקולה על ידי שילוב אלקטרונים Lשכבה בקונכייה אחת. עם אלקטרונים אלה כדי-כדורים יידחו מאותן סיבות שאטומי הליום דוחים זה את זה. כלומר, רק אלקטרונים אלה שאינם משויכים מאחור יהיו פעילים מבחינה כימית. השילוב החיובי האנרגטי של אלקטרונים עם ספינים מנוגדים מוביל להיווצרות של קשר מולקולרי. יש לציין כי אטומי הליום באופן כללי יכולים ליצור מולקולה, אבל בשביל זה יש צורך כי שני האטומים להיות במצב נרגש - ב הראשון בשכבות השני יהיה אלקטרון אחד לא מזויף כל אחד. מולקולה כזו תהיה בלתי יציבה, מכיוון שאנרגיה של שני אטומים בלתי נלאים תהיה קטנה מאנרגיה של המולקולה.
שקול אטום בריליום ( Z = 4). במצב לא ממוקד, על פי תרשים. 8.2, אין לו אלקטרונים לא מזויפים - מבנה הקליפה השנייה שלו זהה לזה של אטום הליום אטום כימית.
איור. 8.2. תצורה אלקטרונית של אטום בריליום
ביסודו ונרגש
עם זאת, כפי שמוצג ניסיון, אטום בריליום הוא דו ערכי. הוא, כמו אטום הליום, יכול לקבל אלקטרונים ערכיים על עירור. על עירור, אחד האלקטרונים של אטום הליום חייב להעביר את הקליפה הבאה, זה דורש אנרגיה של 20 ~ eV, אשר אינו נחסם על ידי חילופי האנרגיה שפורסמו במהלך היווצרות של המולקולה.
כאשר אטום בריליום נרגש, שני אלקטרונים ערכיים נובעים כתוצאה מהמעבר של אחד מהם s- עמ '(איור 8.2). זה דורש אנרגיה נמוכה, חפיפה חוזרת ונשנית עקב חילופי האנרגיה המשתחררת במהלך היווצרות המולקולה. אם מולקולה נוצר על ידי שילוב אלקטרונים valence לתוך פגז אלקטרונים אחד, זה נפוץ לדבר על קשר כימי קוולנטי. לענן האלקטרונים שנוצר במקרה זה יש סימטריה ביחס לשני האטומים.
סוג אחר של קשר מולקולרי ניתן לראות בדוגמה של מולקולה. נאף. באטום הנתרן, שני פגזים הראשונים הושלמו, על השלישי ( n =3) פגז אחד sהוא אלקטרון שאנרגיה מחייב שלו הוא 5.12 eV. ב אטום פלואור, רק פגז הראשון הושלמה, ועל השני יש 7 אלקטרונים, בעוד ספין אחד אינו רווי. לכן, אטום פלואור יכול בקלות לצרף אלקטרון שמיני, ציור אותו אטום הנתרן, ולהיות יון טעונה שלילית. אטום הנתרן הופך ליון חיובי. סוג זה של הקשר המולקולרי נקרא קשר כימי יוני.
האנרגיה של אינטראקציה החליפין במקרה של מולקולה נאף הוא 4.13 eV - זה פחות מאשר האנרגיה מחייב אלקטרונים באטום הנתרן, ובמבט ראשון, היווצרות של מולקולה זו אינה מועילה אנרגטית. עם זאת, יונים נוצרו של סימנים שונים במרחקים קטנים (על 5Å) יש אנרגיה מחייב של 2.9 eV. לכן, האנרגיה החזקה אטומים במולקולה הוא 4.13 + 2.9 = 7.03 eV, אשר עולה באופן משמעותי את האנרגיה מחייב של אלקטרון באטום (5.12 eV). מחדירה הדדית, היונים מוחזקים על ידי דחיפה של פגזים הושלמה.
הקשר המולקולרי יונית טהורה סוג אינו קיים, מדבר על היחס של יונים וקובאלנס. אבל, אם מולקולה מורכבת מאטומים זהים, זה סוג הקשר קוולנטי טהור.
המולקולה היא מערכת קוונטית, שכן ניתן לכתוב ולפתור את משוואת שרדינגר. המורכבות של המשוואה עולה באופן דרמטי עם עלייה במספר רכיבי המערכת (אלקטרונים וגרעינים).
חשבו על המולקולות הפשוטות ביותר - מולקולת המימן. הוא מורכב משני אלקטרונים ושני פרוטונים (שני גרעינים). האנרגיה הפוטנציאלית של מערכת כזו היא:
 (8.14)
(8.14)
גרעיני יש מסה כ 2000 פעמים את המוני של אלקטרון. לכן, בקירוב הראשון, הגרעינים יכולים להיחשב ללא תנועה. קירוב זה מאפשר, מפשט באופן משמעותי, כדי להפחית את משוואת שרדינגר בצורה הבאה:
 (8.15)
(8.15)
שם U - פוטנציאל האנרגיה (6.1), - מפעיל Laplace המכיל את הקואורדינטות של אלקטרון אחד, ו - מפעיל Laplace המכיל את הקואורדינטות של אלקטרון אחר. אם נניח שתנועת הגרעינים והאלקטרונים אינה תלויה זה בזה, אזי משוואה (8.15) מתפצלת לשתי משוואות עצמאיות, שאחת מהן מתארת את מצב הגרעינים, והשנייה את מצב האלקטרונים.

איור. 8.3. האנרגיה של המולקולה תלויה במרחק שבין האטומים
האנרגיה הכוללת של תנועה ואינטראקציה של אלקטרונים במערכת של שני אטומי מימן מתבססת על המרחק בין גרעיני האטומים. יתר על כן, התלות יש אופי שונה עם הגישה של אטומים עם ספינים מקבילים או מקביל. כאשר הגרעינים מוסרים זה מזה בשני המקרים, קירוב אסימפטוטי של אנרגיית המערכת לערך E 0השווה לסך האנרגיות של שני אטומים. ערך זה שווה לאנרגיה המחייבת של המולקולה, בהתאמה, זו האנרגיה הדרושה להרוס את המולקולה ( אנרגיית דיסוציאציה).
עם הגישה של אטומים, האלקטרונים valence שבו יש ספינים מקבילים, עלייה באנרגיה הכוללת של המערכת של שני אטומים הוא ציין. במקרה זה, רק דחייה הדדית של אטומים אפשרי.
במקרה של התכנסות של אטומים עם ספינים בכיוון אופייני, יש מינימום של אנרגיה, אשר מתאים להיווצרות של מולקולה. מינימום זה נקבע על ידי ההפרש בין סכום האנרגיות של שני אטומים לבין האנרגיה של האינטראקציה שלהם. מרחק R 0 קובע את מרחק שיווי המשקל בין הגרעינים במולקולה עבור תצורה אלקטרונית נתונה. כאשר תצורת אלקטרונים של מולקולה משתנה, למשל, כאשר מולקולה מעבירה למצב נרגש, התלות של אנרגיית האלקטרון על המרחק בין הגרעינים משתנה. U * (r) (איור 8.4). זה בא לידי ביטוי בפרט כי המרחק שיווי המשקל בין גרעיני האטומים המרכיבים את המולקולה משתנה. אנרגיית הדיסוציאציה של המולקולה משתנה אף היא.

איור. 8.4. פוטנציאל הקימורים של המולקולה במצב הקרקע נרגש
שינויים אפשריים באנרגיה של מולקולה נקבעים על ידי שלושה סוגים של תנועה האופיינית למולקולות.
1) כאשר השינויים תצורה אלקטרונית (כלומר, כתוצאה משינוי בחלק היקפי של המולקולה), השינוי הבולט ביותר באנרגיה של המולקולה מתרחשת. חלק זה של אנרגיה נקרא אנרגיה אלקטרונים. ה.
2) עבור תצורת אלקטרונים מסוימת של המולקולה, הגרעין יכול להתנודד יחסית למצב שיווי המשקל.
אתה יכול לקבוע את האנרגיה של תנועה תנודה של גרעינים, הוא quantized, עם תנודות קטנות, שווה ל:
 (υ = 0, 1, 2, ...) (8.16)
(υ = 0, 1, 2, ...) (8.16)
שם ω υ - תדר מתנד קלאסי,
υ – מספר קוונטי מתנדנדשינוי אשר במעברים כפוף לכלל הבחירה: Δ ± = = 1 (8.17)
3) לבסוף, יש צורך לקחת בחשבון כי המולקולה כולה עושה תנועה סיבובית יחסית למרכז המסה. מערכת כזו יש רגע של אינרציה, ואת התנועה שלה ניתן לתאר במהירות זוויתית. dem. במקרה זה, האנרגיה תהיה שווה ל:
 (8.18)
(8.18)
שם אני - רגע האינרציה של המולקולה ביחס לציר העובר במרכז המסה.
Independent 49 - המומנטום הזוויתי של המערכת, אשר יכול גם לקחת רק ערכים נפרדים, שכן המולקולה היא מערכת עם תכונות קוונטיות:
![]() (J = 0, 1, 2, ...) (8.19)
(J = 0, 1, 2, ...) (8.19)
כאן י - כמות קוונטית של מומנטום זוויתי או מספר קוונטי סיבובי - -.
לפיכך, הערך של אנרגיה סיבובית הוא quantized:  (8.20)
(8.20)
מעברי האנרגיה של המולקולה מתרחשים על פי כלל הבחירה עבור מספר הקוואנטים הסיבוביים: (8.21)
לכן, האנרגיה הכוללת של המולקולה שווה ל:
 (8.22)
(8.22)
לכל אחד מהמונחים של האנרגיה הכוללת של כל מולקולה יש סדר גודל מסוים, וקובע את המרחק בין הרמות המקבילות על ערכת האנרגיה של המולקולה. אנרגיה אלקטרונית ה הוא בסדר גודל של מספר eV (1 - 10 eV); אנרגיה רטט - E υ≈ 0.01 - 0.1 eV; אנרגיה סיבובית - Er≈ 10 -5 - 10 -3 eV.
ספקטרום המולקולות, בניגוד לספקטרום הקו של האטומים, הוא סט של להקות המורכבות מקווים אחדים. תלוי איזה סוג של שינויים באנרגיה כאשר פוטון נפלט על ידי מולקולה, ישנם שלושה סוגים של להקות: סיבוב, vibrational-rotational ו-רטט אלקטרוניים.
מעברים אלקטרונים vibrational בספקטרום של מולקולות יש את האנרגיה הגבוהה ביותר (בסדר של מספר eV). רמות האנרגיה האלקטרונית מעורבים במעברים אלה, E "ה ו E "" ה ב איור. 7.5), כמו גם רמות vibrational (למשל υ" 49 ו υ"" = 0 או כל רמות vibrational אחרים, אבל אחד חייב להיות מן sublevels vibrational של המדינה האלקטרונית E "ה, עוד של sublevels vibrational של המדינה האלקטרונית E "" ה). עבור להקות מסוג מתנדנד אלקטרוני, יש קצה חד בצד אחד, הנקרא קצה הרצועה, ואת קצה מטושטש על השני.
להקות המתאימות למעברים סיבוביים vibrational ממוקמים בטווח האנרגיה מ 0.01 eV ל 1.5 eV. במקרה זה, המיקום של הלהקה בספקטרום (כלומר, תדירות או אורך גל או אנרגיה) קובע את רכיב vibrational (אלה יכולים להיות שתי מדינות vibrational υ" = i ו υ" = i± 1 מאותה רמה אלקטרונית). רכיב סיבוב י משתנה ברמה הרטט נתון וקובע את המבנה הדק של הלהקה (כלומר, הנוכחות וההסדר ההדדי של קווים בתוך פס נתון).

איור. 8.5. תרשים האנרגיה של המולקולה
להקות סיבוביות מורכבות מקווים המתאימים למעברים בין מצבי סיבוב בלבד בתוך רמה אחת מתנדנדת. אנרגיית הפוטון, תחת הפעולה של מעברים כאלה אפשריים הוא קטן למדי (כ 0.001 eV), ומכאן הלהקות סיבוב ממוקמים באזור אינפרא אדום רחוק.
הספקטרום של מולקולות הן גם בודדות עבור תרכובות אורגניות ואורגניות שונות, כמו גם הספקטרום של אטומים שונים. הניסיון שנצבר על ידי מדענים-ספקטרוסקופים מאפשר לנו לקבוע את הנוכחות ואף את אחוז החומר הספציפי במדגם מספקטרום הפליטה של מולקולה (או תערובת של מולקולות). מאפיין חשוב של שיטות כאלה הוא סף נמוך של רגישות - אפילו נוכחות של כמות קטנה מאוד של חומר כלשהו זמין עבור המחקר. הוא משמש כיום נרחב לניתוח מומחים במעבדות רבות. כדוגמה, שימוש בסמים בתחרויות ספורט; מבחנים משפטיים על תכנים של חומרים נרקוטיים בדם או זיהוי ישיר של החומר שנמצא כסם או להיפך, כמוצר רפואי מאושר; בדיקה של מוצרי צריכה (מזון, כימיקלים ביתיים, כל הפריטים) על התוכן של תרכובות מזיקות ואסורות.
כדי להבין את אופי הקשר הכימי שגורם להיווצרות של מולקולות מאטומים, כמו גם גבישים, יש צורך לשקול את המודל המכני הקוונטי של האטום לגבי תכונות הגל של אלקטרונים. האינטראקציה של החיובים הקלאסיים מתוארת במלואה על ידי חוק קולום. אינטראקציה חשמלית של אלקטרונים אמיתיים עם תכונות גל לא ניתן לצמצם את אחד קולומב הרגיל.
חשבו על מה שקורה כאשר אטומים מתקרבים זה לזה. ראשית, הוכח באופן ניסיוני כי הכוחות המחזיקים אטומים במולקולות נגרמים על ידי אינטראקציה של אלקטרונים חיצוניים. עם זאת, האלקטרונים של הקונכיות הפנימיות נשארים במצבם הקודם. שנית, פונקציות הגל של אלקטרונים חיצוניים די מהר, אבל בהדרגה ירידה עם המרחק מן הגרעין. כאשר האטומים מתקרבים זה לזה, עננים אלקטרונים מפוזרים של אלקטרונים חופפים חופפים, מה שמוביל סוג מיוחד של אינטראקציה. אינטראקציה זו אין שווה ערךבפיסיקה הקלאסית, עבור חיובים קלאסיים, הבעיה של חדירה הדדית של גופים אינו מתעורר כלל. זה בא לידי ביטוי באזור של חפיפה של עננים אלקטרונים של אטומים בודדים. במצב כזה, אנרגיה נוספת (בנוסף קולום) האנרגיה של האינטראקציה של אלקטרונים, "חילופי אנרגיה", מופיע. יתר על כן, אם ספינים אלקטרונים מקבילים, האנרגיה היא חיובית, ואת האלקטרונים להדוף אחד את השני, מניעת היווצרות של מולקולה. אם ספיני האלקטרון אינם מקבילים, אנרגיית ההחלפה היא שלילית, והאלקטרונים נמשכים ונוטים ליצור קליפה אחת המקיפה את שני הגרעינים. הגרעינים יתקיימו במרחק מסוים בשל כוחות הדחייה של קולומב.
באטומים של הליום, שני אלקטרונים מלאים כדי-שלס יש ספינים מנוגדים, כך שהם לא מתחברים אחד עם השני או עם אטומים אחרים. הליום הוא גז אינרטי. שני אטומי ליתיום יכולים ליצור מולקולה על ידי שילוב אלקטרונים Lשכבה בקונכייה אחת. עם אלקטרונים אלה כדי-כדורים יידחו מאותן סיבות שאטומי הליום דוחים זה את זה. כלומר, רק אלקטרונים אלה שאינם משויכים מאחור יהיו פעילים מבחינה כימית. השילוב החיובי האנרגטי של אלקטרונים עם ספינים מנוגדים מוביל להיווצרות של קשר מולקולרי. יש לציין כי אטומי הליום באופן כללי יכולים ליצור מולקולה, אבל בשביל זה יש צורך כי שני האטומים להיות במצב נרגש - ב הראשון בשכבות השני יהיה אלקטרון אחד לא מזויף כל אחד. מולקולה כזו תהיה בלתי יציבה, מכיוון שאנרגיה של שני אטומים בלתי נלאים תהיה קטנה מאנרגיה של המולקולה.
שקול אטום בריליום ( Z= 4). במצב לא ממוקד, על פי תרשים. 8.2, אין לו אלקטרונים לא מזויפים - מבנה הקליפה השנייה שלו זהה לזה של אטום הליום אטום כימית.
איור. 8.2. תצורה אלקטרונית של אטום בריליום
ביסודו ונרגש
עם זאת, כפי שמוצג ניסיון, אטום בריליום הוא דו ערכי. הוא, כמו אטום הליום, יכול לקבל אלקטרונים ערכיים על עירור. על עירור, אחד האלקטרונים של אטום הליום חייב להעביר את הקליפה הבאה, זה דורש אנרגיה של 20 ~ eV, אשר אינו נחסם על ידי חילופי האנרגיה שפורסמו במהלך היווצרות של המולקולה.
כאשר אטום בריליום נרגש, שני אלקטרונים ערכיים נובעים כתוצאה מהמעבר של אחד מהם s- עמ '(איור 8.2). זה דורש אנרגיה נמוכה, חפיפה חוזרת ונשנית עקב חילופי האנרגיה המשתחררת במהלך היווצרות המולקולה. אם מולקולה נוצר על ידי שילוב אלקטרונים valence לתוך פגז אלקטרונים אחד, זה נפוץ לדבר על קשר כימי קוולנטי. לענן האלקטרונים שנוצר במקרה זה יש סימטריה ביחס לשני האטומים.
סוג אחר של קשר מולקולרי ניתן לראות בדוגמה של מולקולה. נאף. באטום הנתרן, שני פגזים הראשונים הושלמו, על השלישי ( n = 3) פגז אחד sהוא אלקטרון שאנרגיה מחייב שלו הוא 5.12 eV. ב אטום פלואור, רק פגז הראשון הושלמה, ועל השני יש 7 אלקטרונים, בעוד ספין אחד אינו רווי. לכן, אטום פלואור יכול בקלות לצרף אלקטרון שמיני, ציור אותו אטום הנתרן, ולהיות יון טעונה שלילית. אטום הנתרן הופך ליון חיובי. סוג זה של הקשר המולקולרי נקרא קשר כימי יוני.
האנרגיה של אינטראקציה החליפין במקרה של מולקולה נאףהוא 4.13 eV - זה פחות מאשר האנרגיה מחייב אלקטרונים באטום הנתרן, ובמבט ראשון, היווצרות של מולקולה זו אינה מועילה אנרגטית. עם זאת, יונים נוצרו של סימנים שונים במרחקים קטנים (על 5Å) יש אנרגיה מחייב של 2.9 eV. לפיכך, האנרגיה המחזיקה אטומים במולקולה מתברר להיות 4.13 + 2.9 = 7.03 eV, אשר באופן משמעותי עולה על האנרגיה מחייב של אלקטרון באטום (5.12 eV). מחדירה הדדית, היונים מוחזקים על ידי דחיפה של פגזים הושלמה.
הקשר המולקולרי יונית טהורה סוג אינו קיים, מדבר על היחס של יונים וקובאלנס. אבל, אם מולקולה מורכבת מאטומים זהים, זה סוג הקשר קוולנטי טהור.
המולקולה היא מערכת קוונטית, שכן ניתן לכתוב ולפתור את משוואת שרדינגר. המורכבות של המשוואה עולה באופן דרמטי עם עלייה במספר רכיבי המערכת (אלקטרונים וגרעינים).
חשבו על המולקולות הפשוטות ביותר - מולקולת המימן. הוא מורכב משני אלקטרונים ושני פרוטונים (שני גרעינים). האנרגיה הפוטנציאלית של מערכת כזו היא:
 (8.14)
(8.14)
גרעיני יש מסה כ 2000 פעמים את המוני של אלקטרון. לכן, בקירוב הראשון, הגרעינים יכולים להיחשב קבועים. קירוב זה מאפשר, מפשט באופן משמעותי, כדי להפחית את משוואת שרדינגר בצורה הבאה:
 (8.15)
(8.15)
שם U- אנרגיה פוטנציאלית (6.1),  הוא מפעיל Laplace, המכיל את הקואורדינטות של אלקטרון אחד, ו
הוא מפעיל Laplace, המכיל את הקואורדינטות של אלקטרון אחד, ו  - מפעיל Laplace המכיל את הקואורדינטות של אלקטרון אחר. אם נניח שתנועת הגרעינים והאלקטרונים אינה תלויה זה בזה, אזי משוואה (8.15) מתפצלת לשתי משוואות עצמאיות, שאחת מהן מתארת את מצב הגרעינים, והשנייה את מצב האלקטרונים.
- מפעיל Laplace המכיל את הקואורדינטות של אלקטרון אחר. אם נניח שתנועת הגרעינים והאלקטרונים אינה תלויה זה בזה, אזי משוואה (8.15) מתפצלת לשתי משוואות עצמאיות, שאחת מהן מתארת את מצב הגרעינים, והשנייה את מצב האלקטרונים.

איור. 8.3. האנרגיה של המולקולה תלויה במרחק שבין האטומים
האנרגיה הכוללת של תנועה ואינטראקציה של אלקטרונים במערכת של שני אטומי מימן מתבססת על המרחק בין גרעיני האטומים. יתר על כן, התלות יש אופי שונה עם הגישה של אטומים עם ספינים מקבילים או מקביל. כאשר הגרעינים מוסרים זה מזה בשני המקרים, קירוב אסימפטוטי של אנרגיית המערכת לערך ה 0 השווה לסך האנרגיות של שני אטומים. ערך זה שווה לאנרגיה המחייבת של המולקולה, בהתאמה, זו האנרגיה הדרושה להרוס את המולקולה ( אנרגיית דיסוציאציה).
עם הגישה של אטומים, האלקטרונים valence שבו יש ספינים מקבילים, עלייה באנרגיה הכוללת של המערכת של שני אטומים הוא ציין. במקרה זה, רק דחייה הדדית של אטומים אפשרי.
במקרה של התכנסות של אטומים עם ספינים בכיוון אופייני, יש מינימום של אנרגיה, אשר מתאים להיווצרות של מולקולה. מינימום זה נקבע על ידי ההפרש בין סכום האנרגיות של שני אטומים לבין האנרגיה של האינטראקציה שלהם. מרחק R 0 קובע את מרחק שיווי המשקל בין הגרעינים במולקולה עבור תצורה אלקטרונית נתונה. כאשר תצורת אלקטרונים של מולקולה משתנה, למשל, כאשר מולקולה מעבירה למצב נרגש, התלות של אנרגיית האלקטרון על המרחק בין הגרעינים משתנה. U * (ייצור) (איור 8.4). זה בא לידי ביטוי בפרט כי המרחק שיווי המשקל בין גרעיני האטומים המרכיבים את המולקולה משתנה. אנרגיית הדיסוציאציה של המולקולה משתנה אף היא.

איור. 8.4. פוטנציאל הקימורים של המולקולה במצב הקרקע נרגש
שינויים אפשריים באנרגיה של מולקולה נקבעים על ידי שלושה סוגים של תנועה האופיינית למולקולות.
1) כאשר השינויים תצורה אלקטרונית (כלומר, כתוצאה משינוי בחלק היקפי של המולקולה), השינוי הבולט ביותר באנרגיה של המולקולה מתרחשת. חלק זה של אנרגיה נקרא אנרגיה אלקטרונים. ה ה .
2) עבור תצורת אלקטרונים מסוימת של המולקולה, הגרעין יכול להתנודד יחסית למצב שיווי המשקל.
אתה יכול לקבוע את האנרגיה של תנועה תנודה של גרעינים, הוא quantized, עם תנודות קטנות, שווה ל:
 (υ = 0, 1, 2, ...)(8.16)
(υ = 0, 1, 2, ...)(8.16)
שם ω υ - תדר מתנד קלאסי,
υ –מספר קוונטי מתנדנדשינוי אשר במעברים כפוף לכלל הבחירה: Δ ± = = 1(8.17)
3) לבסוף, יש צורך לקחת בחשבון כי המולקולה כולה עושה תנועה סיבובית יחסית למרכז המסה. מערכת כזו יש רגע של אינרציה, ואת התנועה שלה ניתן לתאר במהירות זוויתית. ω ייצור . במקרה זה, האנרגיה תהיה שווה ל:
 (8.18)
(8.18)
שם אני- רגע האינרציה של המולקולה ביחס לציר העובר במרכז המסה.
M = ג'ו ייצור - המומנטום הזוויתי של המערכת, אשר יכול גם לקחת רק ערכים נפרדים, שכן המולקולה היא מערכת עם תכונות קוונטיות:
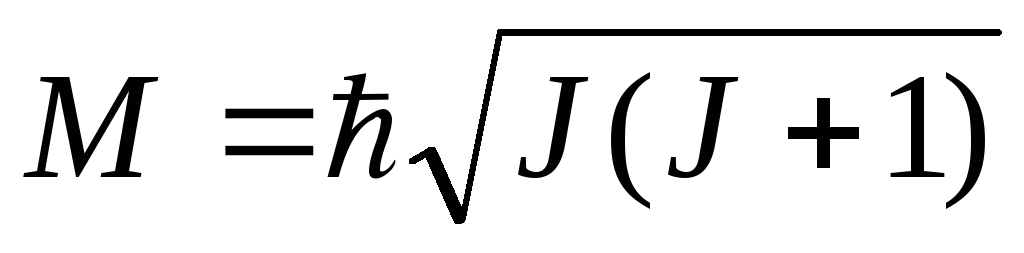 (י = 0, 1, 2,...)
(8.19)
(י = 0, 1, 2,...)
(8.19)
כאן י- כמות קוונטית של מומנטום זוויתי או מספר קוונטי סיבובי - -.
לפיכך, הערך של אנרגיה סיבובית הוא quantized:
 (8.20)
(8.20)
מעברי האנרגיה של המולקולה מתרחשים על פי כלל הבחירה עבור מספר הקוואנטים הסיבוביים:  (8.21)
(8.21)
לכן, האנרגיה הכוללת של המולקולה שווה ל:
 (8.22)
(8.22)
לכל אחד מהמונחים של האנרגיה הכוללת של כל מולקולה יש סדר גודל מסוים, וקובע את המרחק בין הרמות המקבילות על ערכת האנרגיה של המולקולה. אנרגיה אלקטרונית ה ה הוא בסדר גודל של מספר eV (1 - 10 eV); אנרגיה רטט - ה υ ≈ 0.01 - 0.1 eV; אנרגיה סיבובית - ה ייצור ≈ 10 -5 - 10 -3 eV.
ספקטרום המולקולות, בניגוד לספקטרום הקו של האטומים, הוא סט של להקות המורכבות מקווים אחדים. תלוי איזה סוג של שינויים באנרגיה כאשר פוטון נפלט על ידי מולקולה, ישנם שלושה סוגים של להקות: סיבוב, vibrational-rotational ו-רטט אלקטרוניים.
מעברים אלקטרונים vibrational בספקטרום של מולקולות יש את האנרגיה הגבוהה ביותר (בסדר של מספר eV). רמות האנרגיה האלקטרונית מעורבים במעברים אלה, ה" ה ו ה"" ה ב איור. 7.5), כמו גם רמות vibrational (למשל υ" 49 ו υ"" = 0 או כל רמות vibrational אחרים, אבל אחד חייב להיות מן sublevels vibrational של המדינה האלקטרונית ה" ה , עוד של sublevels vibrational של המדינה האלקטרונית ה"" ה). עבור להקות מסוג מתנדנד אלקטרוני, יש קצה חד בצד אחד, הנקרא קצה הרצועה, ואת קצה מטושטש על השני.
![]()
איור. 8.5. תרשים האנרגיה של המולקולה
להקות המתאימות למעברים סיבוביים vibrational ממוקמים בטווח האנרגיה מ 0.01 eV ל 1.5 eV. במקרה זה, המיקום של הלהקה בספקטרום (כלומר, תדירות או אורך גל או אנרגיה) קובע את רכיב vibrational (אלה יכולים להיות שתי מדינות vibrational υ" =iו υ" =i ± 1 מאותה רמה אלקטרונית). רכיב סיבוב ימשתנה ברמה הרטט נתון וקובע את המבנה הדק של הלהקה (כלומר, הנוכחות וההסדר ההדדי של קווים בתוך פס נתון).
להקות סיבוביות מורכבות מקווים המתאימים למעברים בין מצבי סיבוב בלבד בתוך רמה אחת מתנדנדת. אנרגיית הפוטון, תחת הפעולה של מעברים כאלה אפשריים הוא קטן למדי (כ 0.001 eV), ומכאן הלהקות סיבוב ממוקמים באזור אינפרא אדום רחוק.
הספקטרום של מולקולות הן גם בודדות עבור תרכובות אורגניות ואורגניות שונות, כמו גם הספקטרום של אטומים שונים. הניסיון שנצבר על ידי מדענים - ספקטרוסקופים מאפשר לנו לקבוע את הנוכחות ואף את אחוז החומר הספציפי במדגם מספקטרום פליטת המולקולות (או תערובת של מולקולות). מאפיין חשוב של שיטות כאלה הוא סף נמוך של רגישות - אפילו נוכחות של כמות קטנה מאוד של חומר כלשהו זמין עבור המחקר. הוא משמש כיום נרחב לניתוח מומחים במעבדות רבות. כדוגמה, שימוש בסמים בתחרויות ספורט; מבחנים משפטיים על תכנים של חומרים נרקוטיים בדם או זיהוי ישיר של החומר המצוי כמו נרקוטיקה או להיפך, כמוצר רפואי מאושר; בדיקה של מוצרי צריכה (מזון, כימיקלים ביתיים, כל הפריטים) על התוכן של תרכובות מזיקות ואסורות.
כדי להבין את אופי הקשר הכימי שגורם להיווצרות של מולקולות מאטומים, כמו גם גבישים, יש צורך לשקול את המודל המכני הקוונטי של האטום לגבי תכונות הגל של אלקטרונים. האינטראקציה של החיובים הקלאסיים מתוארת במלואה על ידי חוק קולום. אינטראקציה חשמלית של אלקטרונים אמיתיים עם תכונות גל לא ניתן לצמצם את אחד קולומב הרגיל.
חשבו על מה שקורה כאשר אטומים מתקרבים זה לזה. ראשית, הוכח באופן ניסיוני כי הכוחות המחזיקים אטומים במולקולות נגרמים על ידי אינטראקציה של אלקטרונים חיצוניים. עם זאת, האלקטרונים של הקונכיות הפנימיות נשארים במצבם הקודם. שנית, פונקציות הגל של אלקטרונים חיצוניים די מהר, אבל בהדרגה ירידה עם המרחק מן הגרעין. כאשר האטומים מתקרבים זה לזה, עננים אלקטרונים מפוזרים של אלקטרונים חופפים חופפים, מה שמוביל סוג מיוחד של אינטראקציה. אינטראקציה זו אין שווה ערך בפיסיקה הקלאסית, עבור חיובים קלאסיים, הבעיה של חדירה הדדית של גופים אינו מתעורר כלל. זה בא לידי ביטוי באזור של חפיפה של עננים אלקטרונים של אטומים בודדים. במצב כזה, אנרגיה נוספת (בנוסף קולום) האנרגיה של האינטראקציה של אלקטרונים, "חילופי אנרגיה", מופיע. יתר על כן, אם ספינים אלקטרונים מקבילים, האנרגיה היא חיובית, ואת האלקטרונים להדוף אחד את השני, מניעת היווצרות של מולקולה. אם ספיני האלקטרון אינם מקבילים, אנרגיית ההחלפה היא שלילית, והאלקטרונים נמשכים ונוטים ליצור קליפה אחת המקיפה את שני הגרעינים. הגרעינים יתקיימו במרחק מסוים בשל כוחות הדחייה של קולומב.
באטומים של הליום, שני אלקטרונים מלאים כדי-שלס יש ספינים מנוגדים, כך שהם לא מתחברים אחד עם השני או עם אטומים אחרים. הליום הוא גז אינרטי. שני אטומי ליתיום יכולים ליצור מולקולה על ידי שילוב אלקטרונים Lשכבה בקונכייה אחת. עם אלקטרונים אלה כדי-כדורים יידחו מאותן סיבות שאטומי הליום דוחים זה את זה. כלומר, רק אלקטרונים אלה שאינם משויכים מאחור יהיו פעילים מבחינה כימית. השילוב החיובי האנרגטי של אלקטרונים עם ספינים מנוגדים מוביל להיווצרות של קשר מולקולרי. יש לציין כי אטומי הליום באופן כללי יכולים ליצור מולקולה, אבל בשביל זה יש צורך כי שני האטומים להיות במצב נרגש - ב הראשון בשכבות השני יהיה אלקטרון אחד לא מזויף כל אחד. מולקולה כזו תהיה בלתי יציבה, מכיוון שאנרגיה של שני אטומים בלתי נלאים תהיה קטנה מאנרגיה של המולקולה.
שקול אטום בריליום ( Z = 4). במצב לא ממוקד, על פי תרשים. 8.2, אין לו אלקטרונים לא מזויפים - מבנה הקליפה השנייה שלו זהה לזה של אטום הליום אטום כימית.
איור. 8.2. תצורה אלקטרונית של אטום בריליום
ביסודו ונרגש
עם זאת, כפי שמוצג ניסיון, אטום בריליום הוא דו ערכי. הוא, כמו אטום הליום, יכול לקבל אלקטרונים ערכיים על עירור. על עירור, אחד האלקטרונים של אטום הליום חייב להעביר את הקליפה הבאה, זה דורש אנרגיה של 20 ~ eV, אשר אינו נחסם על ידי חילופי האנרגיה שפורסמו במהלך היווצרות של המולקולה.
כאשר אטום בריליום נרגש, שני אלקטרונים ערכיים נובעים כתוצאה מהמעבר של אחד מהם s- עמ '(איור 8.2). זה דורש אנרגיה נמוכה, חפיפה חוזרת ונשנית עקב חילופי האנרגיה המשתחררת במהלך היווצרות המולקולה. אם מולקולה נוצר על ידי שילוב אלקטרונים valence לתוך פגז אלקטרונים אחד, זה נפוץ לדבר על קשר כימי קוולנטי. לענן האלקטרונים שנוצר במקרה זה יש סימטריה ביחס לשני האטומים.
סוג אחר של קשר מולקולרי ניתן לראות בדוגמה של מולקולה. נאף. באטום הנתרן, שני פגזים הראשונים הושלמו, על השלישי ( n =3) פגז אחד sהוא אלקטרון שאנרגיה מחייב שלו הוא 5.12 eV. ב אטום פלואור, רק פגז הראשון הושלמה, ועל השני יש 7 אלקטרונים, בעוד ספין אחד אינו רווי. לכן, אטום פלואור יכול בקלות לצרף אלקטרון שמיני, ציור אותו אטום הנתרן, ולהיות יון טעונה שלילית. אטום הנתרן הופך ליון חיובי. סוג זה של הקשר המולקולרי נקרא קשר כימי יוני.
האנרגיה של אינטראקציה החליפין במקרה של מולקולה נאף הוא 4.13 eV - זה פחות מאשר האנרגיה מחייב אלקטרונים באטום הנתרן, ובמבט ראשון, היווצרות של מולקולה זו אינה מועילה אנרגטית. עם זאת, יונים נוצרו של סימנים שונים במרחקים קטנים (על 5Å) יש אנרגיה מחייב של 2.9 eV. לכן, האנרגיה החזקה אטומים במולקולה הוא 4.13 + 2.9 = 7.03 eV, אשר עולה באופן משמעותי את האנרגיה מחייב של אלקטרון באטום (5.12 eV). מחדירה הדדית, היונים מוחזקים על ידי דחיפה של פגזים הושלמה.
הקשר המולקולרי יונית טהורה סוג אינו קיים, מדבר על היחס של יונים וקובאלנס. אבל, אם מולקולה מורכבת מאטומים זהים, זה סוג הקשר קוולנטי טהור.
המולקולה היא מערכת קוונטית, שכן ניתן לכתוב ולפתור את משוואת שרדינגר. המורכבות של המשוואה עולה באופן דרמטי עם עלייה במספר רכיבי המערכת (אלקטרונים וגרעינים).
חשבו על המולקולות הפשוטות ביותר - מולקולת המימן. הוא מורכב משני אלקטרונים ושני פרוטונים (שני גרעינים). האנרגיה הפוטנציאלית של מערכת כזו היא:
 (8.14)
(8.14)
גרעיני יש מסה כ 2000 פעמים את המוני של אלקטרון. לכן, בקירוב הראשון, הגרעינים יכולים להיחשב ללא תנועה. קירוב זה מאפשר, מפשט באופן משמעותי, כדי להפחית את משוואת שרדינגר בצורה הבאה:
 (8.15)
(8.15)
שם U - פוטנציאל האנרגיה (6.1), - מפעיל Laplace המכיל את הקואורדינטות של אלקטרון אחד, ו - מפעיל Laplace המכיל את הקואורדינטות של אלקטרון אחר. אם נניח שתנועת הגרעינים והאלקטרונים אינה תלויה זה בזה, אזי משוואה (8.15) מתפצלת לשתי משוואות עצמאיות, שאחת מהן מתארת את מצב הגרעינים, והשנייה את מצב האלקטרונים.

איור. 8.3. האנרגיה של המולקולה תלויה במרחק שבין האטומים
האנרגיה הכוללת של תנועה ואינטראקציה של אלקטרונים במערכת של שני אטומי מימן מתבססת על המרחק בין גרעיני האטומים. יתר על כן, התלות יש אופי שונה עם הגישה של אטומים עם ספינים מקבילים או מקביל. כאשר הגרעינים מוסרים זה מזה בשני המקרים, קירוב אסימפטוטי של אנרגיית המערכת לערך E 0השווה לסך האנרגיות של שני אטומים. ערך זה שווה לאנרגיה המחייבת של המולקולה, בהתאמה, זו האנרגיה הדרושה להרוס את המולקולה ( אנרגיית דיסוציאציה).
עם הגישה של אטומים, האלקטרונים valence שבו יש ספינים מקבילים, עלייה באנרגיה הכוללת של המערכת של שני אטומים הוא ציין. במקרה זה, רק דחייה הדדית של אטומים אפשרי.
במקרה של התכנסות של אטומים עם ספינים בכיוון אופייני, יש מינימום של אנרגיה, אשר מתאים להיווצרות של מולקולה. מינימום זה נקבע על ידי ההפרש בין סכום האנרגיות של שני אטומים לבין האנרגיה של האינטראקציה שלהם. מרחק R 0 קובע את מרחק שיווי המשקל בין הגרעינים במולקולה עבור תצורה אלקטרונית נתונה. כאשר תצורת אלקטרונים של מולקולה משתנה, למשל, כאשר מולקולה מעבירה למצב נרגש, התלות של אנרגיית האלקטרון על המרחק בין הגרעינים משתנה. U * (r) (איור 8.4). זה בא לידי ביטוי בפרט כי המרחק שיווי המשקל בין גרעיני האטומים המרכיבים את המולקולה משתנה. אנרגיית הדיסוציאציה של המולקולה משתנה אף היא.

איור. 8.4. פוטנציאל הקימורים של המולקולה במצב הקרקע נרגש
שינויים אפשריים באנרגיה של מולקולה נקבעים על ידי שלושה סוגים של תנועה האופיינית למולקולות.
1) כאשר השינויים תצורה אלקטרונית (כלומר, כתוצאה משינוי בחלק היקפי של המולקולה), השינוי הבולט ביותר באנרגיה של המולקולה מתרחשת. חלק זה של אנרגיה נקרא אנרגיה אלקטרונים. ה.
2) עבור תצורת אלקטרונים מסוימת של המולקולה, הגרעין יכול להתנודד יחסית למצב שיווי המשקל.
אתה יכול לקבוע את האנרגיה של תנועה תנודה של גרעינים, הוא quantized, עם תנודות קטנות, שווה ל:
 (υ = 0, 1, 2, ...) (8.16)
(υ = 0, 1, 2, ...) (8.16)
שם ω υ - תדר מתנד קלאסי,
υ – מספר קוונטי מתנדנדשינוי אשר במעברים כפוף לכלל הבחירה: Δ ± = = 1 (8.17)
3) לבסוף, יש צורך לקחת בחשבון כי המולקולה כולה עושה תנועה סיבובית יחסית למרכז המסה. מערכת כזו יש רגע של אינרציה, ואת התנועה שלה ניתן לתאר במהירות זוויתית. dem. במקרה זה, האנרגיה תהיה שווה ל:
 (8.18)
(8.18)
שם אני - רגע האינרציה של המולקולה ביחס לציר העובר במרכז המסה.
Independent 49 - המומנטום הזוויתי של המערכת, אשר יכול גם לקחת רק ערכים נפרדים, שכן המולקולה היא מערכת עם תכונות קוונטיות:
![]() (J = 0, 1, 2, ...) (8.19)
(J = 0, 1, 2, ...) (8.19)
כאן י - כמות קוונטית של מומנטום זוויתי או מספר קוונטי סיבובי - -.
לפיכך, הערך של אנרגיה סיבובית הוא quantized:  (8.20)
(8.20)
מעברי האנרגיה של המולקולה מתרחשים על פי כלל הבחירה עבור מספר הקוואנטים הסיבוביים: (8.21)
לכן, האנרגיה הכוללת של המולקולה שווה ל:
 (8.22)
(8.22)
לכל אחד מהמונחים של האנרגיה הכוללת של כל מולקולה יש סדר גודל מסוים, וקובע את המרחק בין הרמות המקבילות על ערכת האנרגיה של המולקולה. אנרגיה אלקטרונית ה הוא בסדר גודל של מספר eV (1 - 10 eV); אנרגיה רטט - E υ≈ 0.01 - 0.1 eV; אנרגיה סיבובית - Er≈ 10 -5 - 10 -3 eV.
ספקטרום המולקולות, בניגוד לספקטרום הקו של האטומים, הוא סט של להקות המורכבות מקווים אחדים. תלוי איזה סוג של שינויים באנרגיה כאשר פוטון נפלט על ידי מולקולה, ישנם שלושה סוגים של להקות: סיבוב, vibrational-rotational ו-רטט אלקטרוניים.
מעברים אלקטרונים vibrational בספקטרום של מולקולות יש את האנרגיה הגבוהה ביותר (בסדר של מספר eV). רמות האנרגיה האלקטרונית מעורבים במעברים אלה, E "ה ו E "" ה ב איור. 7.5), כמו גם רמות vibrational (למשל υ" 49 ו υ"" = 0 או כל רמות vibrational אחרים, אבל אחד חייב להיות מן sublevels vibrational של המדינה האלקטרונית E "ה, עוד של sublevels vibrational של המדינה האלקטרונית E "" ה). עבור להקות מסוג מתנדנד אלקטרוני, יש קצה חד בצד אחד, הנקרא קצה הרצועה, ואת קצה מטושטש על השני.
להקות המתאימות למעברים סיבוביים vibrational ממוקמים בטווח האנרגיה מ 0.01 eV ל 1.5 eV. במקרה זה, המיקום של הלהקה בספקטרום (כלומר, תדירות או אורך גל או אנרגיה) קובע את רכיב vibrational (אלה יכולים להיות שתי מדינות vibrational υ" = i ו υ" = i± 1 מאותה רמה אלקטרונית). רכיב סיבוב י משתנה ברמה הרטט נתון וקובע את המבנה הדק של הלהקה (כלומר, הנוכחות וההסדר ההדדי של קווים בתוך פס נתון).

איור. 8.5. תרשים האנרגיה של המולקולה
להקות סיבוביות מורכבות מקווים המתאימים למעברים בין מצבי סיבוב בלבד בתוך רמה אחת מתנדנדת. אנרגיית הפוטון, תחת הפעולה של מעברים כאלה אפשריים הוא קטן למדי (כ 0.001 eV), ומכאן הלהקות סיבוב ממוקמים באזור אינפרא אדום רחוק.
הספקטרום של מולקולות הן גם בודדות עבור תרכובות אורגניות ואורגניות שונות, כמו גם הספקטרום של אטומים שונים. הניסיון שנצבר על ידי מדענים-ספקטרוסקופים מאפשר לנו לקבוע את הנוכחות ואף את אחוז החומר הספציפי במדגם מספקטרום הפליטה של מולקולה (או תערובת של מולקולות). מאפיין חשוב של שיטות כאלה הוא סף נמוך של רגישות - אפילו נוכחות של כמות קטנה מאוד של חומר כלשהו זמין עבור המחקר. הוא משמש כיום נרחב לניתוח מומחים במעבדות רבות. כדוגמה, שימוש בסמים בתחרויות ספורט; מבחנים משפטיים על תכנים של חומרים נרקוטיים בדם או זיהוי ישיר של החומר שנמצא כסם או להיפך, כמוצר רפואי מאושר; בדיקה של מוצרי צריכה (מזון, כימיקלים ביתיים, כל הפריטים) על התוכן של תרכובות מזיקות ואסורות.
מה נעשה עם החומר המתקבל:
אם חומר זה התברר כשימושי עבורך, תוכל לשמור אותו בדף שלך ברשתות חברתיות:
| Wish |
כל הנושאים בקטע זה:
חום קרינה נכסים
מאז ימי קדם, זה ידוע כי חומרים מחומם לטמפרטורה גבוהה מספיק לרכוש את היכולת זוהר. לדוגמה, נוזלים אדומים חמים מוצקים פולטים אור לבן שיש לו
פונקציה קירכהוף. גוף שחור לחלוטין
זרימת האנרגיה הנפלטת על ידי יחידת פני השטח של הגוף המקרין לכל הכיוונים (בתוך הזווית המוצקה 2π) נקראת אנרגיית האנרגיה של הגוף R, שהיא
החוק של עקירה של יין
ב- 1884, סטיבן, המבוסס על נתונים ניסיוניים, ובולצמן, משיקולים תיאורטיים, השיג שהטכנולוגיה האנרגטית RT של גוף שחור לחלוטין, הקשור ו
תורת פלאנק
כדי לחסל את השגיאה, המדענים נאלצו לשנות באופן קיצוני את השקפתם על טבע הקרינה. הראשון לעשות זאת היה מקס פלאנק. לאחר חישובים ארוכים, כדי לקבל את המבוקש הרצוי מחדש
אפקט תמונה
יחד עם חוקי קרינה תרמית בסוף המאה XIX. התגלתה תופעה אופטית שאינה מתאימה לחוקי הפיזיקה הקלאסית. זוהי תופעה של אפקט הפוטואלקטרי או רק fotoef
אנרגיה, מסת ו מומנטום של פוטון. לחץ קל
אפקט התמונה מראה כי קרינה אלקטרומגנטית יכולה להתנהג כמו חלקיק - פוטון. כאשר סופג, פולט או אינטראקציה פוטון עם כל חלקיקים, אתה יכול להשתמש באותו חוק
אפקט קומפטון
הנוכחות של תכונות corpuscular באור הוא אישר גם על ידי קומפטון פיזור של פוטונים. האפקט נקרא על שמו של הפיזיקאי האמריקאי ארתור הולי קומפטון גילו תופעה זו בשנת 1923. ח
התיאוריה האטומית של בור
מימי יוון העתיקה עד סוף המאה ה XIX. האמינו כי כל הגופים מורכבים מהחלקיקים הקטנים ביותר - אטומים שהם חלקיקי חומר בלתי ניתנים לחלוקה, "הלבנים של היקום". כל ביטוי
תכונות הגל של החומר. היפותזה דה ברולי
בהתייחסו למאפייני האור והמיקרו-פייקלים, הגיע הפיזיקאי הצרפתי לואי דה ברולי למסקנה כי "הדואליזם של גלים גל איינשטיין הוא אוניברסלי והוא חל על כל פיזית
עקרון האי-ודאות של הייזנברג
בכל רגע, הן אור ו microparticles הן חלקיק וגם גל. רק במקרים מסוימים אחד המאפיינים הוא פחות בולט. לדוגמה, עבור גל אלקטרומגנטי עם תדר הנמוך מ -10
פונקציית גל
לכן, microparticles לא לציית לחוקים של מכניקה קלאסית, ההתנהגות שלהם לא יכול להיות מתואר על ידי שיטות מקובלות בפיסיקה הקלאסית. עובדה זו הובילה את המדענים ליצור תיאוריה חדשה. מכונאי חדש
משוואת שרדינגר
לכן, מצב המערכת מתואר על ידי פונקציית הגל, אשר נקבעת על פי תצורת המערכת וסוג ספציפי של שדה כוח שבו הוא ממוקם. מצא את שעת הפונקציה
משוואת שרדינגר לחלקיק חופשי
שקול חלקיק נע בחופשיות. ואם פונקציית הגל של פוטון היא גל אור מטוס, עבור חלקיקים פונקציית הגל הוא גל מטוס דה ברולי, (ראה סעיף 4). עבור
משוואת שרדינגר עבור חלקיק בשדה כוח
אם החלקיק נמצא בכל שדה כוח המאופיין באנרגיה פוטנציאלית U, אז: (5.8)
משוואת שרדינגר נייחת
אם שדה הכוח שבו החלקיקים נעים הוא נייח (כלומר, באופן קבוע בזמן), אזי הפונקציה U אינה תלויה במפורש ב- t. במקרה זה, הפתרון של משוואת שרדינגר מתחלק לשניים
משוואת שרדינגר עבור חלקיק בבאר פוטנציאלית
נוכחותו של אלקטרון בתחום הגרעין יכולה להיחשב כתנועה בבאר פוטנציאלי תלת מימדי. גובה באר זה נקבע על פי גודל שדה קולום של הגרעין. חשבו על המילה הפשוטה ביותר.
אפקט המנהרה
שקול את תנועתו של חלקיק במהלך מעבר של מכשול פוטנציאלי. תן לו לזוז משמאל לימין לפגוש בדרכה מחסום פוטנציאלי של U0 גובה רוחב
מתנד הרמוני. פונונים
לתיאור של מערכות קלאסיות וקוונטיות, המודל של מתנד הרמוני משמש לעתים קרובות. מתנד הרמוני ליניארי היא מערכת המבצעת שני תנודות חד-ממדיות
מספר קוונטי ראשי
הבה נבחן כמודל את המערכת הפשוטה ביותר המורכבת מגרעין קבוע עם מטען Z = 1 ואלקטרון אחד, כלומר. אטום מימן. באופן דומה, מה שנקרא
מספרים קוונטיים של מסלול אורביטלי ומגנטי
הפרמטרים l ו- m הם האזימוט (או מסלולית) ומספרים קוונטיים מגנטיים. אנו מסבירים את הופעתם. שקול את משוואת שרדינגר נייחת (ב
כללי בחירה. ספקטרה של אטומים
אנו יודעים כי פליטה וקליטה של האור מתרחשת במהלך מעברים אלקטרונים מרמה אחת לאחרת. במקרה זה, אטום יכול לספוג או לפלוט רק פוטון עם אנרגיה שווה להפרש האנרגיה עם
רגע אלקטרונים
לכן, לאטום יש מומנטום זוויתי מכני, וקיומו משפיע על הספקטרום של האטומים. מאחר שההרכב של האטום כולל חלקיקים טעונים, כאשר בוחנים את תנועתם, יש צורך ללמד
פאולי
במקרה של מורכבות יותר מאשר אטומי מימן שיש מספר אלקטרונים, אנו יכולים להניח כי כל אלקטרונים נעים בשדה הממוצעים של הגרעין ושאר האלקטרונים. שדה זה כבר לא
אפקט זיימן
בידיעה את הרגע המגנטי הכולל של אטום, ניתן לקבוע את ההשפעה של שדה מגנטי חיצוני על הספקטרום שלו. פיצול רמות האנרגיה האטומית על ידי שדה מגנטי חיצוני
פליטה ספונטנית ומעוררת
קיומו של כל microsystem (אטום, מולקולה, זרם החלקיקים) הוא שינוי מרובה באנרגיה הכוללת של מערכת זו כתוצאה של האינטראקציה שלה עם מערכות אחרות. שינוי באנרגיה הכוללת
העיקרון של הפעולה ואת לייזרים המכשיר
הקרינה הכפויה היתה הבסיס למגברי הקרינה האלקטרומגנטית. הפיזיקאים הסובייטיים נ 'ג' באסוב וא 'מ פרוקהורוב, ובאופן בלתי תלוי בהם האמריקאי ג' טונסון, בשנות ה -50 של המאה העשרים
סטטיסטיקה של בוז-איינשטיין ופרמי-דיראק
החלקיקים שנחקרו במהלך הפיזיקה הסטטיסטית המולקולרית הקלאסית יכולים להיחשב כדורים אלסטיים. יתר על כן, כל חלקיקים זהים ניתן להבחין בין האחרים - כמו ב
גיבוש אזורי אנרגיה
כל הגופים קריסטל הם הצטברות הורה של מספר עצום של אטומים. סריג קריסטל אידיאלי מורכב חוזר שוב ושוב תאים יסודיים זהים.
מוליכות פנימית
קחו את תורת הקוונטים של מוליכות של חומרים שונים. נזכיר כי מוליכות היא היכולת של נושאות תשלום לבצע תנועה כיוונית בהתאם להחיל electr
מוליכות טומאה
התכונות החשמליים והאופטיים של מוליכים למחצה טומאה תלויים זיהומים טבעיים או מלאכותיים הציג. כמובן, לניהול יעיל של תכונות החומר נחוץ
תורת הקוונטים של מוליכות מתכת
שקול את תהליך ההולכה מנקודת מבט קוונטית. בהרצאה הקודמת נאמר כי כאשר האטומים משתלבים בסריג גבישי, גובה הקירות של סרגל הפוטנציאל פוחת.
מוליכות
באזור של טמפרטורות נמוכות, את התופעה של מוליכות נצפתה - ירידה חדה ההתנגדות של החומר. תופעה זו התגלתה לראשונה בשנת 1911 על ידי Kamerlingh Onnes עבור כספית בטמפרטורה
הרכב ומאפיינים של גרעינים אטומיים
הגרעין של כל אטום, מלבד האטום של מימן אור, מורכב מחלקיקים - שני סוגים של נוקלאונים: פרוטונים Z ו- N נייטרונים. ניוטרון התגלה בשנת 1932 על ידי ג'יימס צ'אדוויק, אז Car
כוחות גרעיניים
הכוחות הגרעיניים הנ"ל מאפיינים את אחד מהאינטראקציות הבסיסיות, הנקראות אינטראקציה חזקה. ישנם 4 סוגים של אינטראקציות בסיסיות - לפי הסדר
היווצרות גרעינים. פגם המוני
שקול את התהליך של נוקלאציה. אופי היווצרותו של כל גרעין הוא כזה שמסה של גרעין יציב היא תמיד פחות מסכום המונים של הנוקלאונים המהווים את הגרעין הזה. לדוגמה, גרעין הדויטריום, על
חוק הטרנספורמציה הרדיואקטיבית
רדיואקטיביות היא הטרנספורמציה הספונטנית של גרעין אטומי אחד למשנהו, מלווה בפליטת חלקיקים בסיסיים. במהלך טרנספורמציה כזו, הגרעין עשוי להשתנות
אלפא ריקבון
אלפא ריקבון הוא תהליך של פליטה ספונטנית של חלקיקי α על ידי הגרעין, אשר מטבעם הם אטומי הליום
דעיכת בטא
ריקבון ביתא הוא תהליך של טרנספורמציה ספונטנית של גרעין לא יציב לגרעין-איסובאר (גרעין עם מספר אטומי זהה) עם מטען שונה מהראשון ב ΔZ = 1, עקב פליטת אלקטרונים
ביקוע ספונטני של גרעינים כבדים. קרינת גמא
תהליך של ביקוע ספונטני של גרעינים כבדים התגלה בשנת 1940 על ידי הפיזיקאים הסובייטיים G.N. פלרוב וק. פטרז'קוב. הם מצאו כי ללא כל השפעה חיצונית של גרעין האורניום עצמו
תהליכים גרעיניים מאולצים
תגובה גרעינית היא תהליך של אינטראקציה חזקה של גרעין אטומי עם חלקיק אלמנטרי, המוביל לשינוי של גרעין (או גרעינים אחדים). התגובה מתרחשת כאשר ההתקרבות
התגובה הביקוע הגרעיני
בשנת 1938 גילו מדענים גרמנים א 'גן ופ' שטרסמן כי כאשר האורניום מוקרן בנייטרונים תרמיים, נוצרו אלמנטים מאמצע המערכת התקופתית - בריום ולנתנום (הנקרא תרמי
התגובה של הסינתזה של גרעיני האטום
ההיתוך הגרעיני, כלומר מיזוג גרעיני האור לגרעין אחד, מלווה, כמו ביקוע גרעינים כבדים, על ידי שחרור כמות עצומה של אנרגיה. מאז סינתזה של גרעינים נדרשת גבוהה מאוד
מסקנה
מדריך זה בחן את הנושאים העיקריים של הפיזיקה הקוונטית - הטבע הקוונטי של קרינה אלקטרומגנטית, הפיזיקה של אטומים, מולקולות, גופים גבישיים וגרעינים, מציג את האלמנטים של קואה













