Ūdeņraža saites piemēri. Savienojumi ar ūdeņraža saitēm. Ūdeņraža saite polimēros
OSVITI MINISTRIJA UN UKRAINAS ZINĀTNE
KHARKIVSKIY NATSIONALNY UNIVERSITĀTE
im. V.N. Karazina
Ķīmijas rūpniecības departaments
ŪDENSVADU ZV "VALODAS DIMERI HF
Kursa robots
students gr. X - 134
Ķīmijas fakultāte
KOLISNIKA OLEKSIYA VASILOVICHA
Науковий кіівник
ph.D., asociētais profesors
V.V. Ivanovs
Šādā gadījumā tas ir novietots uz orientācijas, izraisot molekulas dipola momenta palielināšanos. Indukcijas efekts ir atkarīgs no temperatūras, bet lielā mērā ir atkarīgs no attāluma starp molekulām, polārās molekulas dipola momentu un polārās polarizācijas spēju. Trešais dispersijas efekts attiecas uz mijiedarbību starp polārajām molekulām, jo tām ir kustīgi elektroni. Elektronu līdzsvaru molekulā var traucēt. Līdz ar to rodas acumirklīgas īssavienojumu momentānās dipoles un pat tās pastāv, tās spēj radīt dipola momentu blakus esošajās daļiņās.
HARKIV 2010
ievads
Pēdējo desmitgažu laikā interese par ūdeņraža fluorīda (dimēra, trimera) oligomēriem ir patiesi lieliska. Tas galvenokārt izskaidrojams ar ūdeņraža saiknes lomu milzīgas tiešas praktiskas intereses vielu klases interpretēšanā, modelēšanā un prognozēšanā (pietiek atsaukt ūdeni). Ūdeņraža fluorīda molekulu asociētās personas tiek uzskatītas par vienkāršākajiem kompleksiem, kuru komponenti tiek saglabāti ar ūdeņraža saites palīdzību, un dimers (HF) 2 ir pirmais šajā sērijā.
Tādējādi tiek īstenota impulsa dipola mijiedarbība ar momentāno dipolu. Un, lai gan kopējais molekulas dipola moments ir 0, šīs tūlītējās mijiedarbības notiek nepārtraukti un rada spēcīgus pievilcīgus spēkus. Svarīga dispersijas spēku iezīme ir to daudzpusība.
Papildus molekulām tās var rasties starp tām pašām vai dažādām daļiņām, molekulu atomu grupām utt. Ūdens ir viena no augstākajām daļām. pastāvīgs starp šķidrumiem. Ūdens dielektriskā konstante palielinās līdz -70 ° C, tad samazinās. Modeļi ar fiksētu maksu neļauj veikt izmaiņas dipola momentā. Polarizēto ūdeņu modeļu izstrāde.
Tagad ir daudz zināms par ūdeņraža fluorīda dimēra struktūru no eksperimentālo pētījumu rezultātiem, izmantojot molekulārās spektroskopijas metodes gan gāzu fāzē, gan inertā vidē ar cēlgāzu matricām. Pēdējā gadījumā tiek izmantota metode, lai atdalītu interesējošo savienojumu no citām molekulām ar inertu šķīdinātāju, piemēram, argonu, lai novērstu ķīmiskas reakcijas vai kompleksu ar citām daļiņām. Saskaņā ar šo pētījumu rezultātiem tika secināts, ka tika noteikts savienojuma (HF) 2 stabilitāte un daudzie parametri. Pašlaik teorētiski tiek pētīta (HF) 2 kompleksa struktūra ar datormodelēšanas metodēm un teorētiskās prognozes precizitāte ir salīdzināma ar eksperimentālo.
Augstākas skaitļošanas prasības. Šķīdinātāji spēcīgāk mijiedarbojas nekā proteīni. Saistītajām ūdens molekulām bieži piemīt īpašības, kas atšķiras no apkārtējā šķīdinātāja ūdens. Vāja saistīšanās mijiedarbība Atkārtošana Kas ir atoms? Atkārtošana Kas ir atoms? Atom - mazākā vielas daļiņa, kas ir ķīmiski nedalāma. Tas sastāv no atomu kodola, kurā ir protoni un neitroni.
Molekulu veidi, vielas un to saites organismos. Organismi sastāv no dažādu vielu molekulām. Atsevišķas vielas veido ķermeni no citām vielām. Šī ir spēcīgākā starpmolekulārā mijiedarbība. Ķīmiskā saite - ja elementu atomi nespēj pilnībā atdalīt eksistenci - atomu piesaiste lielākām vienībām ir stabilāka nekā brīvie atomi - atomi ir sadalīti ar elektronu saistīšanu. Nosacījumi
1 LITERATŪRAS PĀRSKATS
1.1 Ūdeņraža saite
Idejas par ūdeņraža atoma piedalīšanos divu ķīmisko saišu veidošanā (un nevis tās, kas atbilst tās klasiskajai valencei) parādījās 19. gadsimta beigās (Ilinsky, 1887) un 20. gadsimta sākumā (Moore un Vinmil, 1912; Huggins, 1919; Huggins, 1919) . Turpmākā samērā ātra eksperimentālo datu uzkrāšana, lai izskaidrotu, kuras šīs idejas izrādījās noderīgas, ļāva ne tikai pierast pie paša ūdeņraža saites fakta, bet arī sniegt dažus paskaidrojumus par to, kāpēc tā notiek, kāpēc šāda veida saite ir visplašāk izplatīta ūdeņradi saturošiem savienojumiem un ne tik bieži savienojumos, kuros attiecīgie ūdeņraža atomi ir aizvietoti ar citiem, piemēram, sārmu metālu atomiem.
Ķīmiskā saistība Brīvie atomi dabā ir ārkārtīgi ārkārtēji. Elementu elementi mēģina apvienot un radīt elementu vai savienojumu molekulas. Atomi ir ķīmiski saistīti molekulās. Ķīmiskā saistīšana Daži nelieli atkārtojumi Daži nelieli atkārtojumi Kas ir atoms? Nedaudz atkārtojiet Kas ir atoms? Tas sastāv no atomu kodola, kas satur. Josef Kormanik Chemical piemēri.
Orbitāli daudzos elektronu atomos Elektronus piesaista kodolam, bet arī atvaira viens otru. Atstarojošie spēki, ko rada citi elektroni, aizsargā atomu kodola pievilcīgo iedarbību. Lewis formulas ģeometrijas molekulas sniedz informāciju par to, kuri atomi ir saistīti ar saiti un kas ir savienots. Molekulas ģeometrisko izvietojumu raksturo: obligāciju garums.
Ūdeņraža saites ir viena no vājākajām ķīmiskām mijiedarbībām. Ūdeņraža saites enerģija parasti svārstās no 10 līdz 30 kJ / mol, lai gan dažreiz tā sasniedz simtiem kJ / mol. Parastās ķīmiskās saites (kovalentās un jonu) enerģija parasti ievērojami pārsniedz 150 kJ / mol, sasniedzot, piemēram, slāpekļa un oglekļa monoksīda molekulas, vērtības 900 kJ / mol un vairāk. Tomēr pēdējo pusgadsimtu laikā ir izrādījusies skaidra izpratne par vājo mijiedarbību izņēmuma lomu, galvenokārt ūdeņraža saikņu lomu daudzu vienkāršu molekulāru sistēmu, piemēram, ūdens, ūdeņraža fluorīda, un, vissvarīgāk, biopolimēru (nukleīnskābju, olbaltumvielu) stabilizēšanā.
Organiskā ķīmija Studiju gads - gastronomija. Ķīmiskās saites ir kohēzijas spēki, kas darbojas starp atsevišķiem atomiem vai joniem molekulās. Valantiskie elektroni un ķīmiskā saistība Ārējā enerģijas līmenī ir valences elektroni, kas var piedalīties ķīmisko saišu veidošanā. Valences elektronus bieži attēlo punkti.
Molekulārā fizika darbojas, pamatojoties uz vielu un statistikas kinētisko teoriju. Termodinamika, kurā pētītas termiskās parādības un mašīnas, kas nav saistītas ar atsevišķām daļiņām. Molekulārā fizika. Genomiskās datubāzes Ivan Rudolfova vadītāja proteīnu sekvences klasterizācija: Doc. Saturs Proteīni Datu avoti Proteīna struktūras prognozēšana Promocijas darba uzdevumi Ievades dati.
Ūdeņraža saites ļauj polimēru ķēdēm pieslēgties konkrētām trīsdimensiju struktūrām, iegūstot funkcionālu bioloģisko aktivitāti, struktūras, kas, no vienas puses, ir pietiekami stipras (pateicoties lielam skaitam ūdeņraža saites), un, no otras puses, pietiekami reaģē uz izmaiņām ārējos apstākļos (piemēram, molekulu) tieši tāpēc, ka šīs mijiedarbības ir vājas. Šādu obligāciju pārrāvums atņem proteīniem vai nukleīnskābēm to bioloģiskās funkcijas. Tādējādi, jo īpaši, var redzēt ūdeņraža saišu ļoti svarīgo lomu, ko viņi spēlē bioloģiskajos procesos molekulārā līmenī. Ir saprotama arī pētījuma nozīme un izpratne par ūdeņraža obligāciju dabu, kas pēdējā laikā ir saņēmusi tik lielu uzmanību zinātniekiem dažādās jomās.
Atomu struktūra Kāpēc tas ir svarīgi? Visu ķīmisko parādību galīgā interpretācija. Tam jābūt balstītam uz atomu struktūru. Atomu kodols un tā stabilitāte. Atoms ir mazākā materiāla un ķīmiski nedalāmā daļiņa. Tas sastāv no kodola, kas satur protonus un neitronus, un elektronu apvalku. Protonu neitronu elementārās daļiņas.
Līdzīgi molekulai, kurā atomu skaits ir lielāks par vienu, jāatbilst potenciālā reģiona samazinājumam. Šī tiešā mijiedarbība ir brīva telpā, tāpēc ķīmiskās saites netiek ietekmētas kā netieša spin-spin mijiedarbība.
Ilgu laiku dominēja tīri elektrostatisks skatījums: ūdeņraža atoms, kas veido šādu saiti, parasti ir saistīts ar diezgan labi definētu elektronegatīvu atomu, proti, atomu ar augstu elektronu afinitāti, kas samazina elektronu blīvumu uz ūdeņraža atoma salīdzinājumā ar izolēta ūdeņraža atoma blīvumu . Līdz ar to kopējais elektriskais lādiņš uz šāda atoma ir pozitīvs, kas atoms spēj mijiedarboties ar citu elektronegatīvu atomu. Šāda mijiedarbība ar katru no diviem atomiem parasti ir vājāka nekā mijiedarbība ar atomu, ar kuru ūdeņraža atoms sākotnēji bija saistīts. Šāda savienojuma veidošanās ar trešo utt. Atomu ir praktiski neiespējama sakarā ar to, ka dominē elektronegatīvo atomu elektrostatiskā atgrūšana viens no otra. Mūsdienu aprēķini rāda, ka kopējais ūdeņraža atoma daudzums, kas piedalās ūdeņraža saites veidošanā, paliek gandrīz nemainīgs, salīdzinot ar lādiņu monomēra molekulā, kas norāda, kāda būtiska loma ūdeņraža saiknes veidošanā būtu jādara ar polarizāciju, elektronu lādiņa sadalījumu izvēlētās telpas.
Nosaukt vismaz trīs vielu grupas, kas iesaistītas būvniecībā. Tā ir analītiska metode, kuras pamatā ir radiofrekvenču starojuma absorbcija ar paraugu, kas novietots spēcīgā magnētiskā laukā. Organiskā ķīmija Studiju gads - kosmetoloģijas pakalpojumi.
Varick et al., High School Chemistry Review. Visstabilākā atomu elektronu konfigurācija. Ķīmiskā saite ir ķīmiskās saiknes īpašību ķīmiska saite, jo kovalento un koordinātu ķīpu ķīmiskajai saitei σ un π saistība ir vienkārša, divkārša un trīskārša saistīšanās polaritāte.
Pašlaik ķīmiskās saiknes veidošanās interpretācija parasti tiek sniegta molekulāro orbitāļu teorijas valodā, proti, pieņemot, ka molekulas elektroniskās struktūras apraksts ir diezgan labs tuvinājums, kad katram elektronam ir sava viena elektrona funkcija, tās orbitālā.
Parastais ūdeņraža saiknes, kā arī citu veidu ķīmisko saišu rašanās cēlonis galvenokārt ir elektrostatiskā, Coulomb mijiedarbība pret tām daļiņām, kas veido molekulu. Tiesa, šī mijiedarbība atšķiras no klasiskajā teorijā sastopamās mijiedarbības, jo to nenosaka tikai pozitīvo un negatīvo lādiņu sadalījuma blīvums, bet ir izteikts sarežģītāk ar viļņu funkcijām, kas nosaka molekulārās sistēmas stāvokli. Tāpēc ir dabiski censties atrast dažus vienkāršākus attēlus, kas dotu iespēju vizualizēt, kā veidojas ķīmiskā saite.
Proti, molekula, kurā atomu skaits ir lielāks par vienu. Molekulārās fizikas un termodinamikas pamati Molekulārā fizika ir daļa no fizikas, kas pēta vielu īpašības, pamatojoties uz to iekšējo struktūru, kustību un to daļiņu spēku, no kurām tās ir.
Animācijas ķīmija Top Hit Analītiskā ķīmija Neorganiskā analīze Anjonu pierādījums katjonu pierādījums skābekļa pierādījums ūdens pierādījums gravimetriskā analīze masas spektroskopija Ķīmiskā analīze kodolmagnetika. Fizika ir dabaszinātne, kas pēta un apraksta dabas parādību likumus.
Viena no šīm idejām ir balstīta uz elektronu blīvuma pārdales analīzi sistēmas veidošanās laikā: elektronu blīvuma palielināšanās telpā starp kodoliem izraisa elektrostatiskās mijiedarbības palielināšanos starp elektroniem šajā telpā un kodoliem, kam savukārt seko sistēmas enerģijas samazinājums.
Ar atomu skaitu mēs runājam par divām, trim un vairāk atomu molekulām. Toksikodinamika xenobiotiku mijiedarbības toksikodinamika ar mērķa vietu Bioloģiskā reakcija un ksenobiotiska iedarbība uz organismu Toksiska iedarbība Nespecifiska. Aldehīdu nomenklatūra: sistemātisks nosaukums - beigas.
Pusvadītāji. Pusvadītāji ir kristāliskas vai amorfas vielas, kuru elektriskā vadītspēja ir starp metālu un izolatoru elektrovadītspēju un ir atkarīga no temperatūras vai optiskā starojuma. Transporta parādības gāzēs, īstas gāzes, fāzes gradienti, šķidrumi, plūsmas blīvums Mēs pētījām tikai sistēmas, kas bija līdzsvarā, ja sistēma nav spēkā, daļiņu blīvums ir vienāds.
Patiešām, šādam elektronu blīvuma palielinājumam būtu jāpapildina tās samazināšanās citos kosmosa reģionos, un tāpēc ieguldījums enerģijā no šiem reģioniem samazinās. Turklāt elektroniem, kas atrodas salīdzinoši nelielā noteiktā kosmosa apgabalā, būtu jāstiprina viens otru, un tāpēc arī enerģijai vajadzētu palielināties.
Fizikas mācību programma: fizikālā ķīmija Studiju joma: lietišķā ķīmija Specializācija: studiju forma: kopējais nodarbību skaits pētījumā: analītiskā ķīmija Ķīmiskā tehnoloģija Vides aizsardzība. Šķidruma struktūra un īpašības Šķidruma īpašības, Šķidrās virsmas slānis uz cietām virsmām un šķidrumiem Kapilāru parādības, Termiskā tilpuma paplašināšana Šķidruma īpašības Šķidruma forma.
Tādā veidā tiks rakstītas ķīmijas grāmatas un, iespējams, dažas lapas fiziskajā bukletā. Tika pieņemts, ka Hobza tika notiesāta par savu neregulāro ūdens bloku teoriju, jo viņš iebilda pret profesionālām publikācijām. Nesen viņš slavēja čehu zinātnes - ebreju galvu.
Elektronu blīvuma sadalījuma izmaiņu analīze ir noderīgs veids, kā noskaidrot, kas notiek, kad notiek ķīmiskā saite. Vienkāršas pārstāvniecības ne vienmēr darbojas. Tādējādi pašlaik ir zināmas molekulas, kurās ķīmiskās saites veidošanās laikā elektronu blīvums telpā starp kodoliem nav palielinājies, un tomēr ķīmiskā saite ir diezgan reāla.
Tas, kas patiešām notiek ar šo jauno, no pieejamajiem avotiem nav skaidrs. Profesors pats maldina žurnālistu, ka šis atklājums noticis nejauši, un viņam vajadzēja vairākus gadus, lai atrastu drosmi publicēt šo informāciju.
Molekulu un teorētiskās ķīmijas pasaulē tas ir kā mājās, bet mirstīgajam mirstīgajam viņa darbs ir kā spāņu ciems. Pirms tā notiek, redzēsim, kādi ir īsti ūdens bloki. Tā ir vāji saistoša mijiedarbība starp molekulām, ko var pielietot vienas molekulas divās daļās. Tas ir spēcīgāks nekā vairums citu starpmolekulāro spēku, bet aptuveni 10 reizes mazāk jonu vai kovalentu saiti. Ūdeņraža saites rodas starp ūdeņraža atomu un augsti elektronegatīva atoma porainu elektronu pāri.
Ūdeņraža saite tās izcelsmē nav kaut kas atšķirīgs no tā, kas raksturīgs ķīmiskām saitēm kopumā. To nosaka galvenokārt elektronu sadalījuma polarizācija monomērās vienībās (kopumā molekulās, kas veido šādu saiti) un atomu vibrācijas kustības dinamika ūdeņradi saistītā fragmentā, kas atšķiras no monomēra vienībām. Cieša uzmanība sistēmām ar ūdeņraža saišu izpēti jau sen nav noteikta nevis ar šīs saiknes specifiku, bet gan ar ūdeņraža saišu izplatību, jo īpaši bioloģiskajos objektos, un to nozīmīgo lomu biopolimēros un vitāli svarīgos procesos, piedaloties tiem.
Tā kā tikai vienam elektronam ir ūdeņraža atoms, tas saistās ar elektronegatīvu elementu, lai noteiktu atomu kodolu. Iegūtais pozitīvais lādiņš uz ūdens atoma var uztvert apkārtējo molekulu brīvos elektroniskos komponentus. Hidrīda saistīšana ir iespējama tikai ar ļoti elektronegatīviem elementiem, piemēram, fluoru, skābekli un slāpekli. Tikai šie trīs elementi spēj noņemt pietiekami daudz elektronu pietiekamu blīvumu no ūdeņraža atoma.
Visizplatītākais piemērs ir hidroksilgrupa. Skābeklis ir ļoti elektronegatīvs, t.i. ka tas piesaista ūdenim 2 elektronus. Zemāk ir jaunākie ūdeņraža slāņu piemēri starp molekulu sānu grupām. Saites biezums ir saistīts ar saiknes enerģiju, temperatūru un spiedienu.
1.2. Savienojumi ar ūdeņraža saitēm
Daudzos gadījumos, kad ir spēcīga saikne starp molekulām vai vienas un tās pašas molekulas dažādām grupām, šo saiti var attiecināt uz ūdeņraža atomiem, uzrādot divvērtīgu raksturu. Piemēram, tie ir alifātisko skābju, difluorīda jonu, dimeri
un dimera HF, kura struktūra ir parādīta 1.1. attēlā.
1.1. Attēls. Daži ūdeņraža savienojumu piemēri
Ūdeņraža saite palielina starpmolekulāros piesaistītājus, kas būtiski ietekmē noteiktu fizikāli ķīmisko īpašību vērtības pieaugumu. Hidrantu tilti nav ķīmiskas saites, tie ir tikai vāji mijiedarbība, tāpēc vienīgais ūdens bāzes tilts normālā temperatūrā ir pilnīgi nestabils. Bioloģiskajās molekulās tas ir īpaši svarīgi molekulu orientācijai to telpiskajā izvietojumā un var būtiski stabilizēt molekulas, ja molekulā ir liels skaits ūdens bloku.
Ūdeņradis kalpo kā savienojuma atoms citā svarīgā savienojumu klasē - borshidrīdi. Vienkāršākais šīs ģimenes loceklis ir diborāns (B 2 H 6). Tomēr borohidrīdus parasti neuzskata par savienojumiem ar ūdeņraža saiti, jo tos nevar iedalīt fragmentos, kas ir stabilas molekulas. Mēs uzskatām, ka šie savienojumi ir salīdzināmi ar kompleksiem ar ūdeņraža saiti.
Borovodoroda tika saukta par elektronu deficītu molekulām (termins elektronu deficīts, ko piemēro boronhidrīdiem, nav pilnībā pamatots, jo visos gadījumos elektroniem ir pietiekami daudz visu saistošo molekulāro orbītu aizpildīšanai), jo tiem nav pietiekami daudz elektronu, lai veidotu šo divu elektronu obligāciju daudzumu, kas to molekulārā ģeometrija. Diborānam ir astoņas B-H obligācijas, bet tikai četrpadsmit valences elektroni. Aprēķini, kuru pamatā ir molekulāro orbitāļu metode, liecina, ka gala saites ir normālas divu elektronu saites, un tiltu saites jāapraksta kā trīs centru divu elektronu saites.
Apraksts, kas pamatojas uz difluorīda jonu molekulāro orbitāļu metodi, ir pilnīgi atšķirīgs no diborāna apraksta, jo tilta saites veidošanai ir četri elektroni. Molekulas līdzsvara konfigurācija ir lineāra, un ūdeņradis atrodas F-F segmenta vidū. Divi visaugstāk piepildīti molekulārie orbīti galvenokārt veidojas no 2 p σ -orbitols fluors l s -orbīta ūdeņradis ar nelielu papildinājumu 2 s - fluoru bāzēm. Vismazākajai no abām orbitālēm ir simetrija σ g un ir saistošs visiem trim atomiem. Augstāka orbītā σ u (tās vieta ir uz ūdeņraža atoma) - atraisīšanās attiecībā pret fluoru atomiem. Tomēr fluora atomi ir diezgan tālu viens no otra, tā ka vaļīgums ir mazs, un orbītā σ u tai ir negatīva enerģija (t.i., saistās ar elektroniem), jo fluora atoms ir lielā elektronegativitāte.
Var konvertēt σ g - un σ u orbitāli līdzvērtīgiem orbitāliem θ 1 = σ g + σ u un θ 2 = σ g – σ u , kas izvietotas uz divām F-H obligācijām, kas parāda atšķirību no tiltiem borohidrīdos, kuru orbītas nevar lokalizēt uz obligācijām.
Difluorīds nav raksturīgs savienojumiem ar ūdeņraža saitēm, jo ūdeņraža atoms atrodas vidū starp diviem smagiem atomiem. Parasti ūdeņraža saišu enerģija ir daudz zemāka nekā difluorīda jonam, un ūdeņradis ir ciešāk saistīts ar kādu no atomiem, nekā ar otru, tāpat kā skudru dimers (1.1. Attēls). Faktiski abu komponentu, kas veido kompleksu, ģeometrija nedaudz atšķiras no to ģeometrijas izolētos stāvokļos.
1.1. Tabula. Dažu gāzu fāzu dimeru enerģijas dimerizācija ar ūdeņraža saiti
1,3 HF dimērs
1.3.1 Ģeometriskā konfigurācija, svārstības, saistošā enerģija
1.2. Attēlā ir parādīta kompleksa līdzsvara ģeometriskā konfigurācija - gan skaidra, gan neparedzama. Visi četri atomi atrodas vienā plaknē. Attālumi starp fluoru un ūdeņraža atomiem, kas pieder pie Fb – Hb un F f –H f kompleksa savienojuma (monomēra) daļām, ir attiecīgi 0,922 Å un 0,920 Å, un nedaudz atšķiras no līdzsvara attāluma 0,917 Å HF molekulā. Attālums starp H b ... Ff atomiem ir 1,82 Å, kas ir raksturīgs ūdeņraža saitei. Visu trīs ūdeņraža saites F b –H b ... F f dalībnieku izvietojums ir tuvs lineārajam. Tie visi ir paredzami starpmolekulārā kompleksa ar ūdeņraža saiti iezīmes. Neparedzami no vienkāršiem principiem ir leņķi θ 1 = 7 (starp virzieniem F b F f un F f H b) un θ 2 = 69 (F b F f un F f Hf).

1.2. Attēls. Kompleksa (HF) līdzsvara ģeometriskā konfigurācija 2
Apsveriet, kā šie rezultāti tika iegūti. Ūdeņraža fluorīda (HF) n oligomēri veidojas gāzes pārpalikumā, kas pavairojas ar virsskaņas ātrumu un kas plūst no šauras tvertnes ar HF vielu zemās temperatūrās. Gāzes sastāvu kontrolē ar masas spektrālajām metodēm, kas ļauj atšķirt gāzes komponentus pēc masas, tas ir, atšķirt oligomērus ar dažādām n vērtībām. Izvēloties apstākļus, ir iespējams nodrošināt, ka dimeriskie kompleksi (HF) 2 tiek pakļauti pētījumam.
Spektrometra kamerā molekulārais starojums ir pakļauts elektromagnētiskajam starojumam no noteikta viļņa garuma (vai frekvenču) diapazona avota, un pētāmās sistēmas spektrs ir fiksēts. Spektrālās līnijas mikroviļņu diapazonā, kā minēts iepriekš, satur informāciju par molekulas rotāciju, un joslu relatīvais stāvoklis ir atkarīgs no sistēmas ģeometriskās konfigurācijas. 19 300–19 340 MHz diapazona joslu interpretācija daļēji cietā augšējā modeļa ietvaros ļāva noteikt spektra atbilstību attēlā parādītajai struktūrai. 1, ar attālumu starp fluora atomiem Fb-Ff 2.72? 0,03 B un leņķi q1 = 10? 6? un q2 = 63? 6?. Līdzīgi leņķi patstāvīgi iegūti citā laboratorijā: q1 = 7? 3? un q2 = 60? 2?.
Turpmākajā eksperimentu sērijā tika pētīts spektra infrasarkanais (IR) diapazons. Saskaņā ar molekulu struktūras teorijas pamatmodeliem spektrālo līniju izvietojums šajā reģionā ietver informāciju par molekulas daļiņu vibrācijām ap līdzsvara stāvokli, šajā gadījumā par mazām periodiskām atomu nobīdēm no 1. attēlā parādītajām pozīcijām. 1. Katrai molekulai šādu vibrāciju skaitu unikāli nosaka atomu skaits, un (HF) 2 kompleksam tas ir seši. Molekulāro spektroskopijā parasti ir izteiktas svārstību frekvences vienībās, kas norāda pilnu viļņa skaitu konkrētā garumā, novietotas 1 cm attālumā, un attiecīgi runā par frekvenču vērtībām, kas izteiktas apgrieztos centimetros (cm-1), vai līdzvērtīgi viļņos numurus. Lai gan katrā svārstībā ar noteiktu frekvenci visi molekulas atomi piedalās vienā vai otrā veidā, atkal, modelēšanas koncepciju ietvaros, var izvēlēties svārstības (un attiecīgi joslu IR spektrā) par izvēlēto atomu grupu. Daudzos gadījumos šis sadalījums veicina būtiskas svārstību frekvences atšķirības, kā tas ir mūsu piemērā (HF) 2.
Ūdeņraža fluorīda dimēra vibrācijas frekvences, kas novērtētas no spektrālajiem joslas platumiem gāzes fāzē un inertās matricās, ir skaidri sadalītas intramolekulāros (tas nozīmē, molekulārās vibrācijas, kuru asociācija veido kompleksu) ar vērtībām aptuveni 4000 cm-1 un starpmolekulārajām vērtībām, kuru vērtības ir mazākas par 500 cm-1. Augstas frekvences ir saistītas ar Ff-Hf (3931 cm-1) un Fb-Hb (3868 cm-1) grupu vibrācijām. Zemas frekvences (475, 395, 161 un 125 cm-1) raksturo svārstības, kas maina Ff-Hf un Fb-Hb fragmentu relatīvo orientāciju, atomu aizplūšanu no plaknes un izmaiņas Fb_Ff attālumā.
IR līniju intensitāti var saistīt (atkal konkrēta molekulas modeļa ietvaros) ar tik svarīgu kompleksa īpašību kā disociācijas enerģiju divās monomērās molekulās. Tā pati vērtība nosaka kompleksa saistošo enerģiju. Saskaņā ar eksperimentālajiem datiem, tas ir 19,35? 0,71 kJ / mol. Tādējādi spektru interpretācija noved pie molekulāro konstantu kopas - attālumu starp atomiem, leņķiem, vibrācijas frekvencēm, enerģijām, kas pietiekami raksturo molekulārās sistēmas struktūru.
Tagad mēs pievēršamies teorētiskai pieejai. Visas konstrukcijas ir balstītas uz modeli, saskaņā ar kuru komplekss (HF) 2 ir četru kodolu sistēma (divi protoni un divi F9 + kodoli) un 20 elektroni, tas ir, punktu daļiņas, kas savstarpēji mijiedarbojas pa Coulomb likumu. Modelī vairs netiek ievietota sākotnējā informācija, kas padara šādu molekulu īpašību aprēķinus tik pievilcīgus. Šai četru kodolu un 20 elektronu sistēmai skaitļošanas kvantu ķīmijas metodes aprēķina potenciālo enerģijas virsmu - enerģijas atkarību no kodolu koordinātām. Protams, jums ir nepieciešama piekļuve datoriem un diezgan sarežģīta programmatūra, bet tagad sistēmai, piemēram, (HF) 2, ļoti labus rezultātus var iegūt ar personālo datoru, piemēram, Pentium, ļoti reālā laikā, lai gan ir nepieciešama pacietība un noteiktas prasmes.
Viens no datora aprēķinu rezultātiem ir punktu klāsts: enerģija kā funkcija šajā gadījumā, (HF) 2 kompleksa sešas iekšējās koordinātas (iekšējo koordinātu skaits sakrīt ar molekulārās sistēmas vibrācijas pakāpi). Šīs sešdimensiju virsmas reljefs ir diezgan sarežģīts, ar minimāliem, maksimāliem, seglu punktiem. Ideja par zemes elektroniskā stāvokļa potenciālās virsmas divdimensiju šķērsgriezumu atkarībā no leņķa koordinātēm q1 un q2 ir dota 5. attēlā. 2, un visi pārējie ģeometriskie mainīgie tiek pielāgoti tā, lai to enerģētiskās vērtības būtu minimālas. Att. 2 attēlotas izejas enerģiju līniju aprēķinātās kontūras, atdalīto HF monomēru molekulu enerģija tiek uzskatīta par nulles atskaites punktu, negatīvo enerģiju apgabali ir atzīmēti zilā krāsā, kur (HF) 2 komplekss ir kopumā, sarkanais ir pozitīvo enerģiju reģions. Izolējošās kontūras tiek kondensētas ap stacionāriem punktiem - minimumi, seglu punkti. Dziļākā minimālā punkta koordinātas (tumšzilā krāsa 2. attēlā pie | q1 | = 7?, Q2 = 69?) Nosakiet kompleksa līdzsvara ģeometrisko konfigurāciju. Att. 2 ir simetrisks ap diagrammas lauka diagonāli, kas atspoguļo divu kompleksa struktūru līdzvērtību.
Att. 1 parāda koordinātu vērtības, kas iegūtas visprogresīvākajā šobrīd kvantu ķīmiskajā aprēķinā. Iepriekšminētās vērtības tiek noteiktas eksperimentos, un abu pieeju kompleksa (HF) 2 pētījumu rezultātu piekrišanu var uzskatīt par izcilu. No aprēķina piesaistes enerģija tiek noteikta arī no enerģijas atšķirības līdzsvara ģeometriskajā konfigurācijā (HF) 2 un divu nesavienojošu HF molekulu enerģiju. Vislabāk iegūtā vērtība (19,23 kJ / mol) lieliski atbilst arī eksperimentāli noteiktajai enerģijai (19,35? 0,71 kJ / mol).
Vēl viena eksperimentālo datu sērija ļāva mums noteikt kompleksa svārstību frekvences. Svārstīgo problēmu risinājums ir nākamais posms molekulu struktūras modelēšanai pēc potenciālās enerģijas virsmas būvniecības. Vienkāršākajā tuvināšanā ir nepieciešams noteikt potenciālās virsmas izliekumu attiecībā pret visām iekšējām koordinātām pie minimālās pozīcijas un tādējādi novērtēt atsperu stīvuma koeficientus, kas imitē vibrācijas pa molekulas saitēm un leņķiem. Stingruma koeficientu kombinācija, ko aprēķina kā otrās enerģijas atvasinājumus ar koordinātām, veido molekulas spēka lauku. Tad, izmantojot zināmu atomu masas kopumu, līdzsvara ģeometriskos parametrus un spēka lauku, vibrācijas frekvenču kopums ir viegli aprēķināms. (HF) 2 kompleksam šī problēma tika atrisināta vairākas reizes, un aprēķinātās frekvences labi vienojas ar eksperimentālajiem.
Atsauces
1. Ūdeņraža saite / Ed. N. D. Sokolovs. M: Science, 1989.
2. Ovchinnikov Yu A. Bioorganiskā ķīmija. - M.: Apgaismība, 1987. - 815 lpp., Ill.
3. Vitkovskaja N. M. Molekulāro orbitāļu metode: pamatidejas un svarīgas sekas // Sorosa izglītības žurnāls. 1996. № 6. S. 58-64.
4. Stepanovs N. F. Ķīmiskā saistība vienkāršās diatomiskās molekulās // Sorosa izglītības žurnāls. 1998. № 10. S. 37-43.
5. Stepanovs N. F. Potenciālās virsmas un ķīmiskās reakcijas // Sorosa izglītības žurnāls. 1996. № 10. S. 33-41.
6. Marrell J., Kettle S., Tedder J. Chemical bond. M: Mir, 1980. 384 p.
7. Nemukhin A. V. Ūdeņraža fluorīda dimeers: vienkāršākā kompleksa struktūra ar ūdeņraža saiti // Sorosa izglītības žurnāls. 1998. № 7. S. 65-69.
8. Vilkova L.V. Fizikālās izpētes metodes ķīmijā // Sorosa izglītības žurnāls. 1996. № 5. S. 35-40.
9. Nekrasov B. Gadsimts Vispārīgā ķīmija. M: Goskhimizdat, 1962. 973 lpp.
10. Salem L. Elektroni ķīmiskās reakcijās. M: Mir, 1985. 285 lpp.
11. Khobza P., Zahradnik R. Intermolekulārie kompleksi. M: Mir, 1989. 376 lpp.
12. Nemukhin A.V., Weinhold F., Lūisa koncepcija mūsdienu kvantu ķīmijā, Rus. ķīmiskās vielas žurnāliem (Journal. Ros. Chemical. Salas viņiem. DI Mendedeeva). 1994. T. 38. S. 5-11.
13. Nemukhin A.V. Klasteru šķirne // Sorosa izglītības žurnāls. 1996. T. 40. S. 48-56.
Ievads
Papildus dažādām heteropolārajām un homeopolārajām obligācijām ir vēl viens īpašs obligāciju veids, kas pēdējo divu desmitgažu laikā ir piesaistījis arvien lielāku ķīmiķu uzmanību. Tā ir tā sauktā ūdeņraža saite. Izrādījās, ka ūdeņraža atoms var veidot saikni starp diviem elektronegatīviem atomiem (F, O, N, retāk Cl un S). Ir gadījumi, kad šī saikne veido ūdeņraža atomu, kas saistīts ar oglekļa atomu HSCX3 tipa savienojumos, kur X ir elektronegatīvs atoms vai grupa (piemēram, HCN, hidrofluorogļūdeņraži). Lai gan ūdeņraža saiknes raksturs vēl nav pilnībā noskaidrots, tomēr jau var izdarīt skaidru priekšstatu par to.
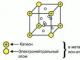
Starp elektronegatīviem atomiem veidojas ūdeņraža saite, no kuras vismaz viens ir brīvs elektronu pāris, piemēram:
Ūdeņraža savienošana ir globāla parādība, kas aptver visu ķīmiju.
1. Ūdeņraža saites būtība un būtība
Pirmo ūdeņraža saiknes zinātnisko interpretāciju 1920. gadā sniedza V. Latimers un V. Rodebush, kas strādāja kovalento obligāciju teorijas dibinātāja G. Lūisa laboratorijā, skābes un bāzu teorijas autore un auglīga organiskā ķīmijā, vispārinātā elektronu pāri. Autori izskaidroja ūdens īpašo fizikālo un ķīmisko īpašību iemeslu ar ūdeņraža saiti, kuras būtība ir vienas molekulas ūdeņraža atoma mijiedarbība ar citas molekulas skābekļa atoma elektronu pāri. Šajā gadījumā ūdeņraža atoms vienlaicīgi saistās ar diviem skābekļa atomiem ar kovalentu un ūdeņraža saiti:
Visu turpmāko laiku līdz mūsu dienām būtiskā pieeja ūdeņraža saiknes interpretācijai nav mainījusies, vientuļo protonu koncepcija paliek nemainīga. Ilgi un intensīvi pētījumi ļāva noskaidrot savienojumu struktūras ietekmi uz H-obligāciju veidošanās tendenci, pēdējo elektronisko raksturu ir ieviesusi skaidrība, ir konstatētas uzticamas metodes to identificēšanai. Un pats svarīgākais ir tas, ka ir veikta plaša vispārināšana, novērtējot H-obligāciju ietekmi uz vielu fizikālajām un ķīmiskajām īpašībām. Butlerovo disertācijas „struktūra definē īpašības” tiek atklāta, ņemot vērā H-saites veidošanās iespēju un tā ieguldījumu īpašās īpašībās. Tālāk ir sniegts galīgais materiāls par ūdeņraža saiknes problēmas jautājumiem.
Saskaņā ar mūsdienu terminoloģiju ūdeņraža saites veidošanās notiek, kad protonu donors (Brønsted skābe, elektronu akceptors) mijiedarbojas ar protonu akceptoru (bāzi, elektronu donoru). Apspriežamo procesu shematiskajam attēlojumam protonu donoru molekulu apzīmē ar A-H (un gadījumiem, kad ir nepieciešams norādīt atomu, kas kovalenti saistīts ar ūdeņradi, R-X-H). Protonu akceptors ir apzīmēts ar: B (gan bāzes, gan atoma ar vientuļo elektronu pāru simbolisko apzīmējumu) vai B-Y. Ņemot vērā pieņemto simbolu, ūdeņraža saiti var attēlot kā nesaistītu mijiedarbību starp vienas molekulas X-H grupu un citas B atomu, kā rezultātā izveidojas stabils A-H… B komplekss ar starpmolekulāro ūdeņraža saiti, kurā ūdeņraža atoms spēlē tiltu, kas savieno fragmentus A un V. Mēs atzīmējam, ka līdz šim nav nepārprotamas pieejas, kas konkrētai saitei būtu jāsauc par ūdeņradi. Vairums autoru atsaucas uz ūdeņraža savienojuma jēdzienu, kas rada papildu mijiedarbību starp ūdeņraža atomu un elektronu donoru B, proti, H… B saiti. Citi autori atsaucas uz ūdeņraža saiknes jēdzienu visai ķēdei XH ... B, ti, saikni starp atomiem X un B caur ūdeņraža tiltu. Koncentrējoties uz lielāko daļu, ūdeņraža saites (garuma, enerģijas) īpašības tiks attiecinātas uz H ... B saiti, zinot, ka pēdējo veidošanās nevar ietekmēt kovalento H-H saiti.
Ūdeņraža saites sākumposmā tika uzskatīts, ka ūdeņraža tilts veidojas tikai starp atomiem ar augstu elektronegativitāti (F, O, N). Pēdējo desmitgažu laikā, kad pētnieku rokās parādījās uzlabotas iekārtas, atomu klāsts - ūdeņraža savienošanas partneri - ir ievērojami paplašināts (Cl, S un daži citi). Atoms X var būt jebkurš atoms, kas ir vairāk elektronegatīvs nekā ūdeņraža atoms, un veido parasto ķīmisko saiti ar pēdējo (piemēram, oglekļa atomu). Ūdeņraža atoma akceptors var būt vai nu atomi ar vientuļiem elektronu pāriem (dažos gadījumos pat argonu un ksenonu), vai savienojumi arπ savienojumi.
Ņemot vērā savienojumu, kas, iespējams, spēj veidot H-saites, raksturu, mēs varam viegli redzēt, ka ūdeņraža saiknes veidošanos var attēlot kā skābes-bāzes mijiedarbību, kas nosaka protonu pārneses pirmo posmu protolītisko reakciju laikā.
A-H +: BA-H ... BA- ... H-B + A- + HB +
Šādas mijiedarbības novēro skābes šķīdumos. Ja produktam A-H nav izteiktas skābuma vai, ja nav piemērota šķīdinātāja, skābes-bāzes mijiedarbības process apstājas molekulārā kompleksa stadijā.
Neskatoties uz H-obligāciju vispārēju pieņemšanu, literatūrā vēl nav izveidots vienots viedoklis par šīs parādības būtību. Jautājums joprojām ir apstrīdams. Pirms iezīmējam moderno skatījumu par ūdeņraža obligāciju veidošanos atbildīgo spēku būtību, mēs atzīmējam svarīgākos šī procesa eksperimentālos faktus.
I. Kad veidojas ūdeņraža saites, tiek izdalīts siltums - H-saites enerģijas termoķīmiskais rādītājs. Šo raksturlielumu izmanto, lai kalibrētu spektrālās metodes ūdeņraža saišu izpētei.
Ii. Attālums starp kaimiņu atomiem, kas iesaistīti ūdeņraža saites veidošanā, ir daudz mazāks par to van der Waals rādiusu summu. Tātad ūdenī attālums starp skābekļa atomiem OH sistēmā ... O ir 0,276 nm. Ja pieņemam, ka OH kovalentās saiknes garums ir 0,1 nm, tad H ... O saiknes garums būs 0,176 nm, tas ir, tas ir ievērojami (aptuveni 70%) garāks par kovalento saiti starp šiem atomiem. Tomēr H… O saite ir ievērojami īsāka nekā van der Waals rādiusu summa, kas veido attiecīgi 0,12 un 0,14 nm ūdeņraža un skābekļa. Pēdējais apstāklis ir viens
no kritērijiem, kas norāda uz ūdeņraža saišu veidošanos starp molekulām.
Iii. Ūdeņraža saite palielina X-H saiti, kas noved pie atbilstošās stiepšanās vibrācijas joslas pārejas uz IR spektru uz zemākām frekvencēm. IR-spektroskopijas metode ir galvenā metode, lai pētītu ūdeņraža saiti.
Iv. Veidojot ūdeņraža saiti, palielinās X-H saite, kas noved pie molekulārā kompleksa dipola momenta pieauguma, salīdzinot ar aprēķinātajiem datiem, kas iegūti, pievienojot R-X-H un B-Y molekulu dipolu.
V. Ūdeņraža saitē iesaistītie protoni ir raksturoti ar zemāku elektronu blīvumu, tāpēc tie ir nekontrolēti, kas noved pie atbilstošo rezonanses signālu nozīmīgas novirzes 1H NMR spektros uz vāju lauku. Protonu magnētiskā rezonanse kopā ar IR spektriem ir visjutīgākā pret H-saites veidošanos.
Vi. Starpmolekulārām ūdeņraža saitēm ar jonu pāru molekulārā kompleksa skābes-bāzes līdzsvara nobīde pa labi parādās, palielinot šķīdinātāja polaritāti.
Papildus tam tiek reģistrētas arī citas ūdeņraža saišu strukturālās un spektroskopiskās iezīmes, kuras, no vienas puses, tiek izmantotas, lai identificētu tās, un, no otras puses, atšifrētu to elektronisko raksturu. Tā kā ūdeņraža saite rodas tikai tad, ja ūdeņraža atoms ir saistīts ar elektronegatīvu atomu, iepriekš tika pieņemts, ka ūdeņraža saiknes raksturs samazinās līdz dipola-dipola mijiedarbībai ar RX-d – H + d… B-d –Y veidu, ko sauc arī par elektrostatiskā mijiedarbība. Šo pieņēmumu apstiprina fakts, ka spēcīgākās ūdeņraža saites veido ūdeņraža atomi, kas saistīti ar visvairāk elektronegatīviem elementiem. Augstāko ūdeņraža saites stiprumu, salīdzinot ar nespecifisko dipola-dipola mijiedarbību (apmēram 10 reizes), var izskaidrot ar ūdeņraža atoma mazo izmēru, lai tā varētu tuvoties citam dipolam. Dipola modelis izskaidro arī ūdeņraža saiknes lineāro ģeometriju, jo ar atomu lineāru izkārtojumu pievilcīgie spēki ir maksimāli un atbaidošie spēki ir minimāli.
Tomēr ne visi ūdeņraža saišu pētījumā ierakstītie eksperimentālie fakti var tikt izskaidroti tikai pamatojoties uz dipola - dipola mijiedarbību. Nav iespējams novērot regulāru saikni starp ūdeņraža saites enerģiju un dipola momentu vai mijiedarbīgo molekulu polarizējamību. Mazais ūdeņraža saišu garums norāda uz būtisku Van der Waals rādiusu pārklāšanos. Vienkāršs elektrostatiskais modelis neņem vērā viļņu funkciju pārklāšanos, elektronu blīvuma pārdalīšanu, kad molekulas savstarpēji saskaras. Šos jautājumus var atrisināt, pieņemot, ka ūdeņraža saite ir daļēji kovalentiska sakarā ar donora-akceptora mijiedarbību starp elektronu donoru B ar elektronu akceptoru A - X - H. Elektronu blīvuma pieaugums uz X atoma notiek caur starpnieku - ūdeņraža tiltu. Šajā gadījumā ir pieļaujama daļēja ūdeņraža atoma nesaistošo orbītu aizpildīšana.
Tādējādi H-saites veidojas, vienlaicīgi parādot šādus spēkus: elektrostatisko mijiedarbību un lādēšanas pārnesi. Kvantu ķīmiskie aprēķini rāda, ka galveno ieguldījumu veic pirmais komponents. Ūdeņraža obligācijās, kas būtiski atšķiras enerģijas raksturlielumos, arī šo iemaksu attiecība ir atšķirīga. Ir citi paskaidrojumi par ūdeņraža saiknes raksturu, kas nav vispārpieņemti.
Pabeidzot H-obligāciju dabu, var atzīmēt, ka praktizējošajam ķīmiķim ir vieglāk atpazīt šīs parādības esamību, nevis izskaidrot tās būtību. Ūdeņraža saišu daudzveidība ir iemesls vienotas pieejas trūkumam to interpretācijā. Ir pat grūti iedomāties, ka ūdeņraža saites raksturojums difluorīda anjonā (FHF) - un С-H ... Cl sistēmā var tikt izskaidrots no vienotas pozīcijas. Viena no grūtībām ir galvenais aktieris - ūdeņraža atoms, kam ārējā apvalkā nevar būt vairāk par diviem elektroniem. Tāpēc divu koordinētu ūdeņraža atoma jēdziens tiek uztverts neskaidri. Visticamāk, ka nebūs vienota pieeja, lai izskaidrotu H-saites raksturu. Tiks izveidots kāds vispārinošs modelis, ņemot vērā dažādu dabas spēku ieguldījumu, proti, ievērojami paplašināto versiju tam, kas mums pašlaik ir.
2. Ūdeņraža saites noteikšana
Saistība, kas veidojas starp vienas molekulas ūdeņraža atomiem un spēcīgi elektronegatīva elementa atomu (O, N, F), tiek saukta par ūdeņraža saite.
Var rasties jautājums: kāpēc tieši ūdeņradis veido šādu specifisku ķīmisko saiti?
Tas ir tāpēc, ka ūdeņraža atomu rādiuss ir ļoti mazs. Turklāt, kad viens elektrons tiek pārvietots vai pilnībā atgūts, ūdeņradis iegūst relatīvi augstu pozitīvo lādiņu, kura dēļ vienas molekulas ūdeņradis mijiedarbojas ar elektronegatīviem atomiem, kuriem ir daļēja negatīva lādiņa, kas nonāk citās molekulās (HF, H20, NH3) .
Apsveriet dažus piemērus. Parasti mēs attēlojam ūdens sastāvu ar ķīmisko formulu H 2 O. Tomēr tas nav pilnīgi precīzs. Būtu pareizi norādīt ūdens sastāvu ar formulu (H 2 O) n, kur n = 2,3,4 utt. Tas izskaidrojams ar to, ka atsevišķas ūdens molekulas ir savstarpēji savienotas ar ūdeņraža saitēm.
Ūdeņraža saiti parasti apzīmē ar punktiem. Tas ir daudz vājāks par jonu vai kovalentu saiti, bet spēcīgāks nekā parastā starpmolekulārā mijiedarbība.
Ūdeņraža saites esamība izskaidro ūdens tilpuma pieaugumu, samazinoties temperatūrai. Tas ir saistīts ar to, ka, samazinoties temperatūrai, molekulas tiek stiprinātas, un tāpēc to iepakošanas blīvums samazinās.
Organiskās ķīmijas pētījumā bija šāds jautājums: kāpēc spirtu viršanas temperatūra ir daudz augstāka par atbilstošajiem ogļūdeņražiem? Tas izskaidrojams ar to, ka ūdeņraža saites veido arī alkohola molekulas.
Alkoholu viršanas punkta palielināšana ir arī to molekulu paplašināšanās dēļ. Ūdeņraža saite ir raksturīga arī daudziem citiem organiskajiem savienojumiem (fenoliem, karboksilskābēm utt.). No organiskās ķīmijas un vispārējās bioloģijas kursiem ir zināms, ka ūdeņraža saites klātbūtne izskaidro proteīnu sekundāro struktūru, DNS dubultā spirāles struktūru, tas ir, komplementaritātes fenomenu.
3. Ūdeņraža saites veidi
Ir divu veidu ūdeņraža saites, intramolekulāras un starpmolekulāras ūdeņraža saites. Ja ūdeņraža saite apvieno vienas molekulas daļas, tad viņi runā par intramolekulāru ūdeņraža saiti. Tas īpaši attiecas uz daudziem organiskiem savienojumiem. Ja ūdeņraža saite veidojas starp vienas molekulas ūdeņraža atomu un citas molekulas nemetāla atomu (starpmolekulāro ūdeņraža saiti), tad molekulas veido diezgan spēcīgus pārus, ķēdes, gredzenus. Tādējādi skudrskābe ir dimeru formā gan šķidrā, gan gāzveida stāvoklī:
un ūdeņraža fluorīda gāzē ir polimēra molekulas, kas satur ne vairāk kā četras HF daļiņas. Spēcīgas saiknes starp molekulām var atrast ūdenī, šķidrā amonjaka, spirtu. Skābekļa un slāpekļa atomi, kas nepieciešami ūdeņraža saites veidošanai, satur visus ogļhidrātus, proteīnus, nukleīnskābes. Piemēram, ir zināms, ka glikoze, fruktoze un saharoze ūdenī ir pilnīgi šķīstoši. Ne pēdējo lomu šajā spēlē spēlē ūdeņraža saites, kas veidojas šķīdumā starp ūdens molekulām un daudzām OH ogļhidrātu grupām.
4. Ūdeņraža saites enerģija
Ūdeņraža saišu raksturošanai ir vairākas pieejas. Galvenais kritērijs ir ūdeņraža saistīšanās enerģija (R - X - H … B - Y), kas ir atkarīgs gan no X un B atomu rakstura, gan uz RXH un BY molekulu vispārējo struktūru. Galvenokārt tas ir 10–30 kJ / mol, bet dažos gadījumos tas var sasniegt 60–80 kJ / mol un pat augstāku. Atbilstoši enerģijas raksturlielumiem atšķirt stipras un vājas ūdeņraža saites. Spēcīgu ūdeņraža saišu veidošanās enerģija ir 15–20 kJ / mol vai lielāka. Tie ietver O-H obligācijas … O ūdenī, spirtos, karboksilskābēs, O-H saistībās … N, N - H … O un N - H … N savienojumos, kas satur hidroksilgrupas, amīda un amīna grupas, piemēram, proteīnos. Vājas ūdeņraža saites veidošanās enerģija ir mazāka par 15 kJ / mol. Ūdeņraža saites enerģijas apakšējā robeža ir 4–6 kJ / mol, piemēram, C-H saite … Par ketoniem, ēteriem, organisko savienojumu ūdens šķīdumiem.
Spēcīgākās ūdeņraža saites veidojas gadījumos, kad neliels ūdeņradis (cietā skābe) vienlaicīgi ir saistīts ar diviem maziem, ļoti elektronegatīviem atomiem (cietām bāzēm). Orbitālā korespondence nodrošina labāku skābes-bāzes mijiedarbību un rada spēcīgākas ūdeņraža saites. Tas ir, spēcīgu un vāju ūdeņraža saišu veidošanos var izskaidrot no cieto un mīksto skābju un bāzu koncepcijas (Pearson princips, CML princips).
H-saites enerģija palielinās, palielinoties pozitīvajam lādiņam uz X-H saita ūdeņraža atoma un palielinoties B atoma protonu akceptoram (tā bāziskumam). Lai gan ūdeņraža saišu veidošanās tiek uzskatīta no skābes-bāzes mijiedarbības viedokļa, tomēr H-kompleksu veidošanās enerģija ir vaļīgi korelēta gan ar skābuma skalu, gan ar bāziskuma skalu.
Līdzīgs modelis ir novērojams merkaptānu un spirtu gadījumā. Mercaptans ir spēcīgākas skābes nekā spirti, bet spēcīgāki partneri veido spirtus. Šādu acīmredzamu anomāliju iemesls ir saprotams, jo skābumu nosaka vērtība pКа saskaņā ar skābes-bāzes mijiedarbības pilnas shēmas rezultātiem (pirms solvātu jonu veidošanās), un molekulārā kompleksa veidošanās ar H-saiti ir tikai šī procesa pirmais posms, kas neietver X-H saita laušanu. Inertos šķīdinātājos skābes-bāzes mijiedarbība parasti apstājas H-kompleksa stadijā.
Attiecībā uz organisko savienojumu bāziskumu un to spēju piedalīties H-saites veidošanā ir arī lielas atšķirības. Tātad, ar tādu pašu spēju veidot ūdeņraža saites, amīnu bāziskuma pakāpe ir 5 kārtas lielākas nekā piridīniem un 13 kārtas augstākas nekā aizvietoto karbonil savienojumu.
Pamatojoties uz eksperimentāliem datiem, tika noteikta lineāra korelācija starp maksas pārneses pakāpi un starpmolekulāro H-obligāciju enerģiju, kas ir svarīgs arguments par labu donora-akceptora dabai. Sterīnie faktori var būtiski ietekmēt ūdeņraža saites veidošanos. Piemēram, orto-aizvietoti fenoli ir mazāk pakļauti pašregulācijai nekā attiecīgie meta- un para-izomēri, kas pilnībā nav sastopami 2,6-di- rubs.-butilfenols. Pieaugot temperatūrai, molekulāro kompleksu skaits maisījumā samazinās, un tie ir daudz mazāk izplatīti gāzes fāzē.
Kursa sākumā tika atzīmēts, ka ūdeņraža saite aizņem starpposmu starp patieso (valences) ķīmisko saiti un vāju starpmolekulāro mijiedarbību. Kur ir tuvāk? Atbilde ir neskaidra, jo H-obligāciju enerģiju svārstību diapazons ir diezgan plašs. Ja mēs runājam par spēcīgām ūdeņraža saitēm, kas var būtiski ietekmēt vielu īpašības, tad tās ir tuvāk īstām ķīmiskām saitēm. Un to nosaka ne tikai H-obligāciju samērā augstā enerģija, bet arī tas, ka tas ir lokalizēts kosmosā, ūdeņraža tiltam ir “personīgie” partneri. Arī ūdeņraža saites darbības virziens ir fiksēts, lai gan tas nav tik stingrs kā īstām ķīmiskām saitēm.
5. Ūdeņraža saites ar organisko savienojumu īpašībām
Ūdeņraža saite notiek laikā, kad mijiedarbojas skābes X-H un B grupas, kas pieder pie tām pašām vai dažādām molekulām. Apvienojot tās pašas molekulas, veidojas asociētie uzņēmumi, dažādu molekulu apvienošana parasti tiek saukta par molekulārajiem kompleksiem (H kompleksiem). Šādas mijiedarbības ir visplašākā H-obligāciju klase, ko sauc par starpmolekulārajām ūdeņraža saitēm. Intermolekulārās mijiedarbības neaprobežojas ar bināro kompleksu veidošanos, bet var izraisīt struktūras ar vairākām saitēm (ūdens, ūdeņraža fluorīds, spirti, fenoli, amīdi, polipeptīdi, proteīni). Intermolekulārās ūdeņraža saites var izraisīt ķēžu, gredzenu vai telpisko tīklu veidošanos. Līdzīgi veidojumi saglabājas kristālos.
Ja H-saistīšanās notiek kā skābes un bāzes fragmentu mijiedarbības rezultāts vienā molekulā, tad iegūtās saites sauc par intramolekulārām. Savienojumi ar šādām saitēm veido vēl vienu lielu savienojumu grupu ar ūdeņraža saitēm. Protams, molekulāro ūdeņraža saišu veidošanās ir iespējama, ja molekulas struktūra pieļauj X-H un B fragmentu telpisko konverģenci ar ūdeņraža saites garumu. Intramolekulārās ūdeņraža saites veidošanās iespēja nav šķērslis starpmolekulārām ūdeņraža saitēm. Piemēram, apsveriet izomēru orto un parahidroksibenzaldehīdus. Salicilskābes aldehīds (orto izomērs) spēj veidot gan iekšējās, gan starpmolekulārās ūdeņraža saites, savukārt para-izomērs mijiedarbojošo grupu pozīcija ļauj veidot tikai starpmolekulāras ūdeņraža saites.
Eksperimentāli ir diezgan viegli atšķirt intramolekulāro ūdeņraža saiti no intermolekulārajām saitēm. Ja H-saites veidošanās ir spektrāli reģistrēta un nav nekādu asociācijas pazīmju, tā ir patiesa norāde par ūdeņraža saites intramolekulāro raksturu. Turklāt starpmolekulārā H-saite (un tās spektrālā izpausme) pazūd pie vielas nelielas koncentrācijas neitrālā šķīdinātājā, kamēr molekulārā H-saite saglabājas šajos apstākļos.
Ūdeņraža saites ietekmē elektronu blīvuma pārdalīšanos molekulās, kas var ne tikai ietekmēt vielu īpašības. Vājas ūdeņraža saites gadījumā elektronu blīvuma izmaiņas notiek galvenokārt X-H fragmentā.… B. Pieaugot ūdeņraža saites enerģijai, elektronu blīvuma pārdale ietekmē visus molekulāro molekulu atomus, kas galu galā noved pie būtiskām izmaiņām vielu fizikālajās un ķīmiskās īpašībās. Organisko savienojumu īpašības būtiski ietekmē gan iekšējās, gan starpmolekulārās ūdeņraža saites. Pēdējo, īpaši fizikālo īpašību, ietekme ir nozīmīgāka, jo starpmolekulārā mijiedarbība izraisa molekulmasas palielināšanos ar visām sekojošām sekām.
Tagad mēs centīsimies aplēst aptuveni, cik plaši ūdeņraža saites ir pārstāvētas organiskajā ķīmijā. Visi organiskie savienojumi ar retāko izņēmumu satur ūdeņradi, tas ir, Brønsted skābes, un organogēni (O, N, S, halogēni), kas visbiežāk sastopami to sastāvā, satur vientuļus elektronu pārus un var darboties kā galvenie centri. Ņemot vērā iepriekš minēto, var teikt, ka lielākā daļa organisko savienojumu ir spējīgi veidot ūdeņraža saites. Ar strukturālo formulu (mijiedarbojošo grupu raksturs un to savstarpējā izvietošana) var prognozēt ūdeņraža saišu stiprumu un to raksturu (intra- vai intermolekulāro). Novērtējot atomu savstarpējo ietekmi molekulās, ir jāņem vērā iespēja veidot ūdeņraža saites un to sekas uz reakcijas ātrumu, mehānismu un virzienu. Bieži vien ir iespējams novērtēt barotnes (šķīdinātāja) ietekmi uz ķīmisko procesu gaitu tikai attiecībā uz ūdeņraža saites veidošanu. Tādējādi kompetenta ķīmiķa sagatavošana ir neiespējama, neizmantojot visu ar ūdeņraža saiti saistīto jautājumu kompleksu.
Aplūkosim dažus raksturīgākos ūdeņraža saites ietekmi uz organisko savienojumu īpašībām. Pirmkārt, tie ir tā saucamie prototropie procesi - transformācijas, kas saistītas ar protonu pārnešanu. Ir zināms, ka enola struktūras (hidroksilgrupa ir ogleklī ar daudzkārtēju saiti = C-OH) ir nestabilas un organiskajā ķīmijā bieži vien šādas formulas tiek ņemtas kvadrātiekavās kā norādi par to nereālu, hipotētisku. Tajā pašā laikāβ- diketoni un citi 1,3-dikarbonil savienojumi var pastāvēt divos veidos: ketonā un enolā. Acetoetiķim, šīs transformācijas var attēlot ar shēmu
Enerģiski mazāk labvēlīgas enola formas veidošanās skaidrojama gan ar konjugētu C = C-O = O savienojumu sistēmas veidošanos, kas vienmēr ir stabilizējošs faktors, gan faktu, ka starp enololu hidroksilgrupu un karboniloksilgrupu veido molekulārā ūdeņraža saite, kas samazina enoliskās formas brīvo enerģiju. Ūdeņraža atoma fiksēšana vairāk elektronegatīvā elementā un konjugācijas ķēdes pagarinājuma rezultātā (H-saite ir iekļauta cirkulārā konjugācijas ķēdē). Ņemot vērā ūdeņraža saites, ne tikai izskaidro enola struktūras realitāti, bet arī šīs formas daudzumu tautomēriskajā sistēmā. Keto-enola līdzsvara stāvokli lielā mērā ietekmē šķīdinātāja raksturs. Enola formas maksimālais daudzums ir norādīts neitrālos ne polāros šķīdinātājos (ogļūdeņražos). Ūdens šķīdumos enola daudzums ir nenozīmīgs, jo ūdens konkurētspējīgi veido starpmolekulāras ūdeņraža saites ar karbonilskābi, iznīcinot molekulāro ūdeņraža saiti, kas stabilizē enola formu.
Karboksilskābes, kā arī spirti var piedalīties H-saites veidošanā gan kā H-donoriem, gan H-akceptoriem. Pirmajā gadījumā skābums samazinās, otrajā palielinājumā. Tas acīmredzami izpaužas divšķiedru skābju jonizācijā: pirmā disociācijas konstante ( K 1) ir neparasti liels un otrais ( K 2) ir neparasti mazs. Lai izskaidrotu novērotos eksperimentālos rezultātus, papildus elektroniskajiem efektiem ir svarīgi H-obligāciju ieguldījums. Sākotnējā struktūrā H-saite spēcīgi aktivizē karboksilgrupu, kas darbojas kā H-akceptors. Monoanjonā, kas veidojas disociācijas pirmajā posmā, veidojas spēcīga molekulārā H-saite, kas krasi samazina otrā karboksila skābumu:
Karboksilskābēm raksturīga ir pseudocikliskās struktūras H-kompleksu un asociēto vielu veidošanās:
Intermolekulārās saites, kas rodas starp karboksilskābes molekulām, ir tik spēcīgas, ka pat gāzveida stāvoklī dimeriskās struktūras ir daļēji saglabātas. Starp citu, karboksilskābes dimera veidošanās palīdz atbildēt uz ilgstošo jautājumu, kas nosaka lielāku ūdeņraža saites stiprumu - X-H grupas skābumu vai B. B etiķskābes bāziskumu ( pK a = 4,7) ar skābumu vairāki lielumi, kas dod trichloracetātu ( pK a = 0,6), tomēr veido izturīgāku dimēru. Protonu akceptora bāziskums ir svarīgāks par protonu donora skābumu.
Ir zināms, ka geminārie dihidroksi atvasinājumi ir nestabili savienojumi - dehidratācija viegli pārvēršas par atbilstošajiem aldehīdiem vai ketoniem. Hlora hidrāts ir viens no nedaudzajiem piemēriem, kur struktūra hem-diols ir stabils. Tā iemesls ir izskaidrojams ar trihlormetilgrupas spēcīgo negatīvo indukcijas efektu (-I-efektu) un molekulāro H-saiti:
Nespējot apturēt citus ūdeņraža saišu ietekmes uz organisko savienojumu īpašībām piemēriem, mēs piedāvājam tabulu ar inter- un intramolekulārajām H-saistībām (1. tabula).
Intramolekulāras un starpmolekulāras ūdeņraža saites veidošanās var būtiski ietekmēt ķīmisko reakciju gaitu un ātrumu. Diemžēl, neskatoties uz ievērojamo darbu, kas veltīts šim jautājumam, nebija plašu vispārinājumu, kam būtu bijusi paredzama vara. Visbiežāk tiek parādīts, ka reakcijas ātrums var samazināties vai palielināties atkarībā no tā, kā elektronu blīvums molekulas reakcijas centros tiek pārdalīts H-saites veidošanās laikā. Jautājumi, piemēram, starpproduktu vai aktivētā kompleksa raksturs, termodinamisko funkciju maiņa, kaimiņu grupu ietekme, nav pienācīgi attīstījušies. Precīzāks šķīdinātāja lomas novērtējums.
Ir zināmas daudzas empīriskas pieejas. Tādējādi savienojumu alkilēšanas reakcijās, kas satur O-H, S-H, N-H saiknes, kālija fluorīda (fluorīda anjona F – ir visefektīvākais protonu akceptors) ievadīšana reakcijas vidē ievērojami palielina alkilēšanas produktu reakcijas ātrumu un ražu. Ūdeņraža saitēm ir liela nozīme reakcijās, kas tiek veiktas šķīdinātājos, kas spēj veidot H-saites ar sākuma savienojumiem un to mijiedarbības produktiem.
Secinājums
Informācija par ūdeņraža saiti norāda uz tā izplatību un apstākļu dažādību. H-obligāciju rakstura apraksts ir mazāk stingrs nekā, piemēram, valences ķīmisko saišu interpretācija. Nav pat vispārpieņemtas H-obligāciju definīcijas. Tajā pašā laikā praktiski ķīmiķi jau sen ir plaši atzinuši un pieņēmuši ūdeņraža saišu patieso esamību un spēju ietekmēt vielu struktūru un īpašības.
Ūdeņraža saikņu lomu dzīvā vielā nosaka ne tikai tas, ka bez H-saitēm nav iespējams iedomāties proteīnu struktūru (dzīvības nesējus) vai nukleīnskābju dubultā spirāles. Bez ūdeņraža saites, visbiežāk sastopamās vielas uz Zemes fizikālās un ķīmiskās īpašības - ūdens, kurā dzīvība ir radusies - būtu pilnīgi atšķirīgas.