אלקטרוליזה של מלח nacl. משוואת גל. הסבר קוונטי-מכני של מבנה האטום
אי-הוודאות בהקמת המיקום והאינטראקציה של האלקטרון כה גדולה עד כי יש צורך לנטוש לחלוטין את הניתוח של מסלול התנועה. עם זאת, קיימת אפשרות של תיאור הסתברותי של מבנה האטום.
על פי מכניקת הקוונטים, תנועת האלקטרון באטום מתוארת על ידי משוואת גלים (משוואת שרדינגר):
כאשר היא פונקציית הגל;
מ - מסת המנוחה של האלקטרון = 9,109. 10-31 ק"ג;
U - אנרגיה פוטנציאלית;
ה - האנרגיה הכוללת של האלקטרון;
x, y, z - קואורדינטות.
הפתרון של משוואת שרדינגר הוא פונקציית הגל ואת הערך המקביל של האנרגיה אלקטרונים ה. ההסתברות למציאת אלקטרון בחלל מאופיינת בריבוע של פונקציית הגל, כלומר. ערך של 2. כדי לתאר את המבנה של אטום, אלקטרון יכול להיחשב "מרוח" בחלל כמו ענן אלקטרונים. הערך 2 המתקבל ממשוואת הגל הוא מדד לצפיפות האלקטרונים באלמנט נפח נתון, או למדוד את ההסתברות למציאת אלקטרון באלמנט נתון בנפח האטום.
לפיכך, במודל הקוונטי-מכני (הסתברותי) של האטום, משמעות המסלול שבו נמצא האלקטרון נעלמת. במקום זאת, אנו מתמודדים עם צפיפות אלקטרונים "מרוח" בחלל של אטום. גוף שנוצר על ידי אלקטרונים "מרוחים" נקרא מסלולית. בדרך כלל, המסלול הוא הבין כחלק של שטח, המהווה 90% של ענן האלקטרון.
נוכחותם של שלושה ממדים של מרחב מובילה לעובדה שבביטוי פונקצית הגל , שהוא פתרון למשוואת שרדינגר, קיימים שלושה כמויות שיכולות לקחת רק ערכים שלמים בדידים - שלושה מספרים קוונטיים. הם מסומנים על ידי סמלים. n, l ו מ l . מספרים קוונטיים אלה מאפיינים את מצב האלקטרון לא רק באטום המימן, אלא גם באטום אחר.
מאפיין אלקטרוןמספרים קוונטיים.
א) המספר הקוונטי הראשי (n ) קובע את הרדיוס הממוצע של ענן האלקטרון, או את כלל האנרגיה האלקטרונית ברמה מסוימת. זה לוקח ערכים טבעיים מ 1 ל . באטומים אמיתיים n יש 7 ערכים, מסומן על ידי האותיות הלטינית K, L, M, N, O, P, Q. ערך n= 1 מתאים לרמת האנרגיה הנמוכה ביותר (כלומר, המדינה היציבה ביותר של האלקטרון). תיאורטית, מספר רמות אינו מוגבל, אבל רמות אטומית עם אנרגיה נמוכה הם בעיקר תפוסים על ידי אלקטרונים.
ב) משני, או מסלולית, מספר קוונטי (l ) . בספקטרום של אטומים multilectron, המבנה multiplet של השורות הוא ציין, כלומר. הקווים מחולקים למספר רכיבים. ריבוי הקווים פירושו כי רמות האנרגיה הן קבוצות של אנרגיה sublevels, כי כל שורה בספקטרום תואמת את המעבר של אלקטרון ממצב אחד למשנהו. ההבדלים באנרגיה במצב האלקטרונים ברמה זו נובעים מהבדל בצורת ענני האלקטרון.
כדי לאפיין את האנרגיה sublevels, מספר הקוונטים מסלולית משמש. בתוך כל רמה, זה יכול לקחת ערכים שלמים מ 0 ל n - 1. לכן, הרמה, בהתאם ל- l, מחולקת למחלצות, שגם להן יש אותיות: s (l = 0), p (l = 1), d (l = 2), f (l = 3). האלקטרונים במצבים אלה נקראים s, p, d ו- f- אלקטרונים.
S טופס אלקטרוני את העננים . לענן זה יש סימטריה כדורית, כלומר. יש צורה של כדור. גל פונקציה גרף функции נמצא בצד אחד של הציר abscissa (איור 3), כלומר פונקצית גל אלקטרונים s היא חיובית.

איור 3 - גרף של פונקציית הגל של s אלקטרון בהתאם למרחק לגרעין. S- אורביטלים הטופס
P- ענן האלקטרון צורה . עבור p- אלקטרון, פונקציית הגל יש טיהור בכיוון כלשהו מן הגרעין (איור 4). בצד אחד של הליבה, הוא חיובי, ומצד שני, שלילי (לא לבלבל את סימן הפונקציה גל עם סימן של המטען החשמלי!). במקור, נעלמת. שלא כמו S- אורביטלים, p-Orbital אין סימטריה כדורית, אבל יש צורה הדומה משקולת (איור 4

איור 4 - תרשים של פונקציית הגל של אלקטרונים p. P- ענן האלקטרון צורה
הסימנים "+" ו- "-" אינם מתייחסים להסתברות למצוא את האלקטרון (הוא תמיד חיובי ושווה ל -2), אלא לפונקציית הגל, שיש לה סימן שונה בחלקים שונים של ענן האלקטרון.
צורה מורכבת אף יותר היא ענני האלקטרון של האלקטרונים D ו- F. לדוגמה d- אורביטלים עשוי להיות בעל מבנה של ארבעה עלי כותרת, ואת הסימנים של פונקציית הגל ב "עלי הכותרת" חלופי:

c) מספר קוונטי מגנטי (m l ). אם האטום ממוקם בשדה מגנטי חיצוני, ואז מתרחש פיצול נוסף של הקווים הספקטראליים. משמעות הדבר היא לערכים נתון n ו l יכולות להיות כמה מדינות של אלקטרון עם אותה אנרגיה. מדינות אנרגיה כאלה נקראות להתנוון. ניוון נעלם כאשר שדה מגנטי חיצוני מוחל על האטום, מה שמוביל את המראה של קווים חדשים בספקטרום.
השינויים באנרגיה תחת פעולה של שדה מגנטי מוסברים על ידי ההבדל בטבעם של ענני האלקטרון בחלל, ולכן, הכיוונים השונים שלהם ביחס לשדות השדה של הכוח. מספר קוונטי מגנטי מ l עבור זה sublevel הוא ערך שלם בטווח מ - ל + ל. לכן, עם זה l יש לו (2l + 1) משמעויות שונות. לדוגמה, עבור s-sublevel (l = 0) יש רק ערך אחד של m l שווה לאפס. לכן, s-sublevel מכיל מסלול אחד. עבור p-sublevel (l = 1) שלושה ערכים אפשריים: m l: (- 1,0,1). בהתאם לכך, כל p-sublevel מורכב משלושה אורביטלים בצורת משקולת מכוונת זה לזה לאורך שלושה צירים מתואמים מסומנים p x, p y, p z. קל לקבוע כי d-sublevel (l = 2) מכיל 2l + 1 = 5 אורביטלים, ו- f-sublevel (l = 3) מכיל 7 אורביטלים.
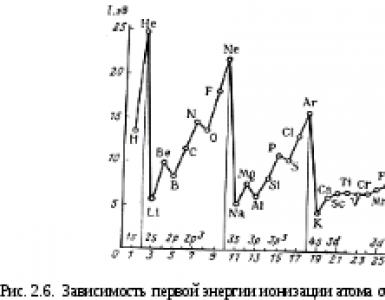
תרשים 5 מציג את הסיבוך ההדרגתי של הרעיונות לגבי המבנה של קליפת האלקטרון של האטום (מרמות ועד סובלנים ועד אורביטלים).

איור 5 - רמות אנרגיה תרשים 1 עד 3
ד) ספין מספר קוונטי (m s ) זה לא קשור לתנועה של אלקטרון סביב הגרעין, אבל קובע את המדינה שלו. טבעו של מצב זה עדיין אינו ידוע. ההנחה היא כי היא קשורה סיבוב של האלקטרון סביב הציר שלה "ספין" מתורגם מאנגלית - "מסתובב", "מסתובב" .. מספר מ s לוקח שני ערכים: +1/W 2.1
כדי לקבוע את מצב האלקטרון באטום אלקטרון רב, פאולילפיו אטום לא יכול להיות שני אלקטרונים, שבו כל ארבעת מספרי הקוונטים יהיה זהה . כתוצאה מכך, כל מסלול, המאופיין בערכים מסוימים של n, l ו- m l, ניתן לכבוש על ידי לא יותר משני אלקטרונים אשר ספינים שלהם סימנים מנוגדים. אלקטרונים כאלה נקראים זוג.
כאן, אלקטרונים באורביטלים מיוצגים על ידי החצים המצביעים למעלה או למטה, בהתאם לסימן המספר הקוונטי של הספין.
7.2 Electronic Skills
7.2.1 אלקטרוליזה של נמס ופתרונות אלקטרוליטים
4 OH - - 4e → 2 H 2 O + O 2
2 2 4 4 - 4e → 2 SO 3 + O 2
בפתרונות מים, בנוסף ליונים של אלקטרוליט עצמו, יש גם מולקולות מים H + ו- OH - יונים, אשר מסוגלים להשתתף בתהליכים אלקטרודה. במקרה זה, תגובות מתחרות אפשריות במהלך אלקטרוליזה. הקריטריון הקובע את היתרון של תהליך אלקטרודה הוא הערך של הפוטנציאל האלקטרודה שלה. ככל שהפוטנציאל גבוה יותר, כך קל יותר (עם קיטוב שלילי קטן יותר של האלקטרודה) הוא הפחתה בקתודה, וקשה יותר (עם קיטוב חיובי יותר של האלקטרודה) הוא החמצון באנודה.
הפוטנציאל המינימלי שבו תהליך אלקטרוליזה הופך אפשרי אפשרי פוטנציאל (מתח) של פירוק או שחרור. הוא נמצא על ידי הפחתת הפוטנציאל האלקטרודה של קטיון מן הערך המקביל של הפוטנציאל האלקטרודה של אניון. לדוגמה, פוטנציאל הפירוק של כלוריד אבץ הוא ה ° (Cl 2 / 2Cl -) - ה ° (Zn 2 + Zn) = 1.36 - (0.76) = 2.12 V. הפרש פוטנציאלי זה, או EMF, של תא גלווני פנימי הנובע משחרור מוצרי אלקטרוליזה על האלקטרודות, יש כיוון הפוך ל- EMF חיצוני, המשמש כמקור זרם. לכן, אלקטרוליזה אפשרי בתנאים של פיצוי של EMF פנימי על ידי מתח חיצוני. לעתים קרובות, פוטנציאל הפירוק הנדרש של אלקטרוליט גדול מהערך התיאורטי. הבדל זה נקרא overvoltage.
מתח יתר של חמצן במהלך אלקטרוליזה של תמיסות מימיות של כלורידים באנודה אינו פולט חמצן, אבל כלור, למרות הפוטנציאל האלקטרודה הסטנדרטי שלה (1.36 V) חשוב יותר מאשר חמצן ה ° (O 2 + 4H + / 2H 2 O) = 1.23V.A.I. ח'לבניקוב, י. Arzhanova, O.A. נאפילקובה
אלקטרוליזה היא מערכת של תהליכים המתרחשים כאשר זרם חשמלי ישיר עובר דרך מערכת אלקטרוכימית המורכבת משני אלקטרודות ופתרון להיתוך או אלקטרוליט.
דוגמה אלקטרוליזה הוא אלקטרוליזה של להמיס מגנזיום כלורי. כמו הנוכחי עובר דרך להמיס, קטיוני מגנזיום תחת הפעולה של השדה החשמלי לעבור האלקטרודה השלילית. כאן, אינטראקציה עם אלקטרונים הקרובים במעגל החיצוני, הם משוחזרים
כלור אניונים לעבור אלקטרודה חיובית, ויתור על אלקטרונים עודפים, הם מחומצנים. במקרה זה, התהליך העיקרי הוא שלב אלקטרוכימי בפועל - חמצון של יוני כלור
ומשנית - הכריכה של אטומי כלור שהתקבלו למולקולות:
הוספת המשוואות של התהליכים המתרחשים באלקטרודות, אנו משיגים את המשוואה הכוללת של תגובת החזרה המתרחשת במהלך אלקטרוליזה של המסה:
תגובה זו לא יכולה להתקיים באופן ספונטני; האנרגיה הדרושה ליישומה באה ממקור כוח חיצוני.
כמו במקרה של מקור כימי של אנרגיה חשמלית, האלקטרודה שבה הפחתת מתרחש נקרא הקתודה; האלקטרודה שבה מתרחשת החמצון נקרא האנודה. אבל במהלך אלקטרוליזה, הקתודה טעונה שלילית, והנודה היא חיובית, כלומר הפצה של סימני המטען של האלקטרודות היא הפוכה לזו הקיימת כאשר התא הגלווני פועל. הסיבה לכך היא כי התהליכים המתרחשים במהלך אלקטרוליזה הם, באופן עקרוני, הפוך התהליכים המתרחשים במהלך המבצע של תא גלווני. במהלך אלקטרוליזה, מתרחשת תגובה כימית על חשבון האנרגיה של זרם חשמלי המסופק מבחוץ, ואילו במהלך פעולתו של תא גלווני, האנרגיה של תגובה כימית שזורמת בו באופן אנרגטי הופכת לאנרגיה חשמלית.
כאשר בוחנים את אלקטרוליזה של תמיסות מימיות, זה לא צריך להתעלם כי בנוסף יונים אלקטרוליטים, בכל פתרון מימית יש גם יונים כי הם מוצרים של ניתוק מים - ו. בשדה החשמלי, יונים המימן לנוע אל הקתודה, ואת היונים לנוע אל האנודה. לכן, על הקתודה הן קטיוני אלקטרוליט וקטיון מימן יכול להיות משוחרר.
באופן דומה, האנודה יכולה לפרוק שני אנילי אלקטרוליטים ויונים hydroxide. בנוסף, מולקולות מים יכול גם לעבור חמצון אלקטרוכימי או הפחתה.
איזה סוג של תהליכים אלקטרוכימיים יתקיים על האלקטרודות במהלך אלקטרוליזה יהיה תלוי בעיקר את הערכים היחסיים של הפוטנציאל האלקטרודה של מערכות אלקטרוכימיות המקביל. מבין כמה תהליכים אפשריים יתרחש אחד מיישומה כרוך בהוצאה מינימלית של אנרגיה. משמעות הדבר היא כי צורות חמצון של מערכות אלקטרוכימיות עם הפוטנציאל האלקטרודה הגבוהה ביותר ישוחזר על הקתודה, וצורות מופחת של מערכות עם הפוטנציאל האלקטרודה הנמוך ביותר יחמצן על האנודה. מהלך של תהליכים אלקטרוכימיים מסוימים יש השפעה מעכבת על החומר אלקטרודה; מקרים אלה נדונים להלן.
בהתחשב בתהליכים הקתודיים המתרחשים במהלך אלקטרוליזה של תמיסות מימיות, אנו מגבילים את עצמנו למקרה החשוב ביותר, הפחתה קתודית, שמובילה לשחרור של רכיבים במצב חופשי. כאן יש צורך לקחת בחשבון את הפוטנציאל של תהליך הפחתת יון מימן. פוטנציאל זה תלוי בריכוז יונים של מימן (ראה עמ '273), ובמקרה של פתרונות ניטראליים, הערך B. לכן, אם קטיון האלקטרוליטים הוא מתכת שהפוטנציאל האלקטרודה שלה הרבה יותר חיובי מ -0.41 V, אלקטרוליט כזה בקתודה ישוחרר ממתכת. מתכות כאלה נמצאים בסדרה של מדגיש ליד מימן (החל בערך מפח) ואחרי זה. להיפך, אם קטיון האלקטרוליטים הוא מתכת שיש לה פוטנציאל הרבה יותר שלילי מ -0.41 V, המתכת לא תתאושש, ומימן ישוחרר. מתכות כאלה כוללות מתכות של תחילת סדרה של מדגיש - כ טיטניום. לבסוף, אם הפוטנציאל של המתכת קרוב לערך של -0.41 V (המתכות של החלק האמצעי של הסדרה הן -), אז בהתאם לריכוז של הפתרון ואת התנאים של אלקטרוליזה, הן הפחתת המתכות ואבולוציה מימן אפשריים; לעתים קרובות יש לשחרר משותף של מתכת ומימן.
אבולוציה אלקטרוכימית של מימן מפתרונות חומציים מתרחשת עקב פריקה של יני מימן. במקרה של מדיה נייטרלי או אלקליין, היא תוצאה של הפחתה אלקטרוכימית של מים:
לפיכך, טבעו של תהליך הקתודה באלקטרוליזה של תמיסות מימיות נקבע בעיקר על ידי המיקום של המתכת המקבילה בסדרה של מדגיש. במקרים מסוימים, הפתרון, הריכוז של יונים מתכת ותנאי אלקטרוליזה אחרים הם בעלי חשיבות רבה.
כאשר בוחנים תהליכים anodic, יש לזכור כי החומר של האנודה עלול להיות מחומצן במהלך אלקטרוליזה. בהקשר זה, יש אלקטרוליזה עם אנודה אינרטית אלקטרוליזה עם אנודה פעיל. Inert הוא אנודה, חומר אשר אינו עובר חמצון במהלך אלקטרוליזה. פעיל הוא האנודה, החומר שממנו ניתן לחמצן במהלך אלקטרוליזה. כמו חומרים אנדים אינרטי, גרפיט, פחם, ופלטינה משמשים לעתים קרובות ביותר.
תמיסות מימיות חשופות של אלקליות, חומצות המכילות חמצן ומלחיהן, כמו גם מימן פלואורו ופלואורידים, עוברים חימצון אלקטרוכימי של מים עם שחרור החמצן באנודה אינרטית. בהתאם לפתרון, תהליך זה מתרחש בדרכים שונות וניתן לכתוב על ידי משוואות שונות. בסביבה אלקליין, המשוואה היא
וכן חומצי או נייטרלי:
במקרים בהם נחשב, חמצון אלקטרוכימי של מים הוא תהליך מועיל ביותר אנרגטית. חמצן המכיל אניונים הם גם לא מסוגלים חמצון, או חמצון שלהם מתרחשת בפוטנציאל גבוה מאוד. לדוגמה, פוטנציאל סטנדרטי לחמצון של יון
שווה ל 2.01 V, אשר עולה באופן משמעותי על הפוטנציאל הסטנדרטי של חמצון מים (1.229 V). הפוטנציאל הסטנדרטי לחמצון היון גדול אף יותר (2.866 V).
במהלך אלקטרוליזה של פתרונות מימיים של חומצות ללא חומצה מלח שלהם (למעט HF ופלואורידים), אניונים משוחררים על האנודה. בפרט, במהלך אלקטרוליזה של פתרונות ומלחים שלהם, הלוגן המתאים משוחרר על האנודה. שים לב כי שחרורו של כלור במהלך אלקטרוליזה ומלחים שלה סותר את המיקום ההדדי של המערכות
בסדרה של פוטנציאל אלקטרודה רגילה.
אנומליה זו קשורה עם overvoltage משמעותי (ראה סעיף 104) של השני אלה שתי אלקטרודות תהליכים - חומר האנודה יש השפעה מעכבת על תהליך של אבולוציה חמצן.
במקרה של אנודה פעילה, מספר התהליכים החמצוניים המתחרים עולה לשלושה: חימצון אלקטרוכימי של מים עם אבקת חמצן, פריקה של האניון (כלומר, החמצון שלו) וחמצון אלקטרוכימי של המתכת האנודית (מה שמכונה פירוק מתכת אנודי). של תהליכים אפשריים אלה, יהיה אחד כי הוא אנרגטי ביותר מועיל. אם המתכת האנודה ממוקמת בסדרה של פוטנציאל סטנדרטי לפני שתי מערכות אלקטרוכימיות אחרות, פירוק אנודי של המתכת יהיה נצפה. אחרת, שחרור חמצן או פריקה אניון תתרחש.
שקול כמה מקרים טיפוסיים של אלקטרוליזה של פתרונות מימיים.