नाइट्रोजन के ऑक्सीजन यौगिकों - ज्ञान के हाइपरमार्केट। मैं नाइट्रोजन के ऑक्सीजन यौगिकों
ऑक्सीकरण +1, +2, +3, +4, +5 की डिग्री के साथ।
आक्साइड nesoleobrazuyuschie N0 और N20 (इसका क्या मतलब है?) और शेष आक्साइड - एसिड: N2O3 मेल खाती है नाइट्रस एसिड NN02 और N205 - नाइट्रिक एसिड HNO3। नाइट्रिक ऑक्साइड (चतुर्थ) एन 02, जब पानी में भंग हो जाता है, साथ ही साथ दो एसिड - एचएनओ 2 और एचएनओ 3 बनाते हैं।
यदि यह अतिरिक्त ऑक्सीजन की उपस्थिति में पानी में घुल जाता है, तो केवल नाइट्रिक एसिड प्राप्त होता है
4N02 + 02 + 2H20 = 4HNO3
नाइट्रिक ऑक्साइड (चतुर्थ) NO2 एक भूरा, बहुत जहरीला गैस है। इसे आसानी से वायुमंडलीय ऑक्सीजन द्वारा रंगहीन गैर-नमक बनाने वाले नाइट्रिक ऑक्साइड (पी) के ऑक्सीकरण द्वारा प्राप्त किया जाता है:
सबक की सामग्री पाठ का सारांश पाठ त्वरण विधियों इंटरैक्टिव प्रौद्योगिकियों के समर्थन ढांचे प्रस्तुति अभ्यास कार्य और अभ्यास स्वयं परीक्षा कार्यशालाओं, प्रशिक्षण, मामलों, quests होमवर्क चर्चा विषयों छात्रों से अशिष्ट प्रश्न चित्र ऑडियो, वीडियो और मल्टीमीडिया तस्वीरें, चित्र ग्राफिक्स, टेबल, योजनाएं विनोद, उपाख्यानों, चुटकुले, कॉमिक्स दृष्टांत, कहानियां, पहेली पहेली, उद्धरण की आपूर्ति करता है सार उत्सुक धोखा शीट पाठ्यपुस्तकों के लिए चिप के लेख मूल और अन्य शब्दकोष के अतिरिक्त शब्द पाठ्यपुस्तकों और पाठों में सुधार पाठ्यपुस्तक में त्रुटियों में सुधार नए के साथ अप्रचलित ज्ञान को बदलने के सबक में नवाचार के पाठ्यपुस्तक तत्वों में खंड को अद्यतन करना केवल शिक्षकों के लिए सही सबक वर्ष के लिए कैलेंडर योजना, चर्चा कार्यक्रम की पद्धतिगत सिफारिशें एकीकृत सबकप्रयोगशाला और व्यावहारिक सबक № 21
विषय 2.1.3। समूह वी का मुख्य उपसमूह
पाठ का विषय "ऑक्सीकरण नाइट्रोजन, फॉस्फरस और इसके यौगिकों के यौगिकों की गुणधर्म" है।
सबक के उद्देश्य:
· ऑक्सीजन युक्त नाइट्रोजन यौगिक के गुणों और फास्फोरस संकलन समीकरणों प्रतिक्रियाओं साबित अभ्यास प्रदर्शन के ज्ञान में सुधार
नाइट्रोजन और फास्फोरस के ऑक्सीजन युक्त यौगिकों के रासायनिक गुण;
धातुओं के साथ नाइट्रिक एसिड की बातचीत की विशेषताएं,
नाइट्रेट्स की थर्मल अपघटन।
कौशल प्राप्त करें
नाइट्रेट पर गुणात्मक प्रतिक्रियाओं का प्रदर्शन -, नाइट्राइट -, फॉस्फेट - आयन।
रेडॉक्स प्रतिक्रियाओं के समीकरणों को चित्रित करने के कौशल में सुधार करने के लिए
मैं सैद्धांतिक हिस्सा:
मैं नाइट्रोजन के ऑक्सीजन यौगिकों।
1. नाइट्रस एसिड।नाइट्रस एसिड कमजोर, अस्थिर है, केवल समाधान में मौजूद है। क्षार के साथ बातचीत करते समय, यह नमक-नाइट्राइट बनाता है।
नाइट्रस एसिड लवण - नाइट्राइट्स - गर्मी के लिए काफी प्रतिरोधी हैं। एग्नो 2 के अपवाद के साथ, वे पानी में आसानी से घुलनशील होते हैं। नाइट्रस एसिड की तरह ही, नाइट्राइट्स में ऑक्सीकरण-कमी द्वंद्व होता है:
5 केएनओ 2 + 2 केएमएनओ 4 + 3 एच 2 एसओ 4 = 5 किलोोज़ + 2 एमएनएसओ 4 + के 2 एसओ 4 + 3 एच 2 हे
एजेंट को कम करना
2KI + 2KNO 2 + 2H 2 SO 4 = I 2 + 2NO + 2K 2 SO 4 + 2H 2 O
आक्सीकारक
किसी एसिड माध्यम में केआई के साथ प्रतिक्रिया का व्यापक रूप से एन 2 नाइट्राइट आयन (मुक्त आयोडीन स्टार्च के साथ नीले रंग के यौगिक के रूप में) के पता लगाने के लिए विश्लेषणात्मक रसायन शास्त्र में उपयोग किया जाता है।
नाइट्रस एसिड के अधिकांश लवण जहरीले होते हैं।
सबसे बड़ा उपयोग सोडियम नाइट्राइट NaNO 2 से बना है, जिसका व्यापक रूप से कार्बनिक रंगों, औषधीय पदार्थों के उत्पादन में विश्लेषणात्मक रसायन शास्त्र में उपयोग किया जाता है। चिकित्सा अभ्यास में इसका उपयोग एंजिना पिक्टोरिस के लिए वासोडिलेटर के रूप में किया जाता है, और साइनाइड विषाक्तता के लिए एक एंटीडोट के रूप में भी किया जाता है।
बड़ी मात्रा में उपयोग किए जाने पर नाइट्राइट्स की विषाक्तता इस तथ्य के कारण होती है कि शरीर मुक्त नाइट्रस एसिड पैदा करता है। फिर, ऑक्सीजन हीमोग्लोबिन को मेटेमोग्लोबिन में परिवर्तित कर दिया जाता है, जिसके गठन से ऊतकों के ऑक्सीजन भुखमरी की स्थिति पैदा होती है, क्योंकि ऐसा रक्त ऑक्सीजन ले जाने में असमर्थ है। श्वसन केंद्र के पक्षाघात से मृत्यु हो सकती है।
2. नाइट्रिक एसिड समाधान में हाइड्रोजन केशन की उपस्थिति के कारण मजबूत अकार्बनिक एसिड के विशिष्ट गुणों को प्रदर्शित करता है, साथ ही नाइट्रेट आयन की ऑक्सीकरण क्षमता के कारण विशिष्ट गुण भी प्रदर्शित करता है।
एक मजबूत अकार्बनिक एसिड के रूप में नाइट्रिक एसिड, धातु ऑक्साइड, बेस, लवण के साथ बातचीत करता है:
2HNO 3 + क्यूओ = क्यू (नहीं 3) 2 + एच 2 ओ;
2HNO 3 + बा (ओएच) 2 = बा (नहीं 3) 2 + 2 एच 2 ओ;
2HNO 3 + CaCO 3 = Ca (नहीं 3) 2 + सीओ 2 + एच 2 ओ;
2HNO 3 + Na 2 SiO 3 = 2NaNO 3 + H 2 SiO 3।
नाइट्रिक एसिड एक बहुत मजबूत ऑक्सीडेंट है, क्योंकि इसमें अधिकतम ऑक्सीकरण राज्य (+5) में नाइट्रोजन परमाणु होता है। यह कई सरल और जटिल पदार्थों के साथ बातचीत करता है।
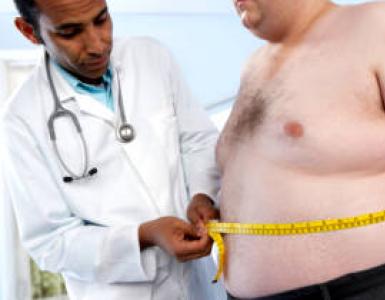
नाइट्रिक एसिड सोने, प्लैटिनम और प्लैटिनम धातुओं के साथ-साथ कई गैर धातुओं और जटिल पदार्थों को छोड़कर लगभग सभी धातुओं को ऑक्सीकरण करता है।
गर्म होने पर, यह विघटित होता है:
4HNO 3 4NO 2 + 2 एच 2 ओ + ओ 2
जब नाइट्रिक एसिड कम करने वाले एजेंटों के साथ प्रतिक्रिया करता है, हाइड्रोजन, एक नियम के रूप में, जारी नहीं किया जाता है। ऑक्सीकरण राज्यों में नाइट्रोजन में कमी आई है
प्रतिक्रिया शर्तों, एसिड एकाग्रता और सह-प्रतिक्रियाशील के घटते गुणों के आधार पर, +4 से -3 तक।
एसिड एकाग्रता को कम करता है और सह-एजेंट के घटते गुणों को और अधिक स्पष्ट करता है, गहरा नाइट्रिक एसिड कम हो जाता है। केंद्रित नाइट्रिक एसिड के साथ निष्क्रिय धातुओं की बातचीत में, एक नियम के रूप में, नहीं 2:
एजी + 2 एनएनओ 3 (कॉन्स) = एग्नो 3 + नहीं 2 + एच 2 ओ।
एक नियम के रूप में पतला नाइट्रिक एसिड के साथ निष्क्रिय धातुओं पर प्रतिक्रिया करते समय, नाइट्रिक ऑक्साइड (द्वितीय) का गठन होता है:
3 क्यू + 8HNO 3 (razb) = 3 क्यू (नहीं 3) 2 + 2NO + 4H 2 ओ।
जब नाइट्रिक एसिड सक्रिय धातुओं के साथ प्रतिक्रिया करता है, वसूली के कई उत्पादों का मिश्रण आमतौर पर बनाया जाता है, हालांकि उनमें से एक प्रमुख हो सकता है। उदाहरण के लिए, नाइट्रिक एसिड के साथ जस्ता की बातचीत में, कमी उत्पाद एसिड एकाग्रता घटाने के साथ बदलता है:

केंद्रित नाइट्रिक एसिड लोहे, क्रोमियम, एल्यूमीनियम और कुछ अन्य धातुओं को निष्क्रिय करता है, इसलिए इसे स्टील और एल्यूमीनियम टैंक में रेल द्वारा पहुंचाया जाता है।
गैर-धातुओं के साथ, बहुत केंद्रित (60% से अधिक) नाइट्रिक एसिड प्रतिक्रिया करता है, जबकि यह कम हो जाता है 2 या नहीं:
6HNO 3 + एस = एच 2 एसओ 4 + 6NO 2 + 2 एच 2 ओ;
5HNO 3 + पी = एच 3 पीओ 4 + 5NO 2 + एच 2 ओ;
2HNO 3 + एस = एच 2 एसओ 4 + 2NO;
5HNO 3 + 3 पी + 2 एच 2 ओ = 3 एच 3 पीओ 4 + 5 एनओ
केंद्रित नाइट्रिक एसिड जटिल पदार्थों के साथ बातचीत करता है, उन्हें ऑक्सीकरण करता है।
एचएनओ 3 की एक मात्रा और एचसीएल के तीन खंडों का मिश्रण शाही वोदका कहा जाता है, क्योंकि यह "धातुओं के राजा" - सोने को भंग कर देता है। इस प्रतिक्रिया का कुल समीकरण
औ + एचएनओ 3 + 4 एचसीएल = एच [एयूसीआई 4] + नहीं + 2 एच 2 ओ।
मोनोबैसिक होने के नाते, नाइट्रिक एसिड नमक की एक पंक्ति बनाता है - नाइट्रेट्स। उनमें से सभी पानी में अत्यधिक घुलनशील होते हैं, नाइट्रिक एसिड से अधिक स्थिर होते हैं, और इसलिए जलीय घोलों में ऑक्सीकरण गुणों का शायद ही कभी होता है। हालांकि, जब एसिड समाधान अम्लीकृत होते हैं, नाइट्रेट्स के गुण ऑक्सीडेंट के रूप में बढ़ाए जाते हैं।
पृष्ठ 1
ऑक्सीजन नाइट्रोजन यौगिकों का एक ज्वलंत उदाहरण है कि शरीर के गुण उनकी मात्रात्मक संरचना में बदलाव के साथ कैसे बदलते हैं। पहला गैस है, दूसरा, सामान्य तापमान पर, एक ठोस क्रिस्टलीय शरीर है।
अत्यंत अस्थिर जब गरम, एक कमजोर ऑक्सीकरण और कम करने के गुण होते हैं - giponitrity - आक्सीजन नाइट्रोजन यौगिकों वी H2N2O2 hyponitrous एसिड 1 से इसके सकारात्मक ऑक्सीकरण राज्यों और उसके लवण के सभी के लिए मौजूद हैं।
नाइट्रोजन का ऑक्सीजन यौगिक, जहां यह उच्च मूल्य - एन 2 ओ, सेमी-पेंटोक्साइड नाइट्रोजन, नाइट्रिक एनहाइड्राइड प्रदर्शित करता है।
आक्सीजन नाइट्रोजन यौगिकों जब उनकी मात्रात्मक रचना बदल रहा है कैसे शरीर की गुणवत्ता को बदलने के लिए की ज्वलंत उदाहरण हैं। पहला गैस है, दूसरा, सामान्य तापमान पर, एक ठोस क्रिस्टलीय शरीर है।
आक्सीजन नाइट्रोजन यौगिकों (SU, वी) एक समाधान पानी में घुलनशील यौगिकों में, एक अम्लीय मध्यम अस्पताल में ऑक्सीकरण PHG, आरआई।
आइए नाइट्रोजन के ऑक्सीजन यौगिकों पर विचार करें।
नाइट्रोजन यौगिकों और परिसरों eoobrazovaniyu-नाइट्रीकरण प्रतिक्रिया है करने के लिए ऑक्सीजन की NO2X क्षमता electrophilicity और समन्वय असंतृप्त नाइट्रोजन परमाणु के रूप में परिभाषित किया जाना है। के लिए एक ही समन्वय संख्या electrophilicity गतिविधि निर्धारित किया जाता है, सबसे अधिक सक्रिय मुक्त nitronium कटियन ओनो है। समाधान बहुत ही कम गतिविधि को कम करता है। मतदान तापमान में वृद्धि के Titov साथ नाभिक के नाइट्रो समूह में प्रवेश कम solvation nitronium कटियन में कमी बताते हैं।
रासायनिक ऑक्सीजन नाइट्रोजन और फास्फोरस यौगिकों हम पहले से ही चर्चा की है; अब हम उपसमूहों के तत्वों ए और बी रासायनिक ऑक्सीजन वैनेडियम यौगिकों विद्युत धन उपसमूह एक के सभी तत्वों, फास्फोरस रसायन विज्ञान के लिए कई मायनों में समान की कम से कम पर विचार करें। के बाद से इन दोनों तत्वों ऑक्सीजन के संबंध में एक ही समन्वय नंबर है, एक ही सूत्र के हाइड्रोक्सी यौगिक समान संरचना है और अक्सर एक दूसरे के साथ-साथ आर्सेनिक की isomorphic इसी यौगिकों isomorphic को कर रहे हैं। उदाहरण के लिए, isomorphic dodekagid-रता Na3PO4, Na3AsO4, Na3VO4, साथ ही R3 (PO4) सी 1, Pb5 (AsOJCl और Pb5 (VO4) क्लोरीन वनैडियम व्यापक रूप से प्रकृति में वितरित किया जाता है की जटिल लवण हैं ;. यह आमतौर पर के रूप में फास्फोरस के साथ एक साथ होता है वैनेडियम-इंग (दुर्लभ खनिज patronita VSB के बड़े जमा भी बहुत महत्वपूर्ण वैनेडियम स्रोत हैं), और नाइओबियम और टैंटलम सामान्यतः अन्य संक्रमण या दुर्लभ पृथ्वी धातुओं के साथ पाए जाते हैं ऑर्थो में जाना जाता है -।, मेटा - और pyrovanadate, लेकिन प्रतिरोध इसी phospha का प्रतिलोम के जलीय घोलों में इन यौगिकों की स्थिरता की डिग्री रों।
ऑक्सीजन द्वारा नाइट्रोजन यौगिकों सभी नाइट्रोजन आक्साइड, नाइट्रस और नाइट्रिक एसिड और उनके लवण शामिल हैं।
एक नाइट्रोजन परमाणु पर नाइट्रोजन की ऑक्सीजन यौगिकों 0 5 से 3 ऑक्सीजन परमाणु से की है। एक नाइट्रोजन परमाणु की शर्तों पर निर्भर करता है संलग्न या भाग या ऑक्सीजन परमाणु खो जा सकता है।
नाइट्रोजन के सभी ऑक्सीजन यौगिकों की तरह, इसकी नाइट्रस ऑक्साइड एक एंडोथर्मिक यौगिक है, और इसमें ऑक्सीजन कुष्ठ रोग होता है। इसलिए, हाइड्रोजन, कोयले, केरोसिन और अन्य दहनशील पदार्थों में इसके साथ-साथ शुद्ध ऑक्सीजन में, एक व्यापक ब्लूश ऑरियोल के साथ एक लौ जलती है।
नाइट्रोजन के सभी ऑक्सीजन यौगिकों की तरह, इसकी नाइट्रस ऑक्साइड एक एंडोथर्मिक यौगिक है, इसमें ऑक्सीजन अस्थिर रूप से आयोजित की जाती है। इसलिए, हाइड्रोजन, कोयला, केरोसिन और अन्य दहनशील पदार्थ; इसमें एक व्यापक ब्लूश आभा के साथ शुद्ध ऑक्सीजन, लौ में जलाएं।
ऑक्सीकरण की विभिन्न डिग्री के नाइट्रोजन और ऑक्सीजन यौगिकों के आक्साइड पहले (उत्प्रेरक प्रक्रिया) में नाइट्रोजन आक्साइड को अमोनिया के ऑक्सीकरण जो तब आसानी से नाइट्रिक एसिड तक वायुमंडलीय ऑक्सीजन से ऑक्सीकरण द्वारा उत्पादित कर रहे हैं।
ग्रेड 9 में सार रसायन शास्त्र सबक हकदार शैक्षिक जटिल O.S.Gabrielyana के लिए "आक्सीजन नाइट्रोजन यौगिकों"। काम, शैक्षिक विकास, शिक्षा, और स्वास्थ्य की बचत समस्या शामिल उदाहरण नाइट्रोजन आयनों ऑक्सीजन soedineniy.Konspekt के लिए ऑक्सीकरण-युग्मन गुण पर विचार करना है।
डाउनलोड:
पूर्वावलोकन:
अपने प्रस्तुतियों के पूर्वावलोकन का उपयोग करने के लिए, स्वयं को एक खाता बनाएं (एक Google खाता) और इसमें लॉग इन करें: https://accounts.google.com
स्लाइड करने के लिए हस्ताक्षर:
नाइट्रोजन के ऑक्सीजन यौगिकों।
नाइट्रोजन के ऑक्साइड। नाइट्रोजन छह ऑक्सीजन यौगिकों का निर्माण करता है। ऑक्सीकरण की डिग्री + 1 एन 2 ओ + 2 नहीं + 3 एन 2 ओ 3 + 4 नहीं 2, एन 2 ओ 4 + 5 एन 2 ओ 5
तैयारी: एनएच 4 सं = एन 2 O + 2H 2 हे रासायनिक गुणों: 1. हीटिंग 2 एन 2 +1 हे = 0 2 एन 2 + O 2 2 एन 2 हाइड्रोजन +1 O + एच 2 के लिए = 2 एन द्वारा अपघटन 0 + H 2 हे nesoleobrazuyuschy +1 एन 2 हे नाइट्रिक ऑक्साइड (आई), नाइट्रस ऑक्साइड या "हँस गैस", मानव तंत्रिका तंत्र पर उत्तेजक प्रभाव एक संवेदनाहारी के रूप में चिकित्सा के क्षेत्र में प्रयोग किया जाता है। भौतिक गुण: बिना रंग और गंध के गैस। यह ऑक्सीकरण गुण दिखाता है, आसानी से विघटित होता है।
नहीं +2 तैयारी: 1. प्रकृति में: एन 2 + ओ 2 = 2NO 2. उद्योग में: 4 एनएच 3 + 5 ओ 2 = 4NO + 6H 2 ओ रासायनिक गुण: 1. आसानी से ऑक्सीकरण: 2 एन + 2 ओ + ओ 2 = 2N 4 हे 2 आक्सीकारक 2. 2 एन 2 O + 2SO 2 = 2SO 3 + N 2 0 nesoleobrazuyuschy बेरंग गैस, थर्मल, स्थिर खराब घुलनशील पानी में, व्यावहारिक रूप से तत्क्षण ऑक्सीजन के साथ प्रतिक्रिया व्यक्त (कमरे के तापमान पर)।
एन 2 ओ 3 3 रासायनिक गुण: NO 2 + सं एन 2 ओ 3 तैयारी: सभी गुण अम्लीय आक्साइड हैं। गहरे नीले रंग, थर्मल, अस्थिर टी गर्म के अम्लीय ऑक्साइड तरल। = 3.5 0C, मी। ई। वहाँ के तहत सामान्य परिस्थितियों एक गैसीय अवस्था में बदल जाता है, केवल ठंडा करने के तहत तरल है। पानी, नाइट्रस एसिड रूपों के साथ प्रतिक्रिया करते समय।
सं 2 + तैयारी 4: 1. 2 सं + O 2 = 2NO 2 2. Cu + 4HNO 3 (करने के लिए) = Cu (कोई 3) 2 + 2 + 2NO 2H 2 हे रासायनिक गुणों: 1 पानी के साथ 2 सं 2 + एच 2 ओ = HNO 3 + HNO 2 2. क्षार 2NO 2 + 2NaOH = नैनो 3 + नैनो 2 + H 2 हे 3. dimerization 2NO 2 एन 2 हे 4 विषैले नाइट्रोजन ऑक्साइड (चतुर्थ) या नाइट्रोजन डाइऑक्साइड, भूरे रंग गैस अच्छी तरह से पानी में घुलनशील, पूरी तरह से इसके साथ प्रतिक्रिया करता है। यह एक मजबूत ऑक्सीकरण एजेंट है।
एन 2 ओ 5 + 5 तैयारी: 1. 2NO 2 + O 3 = एन 2 ओ 5 हे 2 + 2 2HNO 3 + पी 2 ओ 5 = 2HPO 3 + एन 2 ओ 5 रासायनिक गुण: 1. आसानी से विघटित 2N 2 हे 5 = 4NO 2 + ओ 2 2। मजबूत ऑक्सीडेंट अम्लीय ऑक्साइड नाइट्रिक ऑक्साइड (वी), नाइट्रोजन डाइऑक्साइड, सफेद ठोस (mp। = 41 सी 0)। यह अम्लीय गुण दिखाता है, यह एक बहुत मजबूत ऑक्सीडाइज़र है।
एचएनओ 3 संरचना। संरचना गुण। एच ओ एन ओ ओ - - नाइट्रोजन नाइट्रोजन संयोजक के ऑक्सीकरण की डिग्री +5 चतुर्थ ध्रुवीय सहसंयोजक रासायनिक बंधन नाइट्रिक एसिड - बेरंग हीड्रोस्कोपिक तरल, सी तीखी गंध, "धूम्रपान करता है" हवा पानी में अनिश्चित काल के लिए घुलनशील में। टी पिघलने बिंदु -41.5 9 डिग्री सेल्सियस, आंशिक अपघटन के साथ उबलते +82.6 डिग्री सेल्सियस। प्रकाश भंडारण एक नाइट्रोजन ऑक्साइड (चतुर्थ), ऑक्सीजन और पानी में विघटित किया जाता है तो एक पीले रंग प्राप्त करने,: 4HNO 3 2 = 4NO + O 2 + 2H 2 हे नाइट्रिक एसिड जहरीली होती है।
नाइट्रिक एसिड (HNO 3) वर्गीकरण द्वारा: ऑक्सीजन की उपस्थिति: क्षारकता: पानी घुलनशीलता: अस्थिरता: इलेक्ट्रोलाइट पृथक्करण ऑक्सीजन में घुलनशील अस्थिर अकेले आधार मजबूत की डिग्री
नाइट्रिक एसिड उद्योग की तैयारी एनएच 3 सं सं 2 HNO 3 4NH 3 + 5O 2 = 4NO + 6H 2 हे 2NO + O 2 = 2NO 2 से 4 सं 2 + 2 एच 2 ओ + O 2 = 4 HNO 3 संपर्क अमोनिया ऑक्साइड को ऑक्सीकरण नाइट्रोजन (द्वितीय): 2। नाइट्रिक ऑक्साइड (द्वितीय) में नाइट्रिक ऑक्साइड (II) का ऑक्सीकरण: 3। ऑक्सीजन के अतिरिक्त पानी से नाइट्रिक ऑक्साइड (चतुर्थ) का सोखना (अवशोषण)
प्रयोगशाला में, हल्के गर्मी के तहत नाइट्रेट के लिए केंद्रित सल्फ्यूरिक एसिड के साथ नाइट्रिक एसिड की कार्रवाई के द्वारा प्राप्त की। NaNO 3 + एच 2 एसओ 4 = NaHSO 4 + एचएनओ 3
नाइट्रिक एसिड नाइट्रिक एसिड के रासायनिक गुण एसिड के सभी विशिष्ट गुण प्रदर्शित करते हैं। 1। 1 3 2 3 2) ठिकानों 1 के साथ बुनियादी और उभयधर्मी आक्साइड 3) के साथ) हदबंदी: गुण एक इलेक्ट्रोलाइट के रूप में 3 HNO HNO 3 = एच + + नहीं 3 - 2HNO 3 + CuO = Cu (कोई 3) 2 + H 2 हे 6HNO 3 + अल 2 हे 3 = 2AL (कोई 3) 3 + 3 एच 2 ओ HNO 3 + NaOH = नैनो 3 + H 2 हे 2HNO 3 + Zn (OH) 2 = Zn (कोई 3) 2 + 2H 2 हे 4) लवण 2HNO 3 + ना 2 SiO 3 = एच 2 SiO 3 ↓ + 2NaNO 3
2। ऑक्सीडेटिव गुण: विशेष रूप से धातु (! नाइट्रिक एसिड हाइड्रोजन कभी नहीं आवंटित करती है) मेरे + HNO 3 = मेरे साथ बातचीत (कोई 3) 2 + H 2 ↑ धातु एकाग्रता - रोवन (\u003e 60%) Nye पतला (5-60%) बहुत पतला (
विद्युत श्रृंखला स्थिति में धातुओं हाइड्रोजन की बाईं के बाद से: सी धातुओं विद्युत श्रृंखला हाइड्रोजन सही में खड़ा: सांद्र HNO 3, HNO 3 पतला नाइट्रिक एसिड के रासायनिक गुणों
2। ऑक्सीकरण संपत्ति 2) nonmetals (एस, पी, सी) के साथ गुण बातचीत: 3) कार्बनिक पदार्थों (तारपीन चमक) के साथ सूचना का आदान प्रदान: नाइट्रिक एसिड के रासायनिक गुण 3 पी + 5HNO 3 + H 2 O = 3H 3 पीओ 4 + 5NO सी + 4HNO 3 = सीओ 2 + H 2 O + 4NO 2 HNO 3 + 5 3 पी + H 2 हे → 2 एच 3 पीओ 4 + 3 सं 5
नाइट्रिक एसिड का आवेदन 1 5 4 6 2 3 नाइट्रोजन और जटिल उर्वरकों का उत्पादन। विनिर्माण विनिर्माण दवाओं विस्फोटकों रंजक विनिर्माण फिल्मों nitrovarnishes, nitroenamels धातु विज्ञान trawling में धातु के लिए कृत्रिम फाइबर 7 nitrating एसिड घटक के रूप में विनिर्माण
नाइट्रेट - नाइट्रिक एसिड लवण, धातु, उनके आक्साइड और हाइड्रॉक्साइड पर एसिड की कार्रवाई के द्वारा तैयार किया। साल्टपेटर - नाइट्रिक एसिड और क्षार धातुओं के नमक। नैनो 3 - सोडियम नाइट्रेट KNO 3 - पोटेशियम नाइट्रेट एनएच 4 सं 3 - अमोनियम नाइट्रेट सीए (कोई 3) 2 - कैल्शियम नाइट्रेट गुण पानी में सभी घुलनशील।
हीटिंग पर, नाइट्रेट और अधिक पूरी तरह से से सही धातु विद्युत श्रृंखला तनाव में नमक के गठन है विघटित कर रहे हैं। ली कश्मीर बा सीए ना मिलीग्राम अल Mn Zn सीआर फे सह Sn Pb Cu एजी एचजी Au नाइट्राइट + O 2 धातु ऑक्साइड + सं 2 + O 2 मेरे + सं 2 + O 2 2NaNO 3 = 2NaNO 2 + O 2 2PB (कोई 3) 2 = 2PbO + 4NO + O 2 2 3 2AgNO = 2Ag + 2NO 2 + O 2
नाइट्रेट उर्वरकों के रूप में उपयोग किया जाता है। केनो 3 का उपयोग काले पाउडर तैयार करने के लिए किया जाता है।
गृहकार्य: § 26, अभ्यास। 2.4 पृष्ठ 121।
विषय पर सबक का सार: "नाइट्रोजन के ऑक्सीजन यौगिकों"। ग्रेड 9
उद्देश्य: नाइट्रोजन आक्साइड के गुणों का अध्ययन करना।
उद्देश्यों:
शैक्षिक: नाइट्रोजन आक्साइड पर विचार, और उनके उदाहरण वर्गीकरण और आक्साइड की बुनियादी गुण दोहराने;
शैक्षिक: दुनिया की एक वैज्ञानिक तस्वीर का गठन;
विकास: तार्किक सोच का विकास, अतिरिक्त साहित्य के साथ काम करने की क्षमता, सामान्यीकरण और व्यवस्थित करने की क्षमता।
पाठ का पाठ्यक्रम।
संगठनात्मक पल
अध्ययन सामग्री दोहराएं।
कई छात्र कार्ड पर काम करते हैं, अन्य लोगों ने पिछले विषय पर एक फ्रंट-लाइन सर्वेक्षण आयोजित किया।
डिडैक्टिक कार्ड नंबर 1
ए) निम्नलिखित पदार्थों के लिए सूत्र लिखें: अमोनिया, अमोनिया, अमोनिया
अमोनियम के cation के लिए एक गुणात्मक प्रतिक्रिया;
बेरियम क्लोराइड के साथ अमोनियम सल्फेट की बातचीत।
डिडैक्टिक कार्ड नंबर 2
ए) निम्नलिखित पदार्थों के लिए सूत्र लिखें: अमोनियम डिच्रोमैट, अमोनिया, अमोनियम सल्फेट।
बी) निम्नलिखित प्रतिक्रिया समीकरण लिखें:
चांदी नाइट्रेट के साथ अमोनियम क्लोराइड की बातचीत;
हाइड्रोक्लोरिक एसिड के साथ अमोनियम कार्बोनेट की बातचीत।
फ्रंटल सर्वेक्षण:
1) "अमोनिया" क्या है? इसके लिए क्या उपयोग किया जाता है?
2) अमोनिया के गुण प्रशीतन में इसके उपयोग के आधार हैं?
3) अमोनिया कैसे एकत्र किया जाना चाहिए? क्यों? अमोनिया कैसे पहचाना जा सकता है?
5) अमोनिया क्या है? इसके लिए क्या उपयोग किया जाता है?
6) कार्बोनेट और अमोनियम बाइकार्बोनेट का उपयोग क्या है?
3. ज्ञान अद्यतन।
नाइट्रोजन ऑक्साइड में ऑक्सीकरण राज्य व्यवस्थित करें:
एन 2 ओ नहीं 2 ओ 3 नहीं 2 एन 2 ओ 5
नई सामग्री सीखना
शिक्षक पाठ के विषय, उद्देश्य और योजना की रिपोर्ट करता है।
योजना:
नाइट्रोजन ऑक्साइड का वर्गीकरण।
इस विषय पर छात्र का संदेश: "नाइट्रिक ऑक्साइड (आई) की खोज का इतिहास"।
नाइट्रोजन ऑक्साइड के भौतिक गुण (पाठ्यपुस्तक के पाठ के साथ स्वतंत्र काम)।
रासायनिक गुण, नाइट्रोजन ऑक्साइड का उत्पादन और अनुप्रयोग, (शिक्षक की कहानी और स्पष्टीकरण)।
नाइट्रोजन ऑक्साइड का वर्गीकरण। छात्र शिक्षक के साथ योजना पूरी करते हैं।
ओह  ksidy नाइट्रोजन
ksidy नाइट्रोजन
नॉनसोल्यूबल नमक
एन 2 ओ नहीं एन 2 ओ 3 → एचएनओ 2
एसिड, एन 2 ओ 5 → एचएनओ 3 के साथ बातचीत मत करो
न तो क्षार के साथ और न ही 2 2 → एचएनओ 2 और एचएनओ 3 के नमक बनाते हैं
छात्र रिपोर्ट विषय पर: "नाइट्रिक ऑक्साइड की खोज का इतिहास (मैं)».
हंसमुख गैस
अमेरिकन केमिकल 1800 में वह formamide HCONH 2 में सोडियम नाइट्राइट नैनो 2 गर्म समाधान के साथ सल्फर बातचीत का अध्ययन किया। अचानक, एक कमजोर सुखद गंध के साथ गैस की रिहाई के साथ एक हिंसक प्रतिक्रिया शुरू हुई। वोडाहाउस अचानक हंसमुख हो गया, और उसने गाने गाए, गाने गाए। अगले दिन, प्रयोगशाला के लिए लौट आए, यह कुप्पी में पाया जाता है अनुभव था जहां सोडियम thiosulfate ना 2 एस 2 हे 3 के क्रिस्टल। लगभग एक ही समय में ब्रिटिश रसायनज्ञ हम्फ्री डेवी अमोनियम नाइट्रेट का थर्मल अपघटन खर्च एनएच 4 सं 3। जैसा कि उसने बाद में याद किया, सहायक स्थापना के बहुत करीब था और कई बार उसने एक गैस को श्वास से आने वाली सुखद गंध के साथ श्वास लिया। अचानक, सहायक एक अनुचित हंसी में फट गया, और फिर कमरे के कोने में गिर गया और तुरंत सो गया।
वैज्ञानिकों को एक ही गैस - नाइट्रिक ऑक्साइड (आई) एन 2 ओ प्राप्त हुआ है।
ऑक्साइड सूत्र
भौतिक गुण
रासायनिक गुण
तैयारी और आवेदन
एन 2 ओ
सुखद मिठाई के साथ रंगहीन असंगत और।
2 एन 2 ओ → 2 एन 2 + ओ 2
एनएच 4 नहीं 3 → एन 2 ओ + 2 एच 2 ओ
नाइट्रस ऑक्साइड की छोटी सांद्रता एक आसान कारण बनती है(इसलिए नाम - "हंसी गैस")। श्वास लेने पर, शुद्ध गैस तेजी से नशा और उनींदापन विकसित करती है। नाइट्रस ऑक्साइड में कमजोर नारकोटिक गतिविधि होती है, जिसके संबंध में दवा में इसका उपयोग उच्च सांद्रता में किया जाता है.
रंगहीन गैस, पानी में खराब घुलनशील।
2NO + ओ 2 → 2NO2
4 एनएच 3 + 5 ओ 2 → 4NO + 6 एच 2 ओ
NO का उत्पादन उत्पादन चरणों में से एक है।
नहीं 2
जहर गैस, लाल-भूरा रंग, एक विशेष तीव्र गंध या पीले रंग के तरल के साथ। फॉक्स की पूंछ
नहीं 2 + एच 2 ओ → एचएनओ 2 + एचएनओ 3
4NO 2 + एच 2 ओ + ओ 2 → 4HNO 3
2NO 2 + 2NoOH → NaNO 3 + NaNO 2 + एच 2 ओ
2 क्यू (नहीं 3) 2 → 2 क्यूओ + 4 एनओ 2 + ओ 2
उत्पादन मेंऔर, एक तरल में एक ऑक्सीडाइज़र के रूप मेंऔर मिश्रित विस्फोटक।यह अत्यधिक जहरीला है। यह उच्च सांद्रता कारणों में श्वसन पथ को परेशान करता हैनहीं + नहीं 2 = एन 2 ओ 3
यह प्रयोगशाला में नाइट्रस एसिड और इसके लवण का उत्पादन करने के लिए प्रयोग किया जाता है। यह अत्यधिक जहरीला है। शरीर पर कार्रवाई करके फ्यूमिंग नाइट्रिक एसिड के साथ तुलनीय है, गंभीर त्वचा जलती है।
एन 2 ओ 5
रंगहीन, बहुत अस्थिर क्रिस्टल। बेहद अस्थिर
एन 2 ओ 5 + एच 2 ओ = 2 एच एन ओ 3
एन 2 ओ 5 + सीएओ = सीए (नहीं 3) 2
एन 2 ओ 5 + 2 NaOH = 2NaNO 3
2NO 2 + ओ 3 = एन 2 ओ 5 + ओ 2
एन 2 ओ 5 विषाक्त है।
4.Zakreplenie। Upr.6
5. प्रतिबिंब, संक्षेप में। मूल्यांकन.
6. गृहकार्य §26।