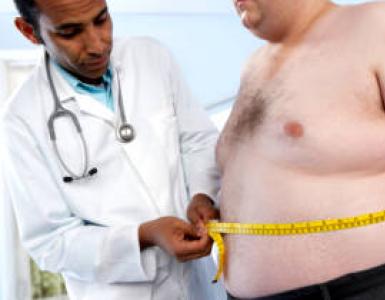
Oksygenforbindelser av nitrogen - Hypermarket of knowledge. Jeg oksygenforbindelser av nitrogen
Med grader av oksidasjon +1, +2, +3, +4, +5.
Oksider N20 og N0 er ikke-saltdannende (hva betyr dette?), Og de resterende oksyder er sure: N2O3 tilsvarer salpetersyre HN02 og N205 - salpetersyre HNO3. Nitrogenoksyd (IV) N02, når det oppløses i vann, danner samtidig to syrer - HNO2 og HNO3.
Hvis det oppløses i vann i nærvær av overflødig oksygen, oppnås bare salpetersyre
4N02 + 02 + 2H20 = 4HNO3
Nitrogenoksyd (IV) NO2 er en brun, veldig giftig gass. Det oppnås lett ved oksydasjon av fargeløst ikke-saltdannende nitrogenoksyd (P) ved atmosfærisk oksygen:
Innhold i leksjonen sammendrag av leksjonen støtte rammeverk presentasjon av leksjon akselerative metoder interaktive teknologier praksis Oppgaver og øvelser, selvstudier, opplæringer, saker, oppdrag, lekser, diskusjonsemner, retoriske spørsmål fra studenter illustrasjoner lyd, video og multimedia bilder, bilder grafikk, tabeller, ordninger humor, anekdoter, vitser, tegneserier ligner, ord, kryssord, sitater kosttilskudd abstracts artikler av brikken for nysgjerrige cheat ark lærebøker grunnleggende og tilleggsbetingelser i ordlisten andre Forbedring av lærebøker og leksjoner Korrigering av feil i læreboken oppdatere fragmentet i læreboken elementer av innovasjon i leksjonen for å erstatte utdatert kunnskap med nye Kun for lærere perfekte leksjoner en kalenderplan for året, de metodiske anbefalingene i diskusjonsprogrammet Integrerte leksjonerLaboratorium og praktisk leksjon № 21
Emne 2.1.3. Den viktigste undergruppen av Gruppe V
Emnet i leksjonen er "Egenskaper for forbindelser av oksidert nitrogen, fosfor og dets forbindelser".
Målet med leksjonen:
· For å forbedre kunnskapen om egenskapene til oksygenholdige nitrogen- og fosforforbindelser ved å utføre øvelser på formuleringen av reaksjonsligninger som viser
Kjemiske egenskaper av oksygenholdige forbindelser av nitrogen og fosfor;
Funksjoner av samspillet mellom salpetersyre og metaller,
Termisk dekomponering av nitrater.
· Oppnå ferdigheter
Ytelse av kvalitative reaksjoner på nitrat-, nitritt-, fosfat-ioner.
· For å forbedre ferdighetene til å utarbeide likningene av redoksreaksjoner
I Teoretisk del:
Jeg oksygenforbindelser av nitrogen.
1. Nitrosyre.Nitrosyre er svak, ustabil, eksisterer bare i oppløsning. Ved samhandling med alkalier danner det saltnitritt.
Nitrosyre salter - nitritt - er ganske motstandsdyktige mot varme. Med unntak av AgNO 2 er de alle lett løselig i vann. Som nitrosyre selv har nitritt oksidasjonsreduksjons-dualitet:
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNOz + 2MnSO4 + K2SO4 + 3H20
reduksjonsmiddel
2KI + 2KNO2 + 2H2SO4 = I2 + 2NO + 2K2SO4 + 2H20
oksidant
Reaksjonen med KI i et surt medium blir mye brukt i analytisk kjemi for påvisning av NO 2 -nitrition (det frigjorte jod danner en blåfarget forbindelse med stivelse).
De fleste salter av salpetersyre er giftige.
Den største bruken er laget av natriumnitrit NaNO 2, som er mye brukt i produksjon av organiske fargestoffer, medisinske stoffer, i analytisk kjemi. I medisinsk praksis brukes den som en vasodilator for angina pectoris, og også som en motgift mot cyanidforgiftning.
Toksisiteten av nitritt når den brukes i store mengder skyldes at kroppen produserer fri salpetersyre. Deretter omdannes oksygenhemoglobin til metemoglobin, dannelsen av hvilke skaper tilstander for oksygen sult av vev, siden slikt blod ikke er i stand til å bære oksygen. Død fra lammelse av luftveiene kan forekomme.
2. Salpetersyre utviser både de typiske egenskapene til sterke uorganiske syrer på grunn av tilstedeværelsen av hydrogenkation i oppløsningen, så vel som de spesifikke egenskaper på grunn av nitrationens oksiderende evne.
Salpetersyre, som en sterk uorganisk syre, interagerer med metalloksider, baser, salter:
2HNO3 + CuO = Cu (NO3) 2 + H20;
2HNO3 + Ba (OH) 2 = Ba (NO3) 2 + 2H20;
2HNO3 + CaCO3 = Ca (NO3) 2 + CO2 + H20;
2HNO3 + Na2SiO3 = 2NaNO3 + H2SiO3.
Salpetersyre er en meget sterk oksidant, siden den inneholder et nitrogenatom i maksimal oksidasjonstilstand (+5). Det samhandler med mange enkle og komplekse stoffer.
Salpetersyre oksyderer nesten alle metaller, unntatt gull, platina og platinmetaller, samt mange ikke-metaller og komplekse stoffer.
Ved oppvarming dekomponerer den:
4HNO3 4NO2 + 2H20 + 02
Når salpetersyre reagerer med reduksjonsmidler, blir hydrogen som regel ikke frigjort. Det er en reduksjon av nitrogen til oksidasjonstilstander
-3 til 4, avhengig av reaksjonsbetingelsene, syrekonsentrasjonen og gjenvinningsegenskaper koreaktant.
Jo lavere syrekonsentrasjonen og de mer uttalt reduksjon egenskaper koreaktantmaterialer, jo dypere gjenvinningen av salpetersyre finner sted. I samspillet mellom inaktive metaller og konsentrert salpetersyre, som regel NO 2:
Ag + 2NNO 3 (kons) = AgNO3 + NO2 + H2O
Ved omsetning av inaktive metall med en fortynnet salpetersyre fremstilles vanligvis nitrogenoksid (II):
3Cu + 8HNO 3 (dil) = 3Cu (NO3) 2 + 2NO + 4H 2 O.
I reaksjonen av salpetersyre med aktive metaller typisk en blanding av flere produkter vocstanovleniya, selv om man kan dominere. For eksempel, dersom interaksjonen av sink med salpetersyre, er reduksjonsproduktet endres med avtagende syrekonsentrasjon:

Konsentrert salpetersyre passive jern, krom, aluminium og andre metaller, slik at den transporteres med jernbane på stål- og aluminiumstanker.
Med ikke-metaller reagerer meget konsentrerte (mer enn 60% th) salpetersyre, mens den er redusert til NO2 eller NO:
6HNO3 + S = H2S04 + 6NO2 + 2H20;
5HNO 3 + R = H 3 PO + 4 5NO 2 + H2O;
2HNO3 + S = H2S04 + 2NO;
5HNO3 + 3P + 2H20 = 3H3P04 + 5NO
Konsentrert salpetersyre samhandler med komplekse stoffer, oksiderer dem.
En blanding av ett volum av HNO3 og HCl tre volumer kalt kongevann, ettersom den løser opp "king metaller" - gull. Den totale ligningen av denne reaksjonen
Au + HNO3 + H = 4NSI [Ausi 4] + NO + 2H 2 O.
Å være monobasisk utgjør salpetersyre en rad salter - nitrater. De er alle meget oppløselig i vann, er salpetersyre mer stabil og derfor nesten ingen oksiderende egenskaper oppviser i vandige oppløsninger. Men når syreoppløsninger surgjøres, forbedres egenskapene til nitrater som oksidanter.
Side 1
Oksygenforbindelser av nitrogen er et klart eksempel på hvordan å endre kvaliteten av de organer som ved skifte av deres kvantitative sammensetning. Den første er gass, den andre, ved vanlig temperatur, er en fast krystallinsk kropp.
Oksygen nitrogenforbindelser finnes for alle sine positive oksidasjonstilstander fra 1 til V. H2N2O2 hyponitrous syre og dens salter - giponitrity - ekstremt ustabile når de oppvarmes, har en svak oksyderende og reduserende egenskaper.
Oksygen nitrogenforbindelse, karakterisert ved at det oppviser høyere valens - N2Os, polupyatiokis nitrogen, nitrogendioksyd.
Oksygen Nitrogen forbindelser er levende eksempler på hvordan å endre kvaliteten av de organer som ved skifte av deres kvantitative sammensetning. Den første er gass, den andre, ved vanlig temperatur, er en fast krystallinsk kropp.
Oksygen nitrogenforbindelser (SU, V) oksyderes i surt miljø HoS, Phg, RI i en oppløsning for å danne vannløselige forbindelser.
La oss se på oksygenforbindelsene av nitrogen.
NO2X evne av oksygen til nitrogen-forbindelser og komplekser eoobrazovaniyu-nitreringsreaksjonen med å bli definert som elektrofile og koordinering umettet nitrogenatom. For det samme koordinasjonstall elektrofilisiteten aktivitet bestemmes, er den mest aktive frie nitronium kation ONO. Solvation reduserer sin aktivitet sterkt. Senking av stemme inn i nitrogruppen til kjernen med økende temperatur Titov forklarer reduksjon i oppløsnings nitronium-kation.
Kjemien til oksygenforbindelser av nitrogen og fosfor har allerede blitt vurdert av oss; Vi har nå vurdere elementer av undergruppene A og B. kjemisk oksygen vanadiumforbindelser elektropositivt Minst av alle elementene i undergruppen A, ligner på mange måter den fosfor kjemi. Siden disse to elementene har samme koordinasjonstall med hensyn til oksygen, hydroksyforbindelsen den samme oppskrift har lignende struktur og ofte er isomorf med hverandre, så vel som isomorfe tilsvarende forbindelser av arsen. For eksempel, isomorfe er dodekagid-rata Na3PO4, Na3AsO4, Na3VO4, så vel som komplekse salter av R3 (PO4) C1, PB5 (AsOJCl og PB5 (VO4) Cl Vanadium er vidt fordelt i naturen ;. Det oppstår vanligvis sammen med fosfor i form av vanadium-ing (store forekomster av sjeldent mineral patronita VSB er også meget viktig vanadium kilde), og niob og tantal er ofte funnet med andre overgang eller sjeldne jordmetaller er kjente orto -., meta - og pyrovanadate, men hvor graden av stabilitet av disse forbindelser i vandige oppløsninger av den inverse av motstanden tilsvarende fosfa s.
Oksygenforbindelser av nitrogen inkluderer alle nitrogenoksyder, salpetersyre og salpetersyrer og deres salter.
I oksygenforbindelser av nitrogen står et nitrogenatom for fra 0 til 5 oksygenatomer. Avhengig av forholdene kan nitrogenatomet feste eller miste deler eller alle oksygenatomer.
Som alle oksygenforbindelser av nitrogen, er dessitrogenoksyd en endotermisk forbindelse, og oksygen i det holdes spedalskhet. Derfor, hydrogen, kull, parafin og andre for-brennings brenne i det, så vel som i ren oksygenflamme med bred blålig halo.
Som alle oksygenforbindelser av nitrogen, er dessitrogenoksyd en endotermisk forbindelse, oksygenet i den holdes ustabil. Derfor er hydrogen, kull, petroleum og andre brennbare stoffer; brenne i det så vel som i rent oksygen, flamme, med en bred blåaktig aura.
Oksyder av nitrogen og oksygenforbindelser av forskjellige grader av oksydasjon fremstilles ved oksydasjon av ammoniakk til nitrogenoksyder ved første (katalysator prosess), som deretter lett oksyderes av luftoksygen til salpetersyre.
Synopsis kjemi leksjon i klasse 9 tittelen "Oxygen Nitrogenforbindelser" for pedagogisk kompleks O.S.Gabrielyana. Arbeidet tar sikte på å vurdere de redoks-koblings egenskaper for eksempel nitrogenioner oksygen soedineniy.Konspekt omfatter pedagogisk, utviklings, pedagogiske og helsebesparende problem.
laste ned:
Preview:
For å bruke en forhåndsvisning av presentasjonene dine, opprett deg en konto (en Google-konto) og logg inn på den: https://accounts.google.com
Signaturer til lysbilder:
Oksygenforbindelser av nitrogen.
Nitrogenoksider. Kväve danner seks oksygenforbindelser. grad av oksidasjon + 1 N 2 O + 2 NO + 3 N 2 O 3 + 4 NO 2, N 2 O 4 + 5 N 2 O 5
Fremstilling: NH4 NO = N 2 O + 2 H 2 O De kjemiske egenskaper: 1. Den dekomponering ved oppvarming av 2 N 2 1 O = 0 2 N 2 + O 2 2 N 2 til hydrogen 1 O + H2 = N 2 0 + H2O nesoleobrazuyuschy 1 N 2 O nitrogenoksid (i), lystgass eller "lystgass", stimulerende virkning på menneskets nervesystem brukes i medisin som en bedøvelsesmiddel. Fysiske egenskaper: gass, uten farge og lukt. Det viser oksiderende egenskaper, lett dekomponerer.
NO 2 Fremstilling: 1. Natur: N2 + O2 = 2NO 2. I industrien: 3 NH4 + 5O 2 = 4NO + 6H 2 O kjemiske egenskaper: 1. lett oksidert: 2 N 2 O 2 + O = 2 N 4 O 2 oksidant 2. 2 N 2 O + 2SO 2 = 2SO 3 + N 2 0 nesoleobrazuyuschy fargeløs gass, termisk stabile, dårlig oppløselig i vann, praktisk talt øyeblikkelig omsatt med oksygen (ved romtemperatur).
N 2 O 3 +3 Kjemiske egenskaper: NO 2 + NO N 2 O 3 Forberedelse: ALLE egenskaper av sure oksider. surt oksyd væske fra mørk blå farge, termisk ustabil, t oppvarmet. = 3,5 0 ° C, m. e. det er flytende bare under avkjøling, under normale forhold går over i gassform. Når det reagerer med vann, dannes salpetersyre.
NO2 + Fremstilling 4: 1. 2 NO + O2 = 2NO 2 2. Cu + 4HNO 3 (i) = Cu (NO3) 2 + 2NO + 2 2 H 2 O De kjemiske egenskaper: 1 med vann 2 NO2 + H 2 O = HNO3 + HNO 2 2. alkalier 2NO 2 + 2NaOH = NaNO 3 + NaNO2 + H 2 O 3. dimerisering 2NO 2 N 2 O 4-toksisk nitrogen oksyd (IV) eller nitrogendioksyd, brun gassbrønn Oppløselig i vann, reagerer fullt ut med det. Det er et sterkt oksidasjonsmiddel.
N 2 O 5 + 5 Fremstilling: 1. 2NO + 2 O 3 = N 2 O 5 O 2 + 2. 2HNO 3 + P 2 O 5 = 2HPO 3 + n 2 O 5 Kjemiske egenskaper: 1. lett spaltes 2 N 2 O 5 = 4NO2 + 022. sterkt oksidasjonssyre oksidoksydoksid (V), salpetersyreanhydrid, hvitt faststoff (smeltepunkt = 41 ° C). Det viser sure egenskaper, det er en veldig sterk oksidasjonsmiddel.
HNO 3-sammensetning. Strukturen. Egenskaper. H O N O O - - grad av oksidasjon av nitrogen nitrogen valens +5 IV polar kovalent kjemisk binding Salpetersyre - fargeløst, hygroskopisk væske, c stikkende lukt, "røyker" i luften på ubestemt tid oppløselige i vann. T smeltepunkt -41,59 ° C, kokende +82,6 ° C med delvis nedbrytning. Ved lagring av lyset blir spaltet til et nitrogenoksid (IV), oksygen og vann, få en gulaktig farge: 4HNO 3 2 = 4NO + O2 + 2 H 2 O Salpetersyre er giftig.
Salpetersyre (HNO3) er klassifisert i nærvær av oksygen: basisitet: vannoppløselighet: flyktighet: graden av elektrolytisk dissosiasjon oksygen-oppløselige flyktig enbasisk sterk
Fremstilling av salpetersyre industri NH3 NO NO 2 HNO3 4NH 3 + 5O 2 = 4NO + 6 H 2 O 2NO + O2 = 2NO 2 4 NO2 + 2 H2O + O2 = 4 HNO3 kontakt ammoniakkoksidasjon til oksyd nitrogen (II): 2. Oksidasjon av nitrogenoksid (II) i nitrogenoksid (IV): 3. Adsorbsjon (absorpsjon) av nitrogenoksid (IV) med vann med overskudd av oksygen
I laboratoriet oppnås salpetersyre ved virkningen av konsentrert svovelsyre på nitrater med mild oppvarming. NaNO3 + H2SO4 = NaHSO4 + HNO3
Kjemiske egenskaper av salpetersyre Salpetersyre utviser alle de typiske egenskapene til syrer. 1. Egenskaper HNO3 som en elektrolytt: 1 3 2 3 2) sammen med de grunnleggende og amfotære oksyder 3) med baser 1) Dissosiering: HNO 3 = H + + NO 3 - 2HNO 3 + CuO = Cu (NO3) 2 + H2 O 6HNO 3 + Al 2O 3 = 2Al (NO 3) 3 + 3H O 2 HNO3 + NaOH = NaNO 3 + H2O 2HNO 3 + Zn (OH) 2 = Zn (NO3) 2 + 2 H 2 O 4) salter av 2HNO3 + Na2SiO3 = H2SiO3 ↓ + 2NaNO3
2. Oksidative egenskaper: interaksjon særlig med metaller (! Salpetersyre aldri allokerer hydrogen) Me + HNO3 = Me (NO3) 2 + H2 ↑ Metall-konsentrasjon - Rowan (\u003e 60%) Nye fortynnet (5-60%) Meget fortynnet (
Siden metaller i spenningsrekken stående igjen av hydrogen: C metaller stående i spenningsrekken hydrogen høyre: Konsentrert HNO3, HNO3 Fortynnet kjemiske egenskaper av salpetersyre
2. Oksyderende eiendom 2) Egenskaper for vekselvirkning med ikke-metaller (S, P, C): 3) samvirker med de organiske stoffer (terpentin blinker): Kjemiske egenskaper av salpetersyre 3P + 5HNO 3 + H2O = 3 H 3 PO 4 + 5NO C + 4HNO 3 = CO 2 + H 2 O + 4NO 2 5 HNO 3 + 3 P + 2 H 2 O → 3 H 3 PO 4 + 5 NO
Anvendelse av salpetersyre 1 5 4 6 2 3 Produksjon av nitrogen og kompleks gjødsel. Fremstilling eksplosiver produksjon legemidler fargestoffer produksjons filmer nitrovarnishes, Nitro fremstilling av kunstige fibre 7 som den nitreringssyre komponenten til metall i metallurgi tråling
Nitrater - salter av salpetersyre, oppnås ved hjelp av syre på metaller, deres oksider og hydroksyder. Saltpeter - Salter av salpetersyre og alkalimetaller. NaNO 3 - natriumnitrat KNO 3 - kaliumnitrat NH4 NO3 - ammoniumnitrat Ca (NO3) 2 - kalsiumnitrat Properties alle er oppløselige i vann.
Når det oppvarmes, dekomponerer nitrater fyldigere enn den høyre i den elektrokjemiske spenningsserien er metallet som danner saltet. Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Sn Pb Cu-Ag-Hg Au nitritt + O 2 metalloksyd + NO2 + O 2 Me + NO2 + O 2 2NaNO 3 = 2NaNO 2 + O 2 2PB (NO 3) 2 = 2PbO + 4NO2 + 022AgNO3 = 2Ag + 2NO2 + 02
Nitrater brukes som gjødsel. KNO 3 brukes til å tilberede svart pulver.
Hjemmearbeid: § 26, øvelse. 2,4 s. 121.
Sammendrag av leksjonen om emnet: "oksygenforbindelser av nitrogen". Grad 9
Formålet med leksjonen er å studere egenskapene til nitrogenoksyder.
mål:
pedagogisk: å vurdere nitrogenoksider, og på deres eksempel for å gjenta klassifisering og grunnleggende egenskaper av oksider;
pedagogisk: dannelsen av et vitenskapelig bilde av verden;
utvikling: utvikling av logisk tenkning, evnen til å arbeide med tilleggslitteratur, evnen til å generalisere og systematisere.
Løpet av leksjonen.
Organisasjons øyeblikk.
Gjenta det studerte materialet.
Flere studenter jobber med kort, mens de andre har utført en frontlinjeundersøkelse om forrige tema.
Didaktisk kortnummer 1
a) Skriv formler for følgende stoffer: ammoniakk, ammoniakk, ammoniakk
En kvalitativ reaksjon på kation av ammonium;
Interaksjon av ammoniumsulfat med bariumklorid.
Didaktisk kortnummer 2
a) Skriv formler for følgende stoffer: ammoniumdikromat, ammoniakk, ammoniumsulfat.
b) Skriv følgende reaksjonsligninger:
Interaksjon av ammoniumklorid med sølvnitrat;
Interaksjon av ammoniumkarbonat med saltsyre.
Frontundersøkelse:
1) Hva er "ammoniakk"? Hva er det brukt til?
2) Hvilke egenskaper av ammoniakk er grunnlaget for bruk i kjøling?
3) Hvordan skal ammoniakk oppsamles? Hvorfor? Hvordan kan ammoniakk bli anerkjent?
5) Hva er ammoniakk? Hva er det brukt til?
6) Hva er bruken av karbonat og ammoniumbikarbonat?
3. Kunnskapsoppdatering.
Ordne oksidasjonstilstander i nitrogenoksyder:
N2O NO2O3NO2N205
Lære nytt materiale.
Læreren rapporterer temaet, hensikten og planen i leksjonen.
plan:
Klassifisering av nitrogenoksyder.
Studentens melding om emnet: "Historien om oppdagelsen av nitrogenoksid (I)".
Fysiske egenskaper av nitrogenoksyder (uavhengig arbeid med tekstbokens tekst).
Kjemiske egenskaper, produksjon og anvendelse av nitrogenoksyder, (historie og forklaring av læreren).
Klassifisering av nitrogenoksyder. Studentene fullfører ordningen med læreren.
Oh  ksidy nitrogen
ksidy nitrogen
Uoppløselige salter
N2O NO N2O3 → HNO2
ikke interagere med syrer, N 2 O 5 → HNO 3
verken med alkalier eller danner salter av NO 2 → HNO 2 og HNO 3
Studentrapport om emnet: "Historien om oppdagelsen av nitrogenoksid (jeg)».
Munter gass.
En amerikansk kjemiker i 1800 studerte vekselvirkningen av svovel med en oppvarmet løsning av natriumnitrit NaNO 2 i formamid HCONH 2. Plutselig begynte en voldelig reaksjon med utslipp av gass med en svak behagelig lukt. Wodehouse ble plutselig glad, og han begynte å danse, synge sanger. Neste dag, tilbake til laboratoriet, fant han krystaller av natriumtiosulfat Na2S203 i kolben hvor eksperimentet pågikk. Nesten samtidig gjorde den engelske kjemikeren Gemfri Devi den termiske dekomponeringen av NH 4 NO 3 ammoniumnitrat. Som han husket senere, var assistenten for nær installasjonen og flere ganger inhalerte han en gass med en behagelig lukt som kommer fra retorten. Plutselig brøt assistenten inn i en urimelig latter, og falt da i hjørnet av rommet og sovnet umiddelbart.
Forskere har fått samme gass - nitrogenoksid (I) N 2 O.
Oksydformelen
Fysiske egenskaper
Kjemiske egenskaper
Klargjøring og anvendelse
N 2 O
fargeløs ubrennbar med behagelig søtt og.
2N20 → 2N2 + 02
NH4NO3 → N20 + 2H20
Små konsentrasjoner av nitrogenoksid gir en enkel(dermed navnet - "lattergas"). Ved innånding utvikler ren gass raskt forgiftning og døsighet. Nitrogenoksyd har en svak narkotisk aktivitet, i forbindelse med hvilken det i medisin brukes i høye konsentrasjoner.
fargeløs gass, dårlig løselig i vann.
2NO + O2 → 2NO2
4 NH3 + 502 → 4NO + 6H20
Produksjonen av NO er en av produksjonsstrinnene.
NEI 2
Giftig gass, rødbrun farge, med en karakteristisk akutt lukt eller en gulaktig væske. Fox hale.
NEI 2 + H20 → HNO2 + HNO3
4NO2 + H20 + O2 → 4HNO3
2NO2 + 2NaOH → NaNO3 + NaNO2 + H20
2Cu (NO3) 2 → 2CuO + 4NO2 + 02
I produksjonog, som oksidasjonsmiddel i en væskeog blandede eksplosiver.Det er svært giftig. Det irriterer luftveiene, i høye konsentrasjoner forårsakerNEI + NO 2 = N 2 O 3
Det brukes i laboratoriet for å produsere salpetersyre og dets salter. Det er svært giftig. Ved handling på kroppen er sammenlignbar med fuming salpetersyre, forårsaker alvorlige hudforbrenninger.
N 2 O 5
fargeløse, meget flyktige krystaller. Ekstremt ustabil.
N205 + H20 = 2HN03
N205 + CaO = Ca (NO3) 2
N205 + 2 NaOH = 2NaNO3
2NO2 + O3 = N2O5 + O2
N 2 O 5 er giftig.
4.Zakreplenie. Upr.6
5. Refleksjon, oppsummering. evaluering.
6. Hjemmearbeid §26.