สารออกซิเจนของไนโตรเจน - ไฮเปอร์มาร์เก็ตความรู้ I สารประกอบออกซิเจนของไนโตรเจน
มีองศาออกซิเดชัน +1, +2, +3, +4, +5
ออกไซด์ nesoleobrazuyuschie N0 และ N20 (สิ่งนี้หมายความว่า?) และออกไซด์ที่เหลือ - กรด: N2O3 สอดคล้องกรดไนตรัส NN02 และ N205 - HNO3 กรดไนตริก ไนตริกออกไซด์ (IV) N02 เมื่อละลายในน้ำจะเกิดเป็นกรด - HNO2 และ HNO3
ถ้าละลายในน้ำในที่ที่มีออกซิเจนมากเกินไปจะได้รับกรดไนตริกเท่านั้น
4N02 + 02 + 2H20 = 4HNO3
ไนตริกออกไซด์ (IV) NO2 เป็นก๊าซที่เป็นพิษและเป็นสีน้ำตาลมาก มันได้ง่ายโดยการออกซิเดชันของไม่มีไนตริกออกไซด์ที่ไม่มีเกลือขึ้นรูป (P) โดยออกซิเจนในชั้นบรรยากาศ:
เนื้อหาของบทเรียน บทสรุปของบทเรียน การสนับสนุนกรอบการนำเสนอของบทเรียนวิธีการเร่งแบบโต้ตอบเทคโนโลยี การปฏิบัติ งานและการออกกำลังกายการฝึกอบรมการตรวจสอบตนเอง, การฝึกอบรม, กรณี, quests การสนทนาการบ้านหัวข้อคำถามเชิงโวหารจากนักเรียน ภาพประกอบ เสียงวิดีโอและมัลติมีเดีย ภาพถ่าย, กราฟิกรูปภาพตารางอารมณ์ขันแผนเกร็ดเล็กเกร็ดน้อย, ตลก, นิยายการ์ตูน, คำพูด, ปริศนาคำไขว้, คำพูด ผลิตภัณฑ์เสริมอาหาร บทคัดย่อ บทความของชิปสำหรับตำราโกงขี้สงสัยคำศัพท์พื้นฐานและเพิ่มเติมของพจนานุกรมอื่น ๆ การปรับปรุงตำราและบทเรียน การแก้ไขข้อผิดพลาดในตำราเรียน การปรับปรุงส่วนในองค์ประกอบของตำราเรียนของนวัตกรรมในบทเรียนเกี่ยวกับการแทนที่ความรู้ล้าสมัยด้วยสิ่งใหม่ ๆ สำหรับครูเท่านั้น บทเรียนที่สมบูรณ์แบบ แผนปฎิทินประจำปี, คำแนะนำเกี่ยวกับระเบียบวิธีวิจัยของโครงการอภิปราย บทเรียนแบบรวมห้องปฏิบัติการและภาคปฏิบัติ№ 21
หัวข้อ 2.1.3 กลุ่มย่อยหลักของกลุ่ม V
หัวข้อของบทเรียนคือ "สมบัติของสารประกอบของไนโตรเจนออกซิเดชันฟอสฟอรัสและสารประกอบของมัน"
วัตถุประสงค์ของบทเรียน:
·ปรับปรุงความรู้เกี่ยวกับคุณสมบัติของไนโตรเจนและฟอสฟอรัสที่มีออกซิเจนโดยการฝึกสมาธิในการกำหนดสูตรสมการปฏิกิริยา
สมบัติทางเคมีของสารประกอบไนโตรเจนและฟอสฟอรัสที่มีออกซิเจน
คุณสมบัติของการปฏิสัมพันธ์ของกรดไนตริกกับโลหะ,
การสลายตัวด้วยความร้อนของไนเตรต
·มีทักษะ
สมรรถนะของปฏิกิริยาเชิงคุณภาพกับไนเตรตไนไตรท์ฟอสเฟตไอออน
·เพื่อพัฒนาทักษะในการวาดสมการปฏิกิริยารีดอกซ์
I ส่วนทางทฤษฎี:
I สารประกอบออกซิเจนของไนโตรเจน
1. กรดไนตรัสกรดไนตริกอ่อนแอไม่เสถียรมีอยู่ในสารละลายเท่านั้น เมื่อปฏิสัมพันธ์กับสารอัลคาไลจะก่อตัวเป็นเกลือ - ไนไตรท์
เกลือไนตรัส - ไนไตรต์ - ทนต่อความร้อนได้ดี ยกเว้น AgNO 2 พวกเขาทั้งหมดละลายได้อย่างง่ายดายในน้ำ เช่นเดียวกับกรดไนตรัสไนไตรต์มีความเป็นคู่ลดออกซิเดชั่น:
5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNOz + 2MnSO 4 + K 2 SO 4 + 3H 2 O
ตัวแทนลด
2KI + 2KNO 2 + 2H 2 SO 4 = I 2 + 2NO + 2K 2 SO 4 + 2H 2 O
สันดาป
ปฏิกิริยากับ KI ในกรดมีการใช้กันอย่างแพร่หลายในการวิเคราะห์ทางเคมีเพื่อตรวจหาไอออนไนไตรท์ NO 2 (ไอโอดีนที่ปลดปล่อยเป็นสารประกอบสีฟ้ากับแป้ง)
เกลือส่วนใหญ่ของกรดไนตรัสเป็นพิษ
การใช้งานที่ยิ่งใหญ่ที่สุดคือโซเดียมไนไตรท์ NaNO 2 ซึ่งใช้กันอย่างแพร่หลายในการผลิตสีย้อมอินทรีย์สารเคมีในการวิเคราะห์ทางเคมี ในทางการแพทย์มันถูกใช้เป็นเครื่องขยายหลอดเลือดสำหรับโรคหลอดเลือดหัวใจตีบและยังเป็นยาแก้พิษไซยาไนด์
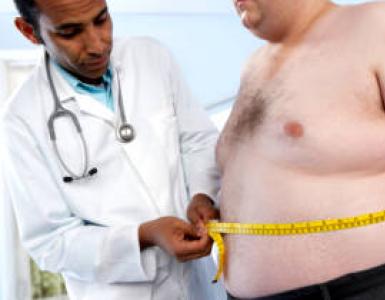
ความเป็นพิษของไนไตรท์เมื่อใช้ในปริมาณมากเป็นผลมาจากข้อเท็จจริงที่ว่าร่างกายผลิตกรดไนตรัสฟรี จากนั้นเฮโมโกลบินออกซิเจนจะถูกเปลี่ยนเป็น methemoglobin ซึ่งก่อให้เกิดสภาพการขาดออกซิเจนของเนื้อเยื่อเนื่องจากเลือดดังกล่าวไม่สามารถนำออกซิเจนได้ อาจเกิดจากความตายจากอัมพาตของระบบทางเดินหายใจ
2. กรดไนตริก มีคุณสมบัติทั่วไปของกรดอนินทรีย์ที่แข็งแกร่งเนื่องจากมีสารประกอบไฮโดรเจนในสารละลายรวมทั้งสมบัติเฉพาะที่เกิดจากความสามารถในการออกซิไดซ์ของไอออนไนเตรต
กรดไนตริกเป็นกรดอนินทรีย์ที่แข็งแกร่งมีปฏิสัมพันธ์กับโลหะออกไซด์ฐานเกลือ:
2HNO 3 + CuO = Cu (NO 3) 2 + H 2 O;
2HNO 3 + Ba (OH) 2 = Ba (NO 3) 2 + 2H 2 O;
2HNO 3 + CaCO 3 = Ca (NO 3) 2 + CO 2 + H 2 O;
2HNO 3 + Na 2 SiO 3 = 2NaNO 3 + H 2 SiO 3
กรดไนตริกเป็นสารออกซิแดนท์ที่แรงมากเนื่องจากมีอะตอมไนโตรเจนอยู่ในสภาวะออกซิเดชั่นสูงสุด (+5) มันมีปฏิสัมพันธ์กับสารที่ง่ายและซับซ้อนมาก
กรดไนตริกออกซิไดซ์เกือบทุกโลหะยกเว้นโลหะทองคำทองคำขาวและทองคำขาวตลอดจนสารที่ไม่ใช่โลหะและสารประกอบที่ซับซ้อน
เมื่อได้รับความร้อนจะสลายตัว:
4HNO 3 4NO 2 + 2H 2 O + O 2
เมื่อกรดไนตริกทำปฏิกิริยากับตัวรีดิวซ์ไฮโดรเจนจะไม่ถูกปล่อยออกมา มีการลดลงของไนโตรเจนต่อสภาวะออกซิเดชัน
จาก +4 ถึง -3 ขึ้นอยู่กับสภาวะของปฏิกิริยาความเข้มข้นของกรดและสมบัติการลดของสารกัน
ความเข้มข้นของกรดจะลดลงและคุณสมบัติในการลดฤทธิ์ลดลงของกรดไนตริกจะลดลง ในการปฏิสัมพันธ์ของโลหะที่ไม่ใช้งานกับกรดไนตริกที่เข้มข้นตามกฎ NO 2:
Ag + 2NNO 3 (conc) = AgNO 3 + NO 2 + H 2 O
เมื่อปฏิกิริยาโลหะที่ไม่ใช้งานกับกรดไนตริกเจือจางตามกฎไนตริกออกไซด์ (II) จะเกิดขึ้น:
3Cu + 8HNO 3 (razb) = 3Cu (NO 3) 2 + 2NO + 4H 2O
เมื่อกรดไนตริกทำปฏิกิริยากับโลหะที่ใช้งานได้มักเกิดส่วนผสมของผลิตภัณฑ์หลายอย่างขึ้นมาแม้ว่าจะมีหลายชนิดที่เด่นกว่าก็ตาม ตัวอย่างเช่นในการปฏิสัมพันธ์ของสังกะสีกับกรดไนตริกการลดลงของผลิตภัณฑ์จะเปลี่ยนแปลงไปตามความเข้มข้นของกรดที่ลดลง:

กรดไนตริกเข้มข้นผ่านเหล็ก, โครเมียม, อลูมิเนียมและโลหะอื่น ๆ บางชนิดดังนั้นจึงมีการขนส่งโดยทางรถไฟในถังเหล็กและอลูมิเนียม
เมื่อใช้สารที่ไม่ใช่โลหะกรดไนตริกเข้มข้นมาก (มากกว่า 60%) จะทำปฏิกิริยาระหว่าง NO 2 หรือ NO:
6HNO 3 + S = H 2 SO 4 + 6NO 2 + 2H 2 O;
5HNO 3 + P = H 3 PO 4 + 5NO 2 + H 2 O;
2HNO 3 + S = H 2 SO 4 + 2NO;
5HNO 3 + 3P + 2H 2O = 3H 3 PO 4 + 5NO
กรดไนตริกเข้มข้นมีปฏิสัมพันธ์กับสารที่มีความซับซ้อน oxidizing พวกเขา
มีส่วนผสมของปริมาณหนึ่ง HNO 3 และ HCl สามเล่มเรียกว่ากรดกัดทองเพราะมันละลาย "โลหะกษัตริย์" - ทอง สมการทั้งหมดของปฏิกิริยานี้
Au + HNO 3 + 4HCl = H [AuCI 4] + NO + 2H 2 O
กรดไนตริกเป็นหนึ่งเดียวของเกลือ - ไนเตรต ทั้งหมดมีความสามารถในการละลายน้ำได้ดีกว่ากรดไนตริกดังนั้นจึงไม่มีคุณสมบัติในการออกซิไดซ์ในน้ำ อย่างไรก็ตามเมื่อสารละลายกรดเป็นกรดคุณสมบัติของไนเตรทเป็นสารออกซิแดนท์จะเพิ่มขึ้น
หน้า 1
สารประกอบไนโตรเจนออกซิเจนเป็นตัวอย่างที่ชัดเจนว่าคุณสมบัติของร่างกายมีการเปลี่ยนแปลงอย่างไรโดยมีการเปลี่ยนแปลงองค์ประกอบเชิงปริมาณ แรกคือก๊าซที่สองที่อุณหภูมิปกติเป็นตัวผลึกที่เป็นของแข็ง
สารประกอบไนโตรเจนออกซิเจนที่มีอยู่ทั้งหมดของสหรัฐฯบวกออกซิเดชันจาก 1 ถึงวี H2N2O2 กรด hyponitrous และเกลือ - giponitrity - เสถียรมากเมื่อถูกความร้อนมีออกซิไดซ์ที่อ่อนแอและคุณสมบัติลด
สารประกอบออกซิเจนของไนโตรเจนซึ่งมีความจุสูงกว่า - ไนโตรเจน N2O ไนโตรเจนกึ่งไนเตรตไนตริกไนตริก
สารประกอบไนโตรเจนออกซิเจนเป็นตัวอย่างที่ชัดเจนของวิธีการเปลี่ยนคุณภาพของศพเมื่อมีการเปลี่ยนแปลงองค์ประกอบเชิงปริมาณของพวกเขา แรกคือก๊าซที่สองที่อุณหภูมิปกติเป็นตัวผลึกที่เป็นของแข็ง
สารประกอบไนโตรเจนออกซิเจน (SU, V) จะถูกออกซิไดซ์ในเหลวแหลกกลางที่เป็นกรด PHG, RI ในการแก้ปัญหาในรูปแบบสารที่ละลายน้ำ
ลองพิจารณาสารประกอบออกซิเจนของไนโตรเจน
NO2X ความสามารถของออกซิเจนในสารประกอบไนโตรเจนและซับซ้อน eoobrazovaniyu-ไนเตรปฏิกิริยาจะต้องมีการกำหนดเป็น electrophilicity และการประสานงานไม่อิ่มตัวไนโตรเจนอะตอม สำหรับการประสานงานกิจกรรมเดียวกันจำนวน electrophilicity ถูกกำหนดใช้งานมากที่สุดคือ nitronium ฟรีไอออนบวก ONO การละลายจะช่วยลดกิจกรรมได้มาก ลดการออกเสียงลงคะแนนเข้ากลุ่มไนโตรนิวเคลียสที่มีอุณหภูมิเพิ่มขึ้น Titov อธิบายการลดลงของ solvation nitronium ไอออนบวก
ออกซิเจนเคมีไนโตรเจนและฟอสฟอรัสสารที่เราได้กล่าวไปแล้ว ตอนนี้เราต้องพิจารณาองค์ประกอบของกลุ่มย่อย A และ B เคมีสารประกอบออกซิเจนวานาเดียม electropositive อย่างน้อยขององค์ประกอบทั้งหมดของกลุ่มย่อยที่คล้ายกันในหลายประการเคมีฟอสฟอรัส เนื่องจากทั้งสององค์ประกอบมีหมายเลขการประสานงานเดียวกันด้วยความเคารพออกซิเจนสารประกอบไฮดรอกซีสูตรเดียวกันมีโครงสร้างที่คล้ายกันและมักจะมีรูปร่างสัณฐานเหมือนกันกับแต่ละอื่น ๆ เช่นเดียวกับสารประกอบที่สอดคล้องกัน isomorphic ของสารหนู ยกตัวอย่างเช่น isomorphic มี dodekagid-Rata Na3PO4, Na3AsO4, Na3VO4 เช่นเดียวกับเกลือที่ซับซ้อนของ R3 (PO4) C1, PB5 (AsOJCl และ PB5 (VO4) Cl วาเนเดียมกระจายอยู่ทั่วไปในธรรมชาติ ;. มันมักจะเกิดขึ้นร่วมกับฟอสฟอรัสในรูปแบบของวานาเดียมไอเอ็นจี (เงินฝากขนาดใหญ่หายากแร่ patronita VSB นอกจากนี้ยังมีแหล่งที่มาของวานาเดียมที่สำคัญมาก) และไนโอเบียมและแทนทาลัมจะพบกับการเปลี่ยนแปลงอื่น ๆ หรือโลหะหายากเป็นที่รู้จักกันออร์โธ. - เมตาดาต้า - และ pyrovanadate แต่ระดับของความมั่นคงของสารเหล่านี้ในการแก้ปัญหาน้ำของผกผันของ phospha สอดคล้องต้านทาน s
สารประกอบออกซิเจนของไนโตรเจนประกอบด้วยไนโตรเจนออกไซด์ไนตริกและกรดไนตรัสและเกลือของสารเหล่านี้
สารประกอบออกซิเจนไนโตรเจนในอะตอมไนโตรเจนหนึ่งมีตั้งแต่ 0 5-3 อะตอมออกซิเจน อะตอมไนโตรเจนสามารถยึดหรือสูญเสียอะตอมออกซิเจนบางส่วนหรือทั้งหมดขึ้นอยู่กับเงื่อนไข
เช่นเดียวกับสารประกอบไนโตรเจนทั้งหมดไนโตรเจนออกไซด์เป็นสารประกอบความร้อนและมีออกซิเจนในตัวเป็นโรคเรื้อน ดังนั้นไฮโดรเจน, ถ่านหิน, น้ำมันก๊าดและสารที่ติดไฟอื่น ๆ การเผาไหม้ในนั้นเช่นเดียวกับในเปลวไฟออกซิเจนบริสุทธิ์ที่มีรัศมีสีฟ้ากว้าง
เช่นเดียวกับสารประกอบออกซิเจนทั้งหมดของไนโตรเจนไนตรัสออกไซด์ของมันเป็นสารประกอบความร้อนที่มีออกซิเจนอยู่ในสภาพไม่มั่นคง ดังนั้นไฮโดรเจนถ่านหินน้ำมันก๊าดและสารอื่น ๆ ที่ติดไฟได้ เผาไหม้ในมันเช่นเดียวกับในออกซิเจนบริสุทธิ์เปลวไฟที่มีกลิ่นอายสีน้ำเงินกว้าง
ออกไซด์ของไนโตรเจนและออกซิเจนสารประกอบองศาที่แตกต่างกันของการเกิดออกซิเดชันมีการผลิตโดยการเกิดออกซิเดชันของแอมโมเนียไนโตรเจนออกไซด์ในตอนแรก (กระบวนการเร่งปฏิกิริยา) แล้วจะถูกออกซิไดซ์ได้อย่างง่ายดายโดยบรรยากาศออกซิเจนจนกรดไนตริก
บทเรียนเคมีเรื่องย่อในระดับ 9 ชื่อ "สารประกอบออกซิเจนไนโตรเจน" สำหรับ O.S.Gabrielyana ซับซ้อนการศึกษา การทำงานมีจุดมุ่งหมายที่จะต้องพิจารณาคุณสมบัติออกซิเดชันมีเพศสัมพันธ์เช่นไนโตรเจนออกซิเจนไอออน soedineniy.Konspekt ประกอบด้วยการศึกษาพัฒนาการศึกษาและปัญหาสุขภาพที่ประหยัด
ดาวน์โหลด:
ตัวอย่าง:
หากต้องการใช้ตัวอย่างงานนำเสนอของคุณสร้างบัญชีด้วยตนเอง (บัญชี Google) และเข้าสู่ระบบ: https://accounts.google.com
ลายเซ็นไปยังสไลด์:
สารออกซิเจนของไนโตรเจน
ออกไซด์ของไนโตรเจน ไนโตรเจนเป็นสารประกอบออกซิเจนหกชนิด องศาออกซิเดชัน + 1 N 2 O + 2 NO + 3 N 2 O 3 + 4 NO 2, N 2 O 4 + 5 N 2 O 5
เตรียม NH 4 NO = N 2 O + 2H 2 O คุณสมบัติทางเคมี 1. การสลายตัวด้วยความร้อน 2 N 2 O 1 = 0 2 N 2 + O 2 2 N 2 ไฮโดรเจน 1 O + H 2 = N 2 0 + H 2 O nesoleobrazuyuschy 1 N 2 O ไนตริกออกไซด์ (I), ไนตรัสออกไซด์หรือ "ก๊าซหัวเราะ" มีผลต่อการกระตุ้นต่อระบบประสาทของมนุษย์จะใช้ในการแพทย์เป็นยาชา คุณสมบัติทางกายภาพ: ก๊าซไม่มีสีและกลิ่น มันแสดงให้เห็นคุณสมบัติออกซิไดซ์ได้อย่างง่ายดายสลายตัว
NO 2 เตรียม: 1. ในธรรมชาติ: N 2 + O 2 = 2NO 2. ในอุตสาหกรรม: 4 NH 3 + 2 = 5o 4NO + 6H 2 O คุณสมบัติทางเคมี 1. ออกซิไดซ์ได้อย่างง่ายดาย: 2 N 2 O 2 + O = 2N 4 O 2 สันดาป 2. 2 N 2 O + 2 = 2SO 2SO 3 + N 2 0 ก๊าซไม่มีสี nesoleobrazuyuschy มั่นคงความร้อนไม่ดีที่ละลายในน้ำจริงทันทีปฏิกิริยากับออกซิเจน (ที่อุณหภูมิห้อง)
N 2 O 3 คุณสมบัติทางเคมี 3: NO 2 + NO N 2 O 3 เตรียมคุณสมบัติทั้งหมดอยู่ออกไซด์ที่เป็นกรด ของเหลวที่เป็นกรดออกไซด์สีฟ้าเข้มไม่มั่นคงความร้อน, เสื้ออุ่น. = 3.5 0C, ม. e. มีสภาพคล่องเฉพาะภายใต้การระบายความร้อนภายใต้สภาวะปกติกลายเป็นสถานะเป็นก๊าซ เมื่อทำปฏิกริยากับน้ำฟอร์มกรดไนตรัส
NO 2 + เตรียม 4: 1 2 NO + O 2 = 2NO 2 2. Cu + 4HNO 3 (ไป) = Cu (NO 3) 2 + 2 + 2NO 2H 2 O คุณสมบัติทางเคมี: 1 กับน้ำ 2 NO 2 + H 2 O = HNO 3 + HNO 2 2. ด่าง 2NO 2 + 2NaOH = Nano 3 + Nano 2 + H 2 O 3. dimerization 2NO 2 N 2 O 4 สารพิษไนโตรเจนออกไซด์ (IV) หรือก๊าซไนโตรเจนไดออกไซด์, ก๊าซสีน้ำตาลอย่างดี ละลายในน้ำได้อย่างเต็มที่ทำปฏิกิริยากับมัน เป็นตัวออกซิไดซ์ที่แรง
N 2 O 5 + 5 เตรียม: 1. 2NO 2 + O = 3 N 2 O 5 O 2 + 2 2HNO 3 + P 2 O 5 = 2HPO 3 + N 2 O 5 เคมีคุณสมบัติ: 1. ได้อย่างง่ายดายย่อยสลาย 2N 2 O 5 = 4NO 2 + O 2 2. สารต้านอนุมูลอิสระที่แข็งแกร่งเป็นกรดไนตริกออกไซด์ (V), ก๊าซไนโตรเจนไดออกไซด์, ของแข็งสีขาว (MP. = 41 C 0) มันแสดงให้เห็นคุณสมบัติที่เป็นกรดเป็นตัวออกซิไดซ์ที่แข็งแกร่งมาก
HNO 3 องค์ประกอบ โครงสร้าง สรรพคุณ H O N O O - - ระดับของการเกิดออกซิเดชันของไนโตรเจนไนโตรเจนจุ 5 IV พันธะเคมีโควาเลนต์ขั้วโลกกรดไนตริก - ไม่มีสีของเหลวดูดความชื้น, C กลิ่นฉุน "สูบบุหรี่" ในอากาศไปเรื่อย ๆ ละลายในน้ำ T จุดหลอมเหลว -41.59 ° C, จุดเดือด +82.6 ° C มีการสลายตัวบางส่วน เมื่อเก็บแสงจะถูกย่อยสลายกลายเป็นไนโตรเจนออกไซด์ (IV), ออกซิเจนและน้ำได้มาเป็นสีเหลือง: 4HNO 3 2 = 4NO + O 2 + 2H 2 O กรดไนตริกเป็นพิษ
กรดไนตริก (HNO 3) การจำแนกประเภทโดย: การปรากฏตัวของออกซิเจน: ด่าง: ละลายน้ำ: การระเหย: ระดับของการไฟฟ้าแยกออกจากออกซิเจนที่ละลายใน monobasic ระเหยที่แข็งแกร่ง
การเตรียมความพร้อมของอุตสาหกรรมกรดไนตริก NH 3 NO NO 2 HNO 3 4NH 3 + 5o 2 = 4NO + 6H 2 O 2NO + O 2 = 2NO 2 4 NO 2 + 2 H 2 O + O 2 = 4 HNO 3 ติดต่อแอมโมเนียออกซิเดชันออกไซด์ ไนโตรเจน (II): 2 ออกซิเดชันของไนโตรเจนออกไซด์ (II) ไนตริกออกไซด์ (IV): 3 การดูดซับ (การดูดซึม) ของไนตริกออกไซด์ (IV) โดยน้ำที่มีส่วนเกินออกซิเจน
ในห้องปฏิบัติการที่ได้รับจากการกระทำของกรดไนตริกกรดซัลฟูริกเข้มข้นเพื่อไนเตรตภายใต้ความร้อนอ่อน Nano 3 + H 2 SO 4 = NaHSO 4 + HNO 3
สมบัติทางเคมีของกรดไนตริกกรดไนตริกแสดงคุณสมบัติทั่วไปของกรด 1 คุณสมบัติ HNO 3 เป็นอิเล็กโทร: 1 3 2 3 2) ที่มีพื้นฐานและ amphoteric ออกไซด์ 3) ที่มีฐาน 1) ความร้าวฉาน: HNO 3 = H + + NO 3 - 2HNO 3 + ออกไซด์ = Cu (NO 3) 2 + H 2 O 6HNO 3 + Al 2 O 3 = 2AL (NO 3) 3 + 3H 2 O HNO 3 + NaOH = Nano 3 + H 2 O 2HNO 3 + Zn (OH) 2 = Zn (NO 3) 2 + 2H 2 O 4) เกลือ 2HNO 3 + นา 2 SiO 3 = h 2 SiO 3 ↓ + 2NaNO 3
2 คุณสมบัติ Oxidative: ปฏิสัมพันธ์โดยเฉพาะอย่างยิ่งกับโลหะ (! กรดไนตริกไม่เคยจัดสรรไฮโดรเจน) ฉัน + HNO 3 = ฉัน (NO 3) 2 + H 2 ความเข้มข้น↑โลหะ - โร (\u003e 60%) ไนย์เจือจาง (5-60%) เจือจางมาก (
ตั้งแต่โลหะยืนชุดไฟฟ้าด้านซ้ายของไฮโดรเจนโลหะ C ยืนอยู่ในชุดไฟฟ้าไฮโดรเจนขวา: เข้มข้น HNO 3 HNO 3 ปรับลดคุณสมบัติทางเคมีของกรดไนตริก
2 สถานที่ให้บริการออกซิไดซ์ 2) การปฏิสัมพันธ์คุณสมบัติที่มีอโลหะ (S, P, C): 3) มีการโต้ตอบกับสารอินทรีย์ (น้ำมันสนกะพริบ): คุณสมบัติทางเคมีของกรดไนตริก 3P + 5HNO 3 + H 2 O = 3H 3 PO 4 + 5NO C + 4HNO 3 = CO 2 + H 2 O + 4NO 2 HNO 3 + 5 3 P + H 2 O → 2 H 3 PO 4 + 3 NO 5
การใช้กรดไนตริก 1 5 4 6 2 3 การผลิตไนโตรเจนและปุ๋ยที่ซับซ้อน วัตถุระเบิดการผลิตการผลิตยาสีย้อมการผลิตภาพยนตร์ nitrovarnishes, nitroenamels การผลิตเส้นใยประดิษฐ์ 7 ในฐานะที่เป็นส่วนประกอบของกรดไนเตรตกับโลหะในโลหะสืบค้น
ไนเตรต - เกลือกรดไนตริก, จัดทำขึ้นโดยการกระทำของกรดบนโลหะออกไซด์และไฮดรอกไซ Saltpeter - เกลือของกรดไนตริกและโลหะอัลคาไล Nano 3 - โซเดียมไนเตรต KNO 3 - ดินประสิว NH 4 NO 3 - แอมโมเนียมไนเตรต Ca (NO 3) 2 - แคลเซียมไนเตรทคุณสมบัติทั้งหมดที่ละลายในน้ำ
เมื่อความร้อน, ไนเตรตจะถูกย่อยสลายสมบูรณ์ยิ่งขึ้นกว่าที่เป็นโลหะที่ด้านขวารูปเกลือในความเครียดชุดไฟฟ้า Li K บา Ca นา Mg Al Mn Zn Cr เฟ Co Sn Pb Cu Ag ปรอท Au ไนไตรท์ + O 2 โลหะออกไซด์ + NO 2 + O 2 Me + NO 2 + O 2 2NaNO 3 = 2NaNO 2 + O 2 2PB (NO 3) 2 = 2PbO + 4NO + O 2 2 3 2AgNO = 2AG + 2NO 2 + O 2
ไนเตรทถูกใช้เป็นปุ๋ย KNO 3 ใช้ในการเตรียมผงสีดำ
การบ้าน: § 26, การออกกำลังกาย 2.4 หน้า 121
บทคัดย่อบทเรียนเรื่อง "สารออกซิเจนของไนโตรเจน" เกรด 9
วัตถุประสงค์ของบทเรียนคือการศึกษาคุณสมบัติของไนโตรเจนออกไซด์
วัตถุประสงค์:
การศึกษา: เพื่อพิจารณาไนโตรเจนออกไซด์และในตัวอย่างของพวกเขาที่จะทำซ้ำการจัดหมวดหมู่และคุณสมบัติพื้นฐานของออกไซด์;
การศึกษา: การก่อตัวของภาพทางวิทยาศาสตร์ของโลก;
การพัฒนา: การพัฒนาความคิดเชิงตรรกะความสามารถในการทำงานร่วมกับวรรณกรรมเพิ่มเติมความสามารถในการพูดคุยและจัดระบบ
หลักสูตรของบทเรียน
ช่วงเวลาขององค์กร
ทำซ้ำวัสดุที่ศึกษา
นักเรียนหลายคนทำงานกับบัตรและคนอื่น ๆ ได้ทำการสำรวจบรรทัดแรกในหัวข้อก่อนหน้านี้
หมายเลขบัตรข้อมูลดิฉัน 1
a) เขียนสูตรสำหรับสารต่อไปนี้: แอมโมเนีย, แอมโมเนีย, แอมโมเนีย
ปฏิกิริยาเชิงคุณภาพต่อไอออนบวกของแอมโมเนียม
ปฏิสัมพันธ์ของแอมโมเนียมซัลเฟตกับแบเรียมคลอไรด์
หมายเลขบัตรการสอน 2
a) เขียนสูตรสำหรับสารต่อไปนี้: แอมโมเนียม dichromate, แอมโมเนีย, แอมโมเนียมซัลเฟต
b) เขียนสมการปฏิกิริยาต่อไปนี้:
ปฏิสัมพันธ์ของแอมโมเนียมคลอไรด์กับไนเตรตเงิน
ปฏิสัมพันธ์ของแอมโมเนียมคาร์บอร์กับกรดไฮโดรคลอริก
การสำรวจหน้าผาก:
1) "แอมโมเนีย" คืออะไร? อะไรที่ใช้สำหรับ?
2) คุณสมบัติของแอมโมเนียเป็นพื้นฐานของการใช้งานในระบบทำความเย็นอย่างไร?
3) ควรเก็บแอมโมเนียอย่างไร? ทำไม? แอมโมเนียสามารถจำได้อย่างไร?
5) แอมโมเนียคืออะไร? อะไรที่ใช้สำหรับ?
6) การใช้คาร์บอเนตและแอมโมเนียมไบคาร์บอเนตคืออะไร?
3. การปรับปรุงความรู้
จัดเรียงสถานะออกซิเดชันในไนโตรเจนออกไซด์:
N 2 O NO 2 O 3 NO 2 N 2 O 5
การเรียนรู้เนื้อหาใหม่
ครูรายงานหัวข้อเป้าหมายและแผนของบทเรียน
แผน:
การจำแนกประเภทไนโตรเจนออกไซด์
ข้อความของนักเรียนเกี่ยวกับหัวข้อ: "ประวัติความเป็นมาของการค้นพบไนตริกออกไซด์ (I)"
สมบัติทางกายภาพของไนโตรเจนออกไซด์ (การทำงานอิสระกับข้อความในตำราเรียน)
สมบัติทางเคมีการผลิตและการใช้ไนโตรเจนออกไซด์ (เรื่องราวและคำอธิบายของครู)
การจำแนกประเภทไนโตรเจนออกไซด์ นักเรียนทำโครงงานให้เสร็จสมบูรณ์พร้อมกับครู
โอ้  ไนโตรเจน ksidy
ไนโตรเจน ksidy
เกลือที่ไม่ละลายน้ำ
N 2 O NO N 2 O 3 → HNO 2
ไม่โต้ตอบกับกรด N 2 O 5 → HNO 3
ไม่มีทั้งด่างและเกลือของ NO 2 → HNO 2 และ HNO 3
รายงานนักเรียน ในหัวข้อ: "ประวัติความเป็นมาของการค้นพบไนตริกออกไซด์ (ผม)».
ก๊าซร่าเริง
นักเคมีชาวอเมริกันคนหนึ่งในปี ค.ศ. 1800 ได้ศึกษาปฏิสัมพันธ์ของกำมะถันกับสารละลายโซเดียมไนไตรท์ NaNO 2 ที่ให้ความร้อนใน formamide HCONH 2 ทันใดนั้นปฏิกิริยารุนแรงเริ่มต้นด้วยการปล่อยแก๊สที่มีกลิ่นอ่อน ๆ Wodehouse ก็เริ่มร่าเริงและเขาก็เริ่มเต้นร้องเพลง วันรุ่งขึ้นกลับไปที่ห้องทดลองเขาพบผลึกของโซเดียมไธโอซัลเฟต Na2S2O3 ในขวดที่การทดลองเกิดขึ้น เกือบจะในเวลาเดียวกันนักเคมีชาวอังกฤษชื่อ Gemfri Devi ได้ทำการปลดปล่อยความร้อนของ NH 4 NO 3 ammonium nitrate ในขณะที่เขานึกขึ้นมาภายหลังผู้ช่วยใกล้ชิดกับการติดตั้งและหลายครั้งที่เขาสูดดมก๊าซที่มีกลิ่นหอมออกมาจากการโต้แย้ง ทันใดนั้นผู้ช่วยก็โผล่เข้าหัวเราะอย่างไม่สมควรแล้วก็ตกลงไปในมุมห้องและหลับไปทันที
นักวิทยาศาสตร์ได้รับก๊าซไนตริกออกไซด์ (I) N 2 O เดียวกัน
สูตรออกไซด์
สมบัติทางกายภาพ
สมบัติทางเคมี
การเตรียมและการประยุกต์
N 2 O
ไม่มีสีไม่มีชีวิตชีวากับขนมหวานที่น่ารื่นรมย์และ
2N 2O → 2N 2 + O 2
NH 4 NO 3 → N 2 O + 2H 2 O
ความเข้มข้นของไนตรัสออกไซด์มีน้อยทำให้ง่าย(เพราะฉะนั้นชื่อ - "หัวเราะแก๊ส") เมื่อสูดดมก๊าซบริสุทธิ์จะพัฒนาความมึนเมาและง่วงนอนได้อย่างรวดเร็ว ไนตรัสออกไซด์มีกิจกรรมยาเสพติดที่อ่อนแอซึ่งเกี่ยวข้องกับยาที่ใช้ในปริมาณที่สูง.
ก๊าซที่ไม่มีสีละลายได้ไม่ดีในน้ำ
2NO + O2 → 2NO2
4 NH 3 + 5O 2 → 4NO + 6H 2 O
การผลิต NO เป็นหนึ่งในขั้นตอนการผลิต
NO 2
ก๊าซพิษสีแดงน้ำตาลที่มีกลิ่นเฉียบพลันลักษณะพิเศษหรือของเหลวสีเหลือง หางของสุนัขจิ้งจอก
NO 2 + H 2 O → HNO 2 + HNO 3
4NO 2 + H 2 O + O 2 → 4HNO 3
2NO 2 + 2NaOH → NaNO 3 + NaNO 2 + H 2 O
2Cu (NO 3) 2 → 2CuO + 4NO 2 + O 2
ในการผลิตและเป็นตัวออกซิไดซ์ในของเหลวและวัตถุระเบิดผสมเป็นพิษสูง ทำให้เกิดการระคายเคืองต่อระบบทางเดินหายใจในกรณีที่ความเข้มข้นสูงNO + NO 2 = N 2 O 3
ใช้ในห้องปฏิบัติการในการผลิตกรดไนตรัสและเกลือของมัน เป็นพิษสูง โดยการทำงานของร่างกายเปรียบได้กับกรดไนตริกที่ทำให้เป็นแผลไหม้ทำให้ผิวหนังไหม้อย่างรุนแรง
N 2 O 5
ไม่มีสี, ระเหยง่ายคริสตัล ไม่เสถียรมากนัก
N 2 O 5 + H 2 O = 2H N O 3
N 2 O 5 + CaO = Ca (NO 3) 2
N 2 O 5 + 2 NaOH = 2NaNO 3
2NO 2 + O 3 = N 2 O 5 + O 2
N 2 O 5 เป็นพิษ
4.Zakreplenie Upr.6
5. การสะท้อนข้อสรุป การประเมินผล.
§บ้าน 26